術後せん妄患者のDNAメチル化プロファイルを検証する研究はこれまでなかった.本研究では,治療抵抗性てんかんに対する脳切除術を受けた患者の手術前後の血液を集め,術後せん妄と関連するDNAメチル化マーカーを発見することを目的とした.10名の術後せん妄症例を含む37名の患者の手術前後の血液を入手し,DNAサンプルをIllumina社EPICアレイゲノム網羅的プラットフォームを用いて測定した.術後せん妄の有無による血液中のDNAメチル化の差異を検討し,さらにGene OntologyおよびKyoto Encyclopedia of Genes and Genomesによるエンリッチメント解析も実施した.術後せん妄症例について,手術前後のDNAメチル化の変化を調べたところ,エンリッチメント解析により,「サイトカイン刺激に対する細胞応答」「免疫系プロセスの制御」「細胞活性化の制御」「サイトカイン産生の制御」といった免疫応答関連経路や炎症性サイトカイン関連経路に統計的に有意な関連シグナルが多く見いだされた.さらに,術後せん妄症例と非術後せん妄症例の間の手術や麻酔に関連する共通因子の影響の可能性を除外した後のエンリッチメント解析では,「免疫反応」や「T細胞の活性化」などの有意なシグナルが示された.術後せん妄に関してゲノム網羅的にDNAメチル化を検証した本研究では,免疫反応,炎症反応,およびせん妄の病態生理に関連すると考えられる他の関連シグナルに関連する有望なシグナルが示された.このデータは,エピジェネティクスがせん妄の病態生理学的メカニズムにおいて重要な役割を果たしているという仮説を支持し,エピジェネティクスに基づく術後せん妄のバイオマーカーの有用性の可能性を示唆するものであった.
2)アイオワ大学医学部精神科
3)鳥取大学医学部附属病院精神科
https://doi.org/10.57369/pnj.24-002
はじめに
術後せん妄は手術後に生じるせん妄であり,術後の事故リスクの上昇や対応する医療スタッフの疲弊といった短期的なデメリットのみでなく,長期的な認知機能低下や高い死亡率とも関連している13)14)17)20)34).せん妄リスクを評価すること,せん妄を早期に検出し対応することは重要であるが,そのためにはせん妄の病態を理解し,バイオマーカーを活用することが必要である.これまでの研究で,高齢のせん妄患者は,炎症マーカーやサイトカインの血清レベルが上昇していることが示されているが9)15)35)36),報告によるばらつきも大きく,さらなる分子機構の解明が求められる.
DNAメチル化(DNA methylation:DNAm)は遺伝子の発現を動的に制御する重要なエピジェネティクス機構であり22),せん妄の主要なリスク因子である加齢とともに制御されることが知られている8)19)29).これらのことから,DNAmはせん妄の分子機構を解明するための有望なターゲットであり,せん妄のバイオマーカーとして機能する可能性があることが示唆される30).これまでに著者らのグループは,せん妄患者において免疫反応,炎症反応,コリン作動性シナプス機能に関連した遺伝子のDNAmに違いがあること27),炎症性サイトカイン遺伝子であるTNF-αのDNAmが,せん妄症例では年齢とともに減少すること37),神経栄養因子遺伝子BDNFのDNAmが,せん妄患者において加齢とともに増加すること26),を報告してきた.これらの報告はDNAmがせん妄の病態に寄与しており,またバイオマーカーになることを示唆するものである.しかしこれらの先行研究におけるせん妄症例は,入院に至った経緯の異なる内科的・外科的疾患をもつ集団からのものであり,せん妄の病因が均一ではなかった.また,横断研究であることから,せん妄対象者にみられたエピジェネティックなシグナルが,せん妄そのものによるものか,せん妄の原因疾患によるものか,せん妄発症前の状態を反映したものか,不明であった.
このような限界を克服するため,本研究では治療抵抗性てんかんに対しててんかん外科治療を実施する患者を対象として手術前後で血液を収集し,術後せん妄(postoperative delirium:POD)に発展した患者におけるDNAmの特徴を見いだすことを目的とした41).
I.研究の方法および結果
1.リクルートと患者情報取得
本研究は,アイオワ大学のHuman Subjects Research Institutional Review Boardにより承認され実施した.2015年4月から2019年7月の間に,アイオワ大学病院で治療抵抗性てんかんのため脳切除手術が予定された被験者を募集した3)4).研究登録に際して,書面によるインフォームドコンセントを取得した.被験者が未成年の場合は,その両親から同意を得た.病歴,手術歴,人口統計情報を電子カルテと患者インタビューから入手した.脳切除術後にせん妄に発展したかを調査するために,詳細なカルテレビューを実施した.術後7日目,または退院のいずれか早いほうまでにせん妄を呈した患者をPOD群,せん妄に発展しなかった患者をnon-POD群とした.カルテに意識状態や精神状態の変動が記録されている場合か,Confusion Assessment Method for the ICU(CAM-ICU)陽性の記録がある場合にせん妄ありと判断した.
2.血液サンプル収集と処理
合計で37名の被験者から血液サンプルを入手した.手術室で手術の前後に全血を採取し,採取した全血を血球と血漿に遠心分離した後に-80°Cで保存した.血球からDNAを抽出し,各500 ngのDNAをバイサルファイト処理した.その後,Infinium HumanMethylationEPIC BeadChip Kit(WG-317-1002,Illumina,San Diego,CA,USA)を用いて,ゲノムワイドDNAmを解析した.アレイは,Illumina iScanプラットフォームでスキャンした.すべての統計解析にRを使用した23).メチル化データの解析には,RパッケージのChAMPとMinfiを使用した.データのロード中に,(i)検出P値>0.01,(ii)プローブあたり少なくとも5%のサンプルで<3ビーズ,(iii)非CpG,SNP関連,マルチヒットプローブ,(iv)XまたはY染色体に配置されている場合はプローブがフィルターアウトされた.サンプルをベータミクスチャー量子化で正規化してから差分メチル化分析を実行した.
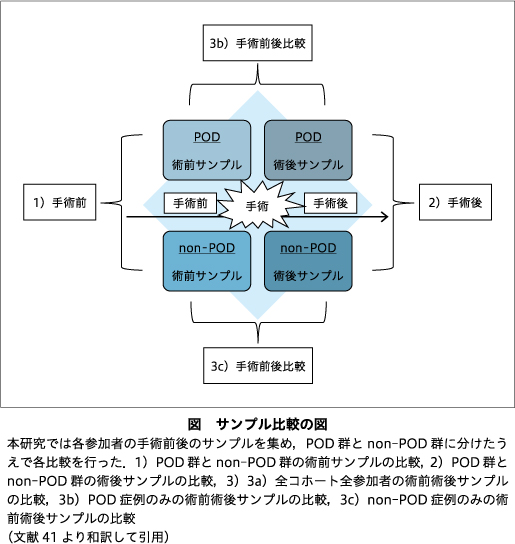
CD8 T細胞,CD4 T細胞,ナチュラルキラー細胞,B細胞,および単球の推定細胞比率は,オンラインで入手可能なDNAm Age Calculatorにより算出した10-12).各CpG部位におけるDNAメチル化の差は,RnBeadsによりlimma法を用いて評価した2)24).1)術前サンプル,2)術後サンプルにおいて,POD群とnon-POD群間のDNAmの差異を検証した.また,3)術前術後サンプル比較(3a)全コホート,3b)POD症例のみ,3c)non-PODコントロールのみ)により,術後のDNAmの変化を評価した(図).年齢,性別,および細胞タイプの割合を共変量として解析に含んだ.ゲノムワイドの有意性は,P値が5.0E-08未満であることとした.
エンリッチメント解析としてGene Ontology(GO解析)およびKyoto Encyclopedia of Genes and Genomes terms(KEGG解析)を行った.各エンリッチメント解析はRパッケージmissMethylを用いたgometh解析により,各遺伝子で検査したCpG部位の数が変動することを調整して行った21).limmaで抽出した各比較について,GO解析とKEGG解析でP<0.05の上位1,500のCpGサイトを含めて,潜在的に関連する経路を捕捉した.上記の術前・術後のサンプル比較の一環として,術前・術後POD症例群に特有のメチル化差のあるCpG部位セットを解析した.このCpG部位のサブセットは,以下のプロセスで決定した.(i)POD症例群とnon-POD対照群は,P<0.05のCpG部位についてフィルターにかけた.(ii)有意なCpGサイトの2つのサブセット間で共通するCpGサイトを決定した.(iii)共通するCpGサイトのセットを有意なPOD症例CpGサイトのセットから除去した.(iv)POD症例に固有のCpGサイトのこの新しいセットから,GOおよびKEGGパスウェイの変化を検出するために上位1,500CpGサイトを含めた.
3.結 果
1)参加者背景
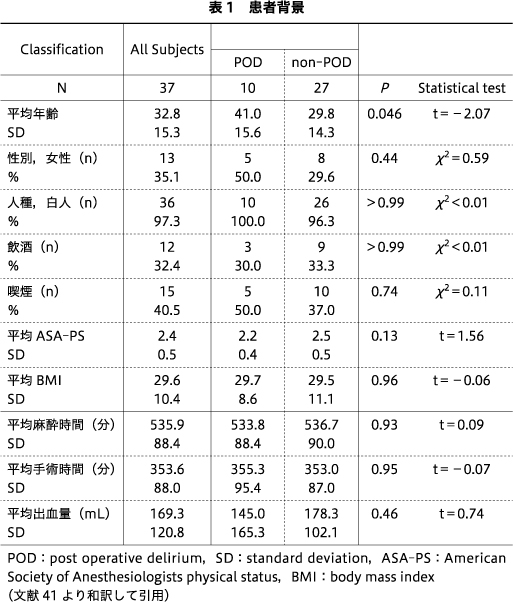
脳外科手術が予定され,本研究に登録された合計37名の患者の血液サンプルを入手した.患者の平均年齢は32.8歳(SD=15.3),35.1%が女性,97.3%が非ヒスパニック系白人であった.そのなかで,10名の患者が術後せん妄を発症し(POD群),27名が発症しなかった(non-POD群).POD群の平均年齢は41.0歳(SD=15.6),10名中5名(50.0%)が女性であった.non-POD群の平均年齢は29.8歳(SD=14.3),27名中8名(29.6%)が女性であった.PODのある患者とない患者では,年齢に有意差があった(表1).
2)エピゲノムワイド解析におけるPOD群とnon-POD群の比較
術前サンプルの比較,術後サンプルの比較のいずれにおいても,POD群とnon-POD群でDNAmレベルに有意に差があるCpGサイトはなかった.全患者,POD群,non-POD群の各集団において,術前と術後のサンプルを比較しても,手術前後で有意にDNAmレベルが変化したCpGサイトはなかった.
3)エンリッチメント解析(GO and KEGG)
術前サンプルの比較,術後サンプルの比較のいずれにおいても,POD群とnon-POD群で有意に差のあるパスウェイは確認されなかった.全患者を対象にして術前後のサンプルを比較した際に,エンリッチメント解析では,GO解析で「リポ多糖への反応」「炎症反応」「インターロイキン6産生」,KEGG解析で「NF-κBシグナル伝達経路」などのパスウェイが示されたが,これらはfalse discovery rate(FDR)有意水準には達していなかった.
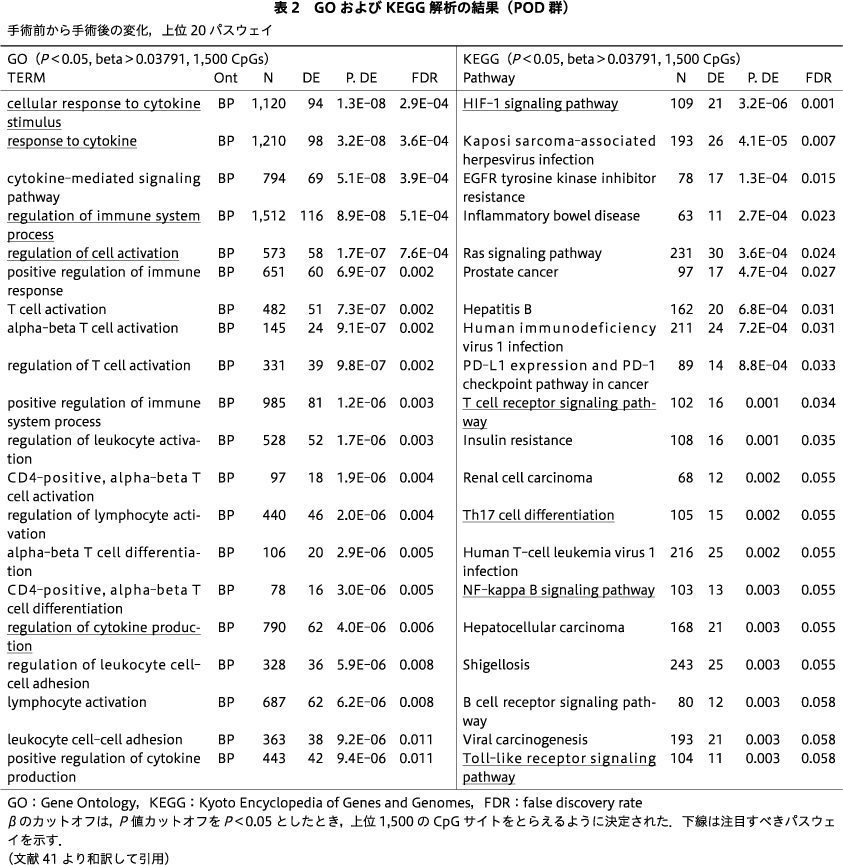
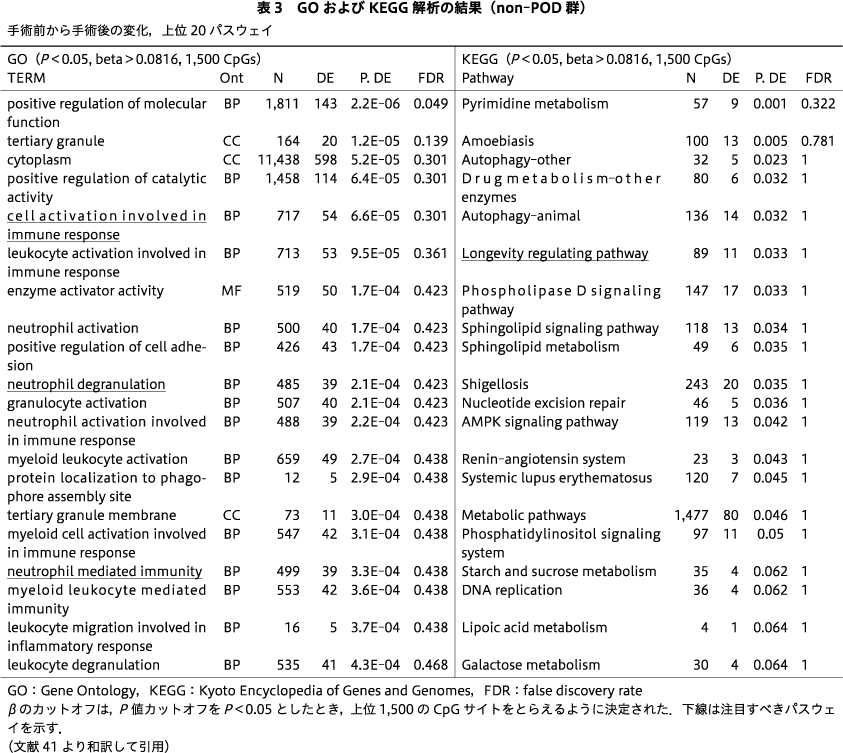
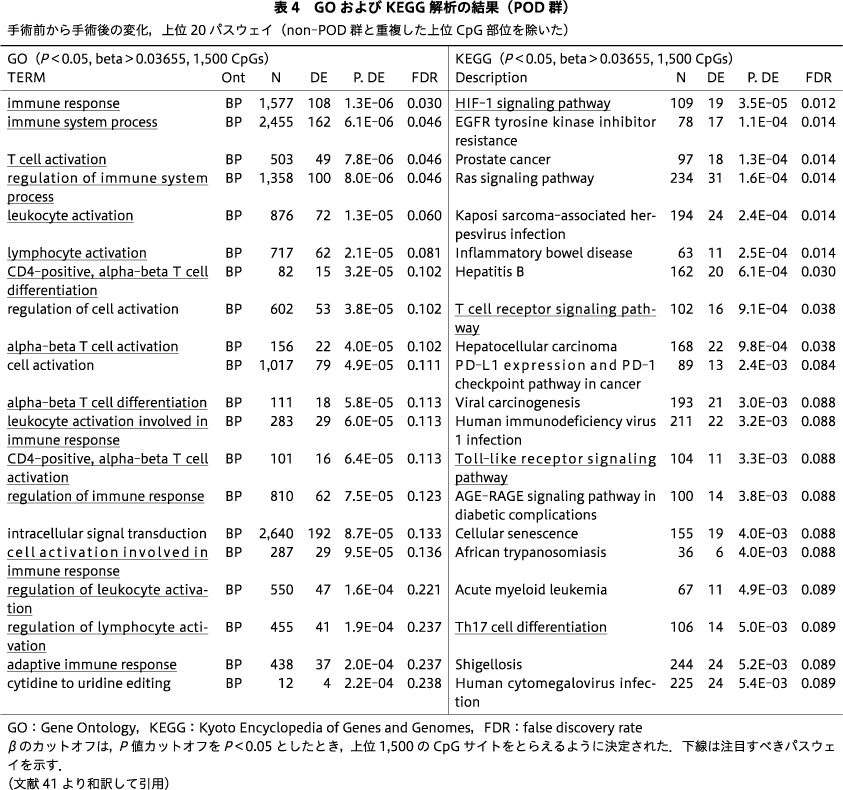
10名のPOD症例のみを対象に,手術前後のDNAmの変化をエンリッチメント解析で調べた.GO解析からは「サイトカイン刺激に対する細胞応答」「サイトカインに対する応答」「免疫系プロセスの制御」「細胞活性化の制御」「サイトカイン生産の制御」などのパスウェイ,KEGG解析からは「HIF-1シグナル伝達経路」「T細胞受容体シグナル伝達経路」「Th17細胞分化」「NF-κBシグナル伝達経路」「Toll様受容体シグナル伝達経路」といったパスウェイが,FDR有意水準,もしくは有意傾向(P=0.058)なものとして検出された(表2).一方,non-POD群の手術前後を比較したエンリッチメント解析では,GO解析で「免疫反応にかかわる細胞の活性化」「好中球の脱顆粒」「好中球を介した免疫」,KEGG解析で「長寿調節経路」などのパスウェイが示されたが,これらはFDR有意水準ではなかった(表3).
POD群とnon-POD群の間の手術や麻酔に関連する共通因子の影響を除いて比較するために,両群のいずれにおいても手術前後の変化としてとらえられたCpG部位をnon-PODから共通のシグナルとして除外し,手術後のせん妄の発症に関連するCpGサイトを抽出した.エンリッチメント解析の結果,上位のGOパスウェイは,FDR有意水準で「免疫反応」「免疫系プロセス」「T細胞活性化」「免疫系プロセスの制御」であった.KEGGパスウェイは,「HIF-1シグナル伝達経路」と「T細胞受容体シグナル伝達経路」をFDR有意水準で示した(表4).
II.考察―本研究の意義,苦労・工夫したことなどを含めて―
今回の研究では,術後せん妄のエピジェネティクスをゲノムワイドDNAm解析を用いて調査した.術後せん妄患者を対象として,手術前後のDNAmの変化を調べた研究は初である.今回のデータでは,POD症例において術前と術後のサンプルでサイトカインへの反応,免疫系プロセスの制御,細胞の活性化とサイトカイン生産,免疫反応のポジティブ制御など,術後せん妄に関連する多数のネットワークの重要なエビデンスを示した.さらに,術後せん妄の発症に関連するシグナルを手術や麻酔の潜在的な影響を除外してとらえるために解析したところ,免疫反応,T細胞の活性化,T細胞受容体のシグナル伝達経路,HIF-1のシグナル伝達経路が示された.実際,これらの上位シグナルは,過去にわれわれが検証した入院患者コホートから得られたせん妄患者と非せん妄患者の比較から得られた上位シグナルと一致している27).このデータは,術後せん妄が手術によって誘導されるプロセスだけでなく,せん妄の発症に影響を及ぼす動的なエピジェネティクスプロセスがあることを示唆している.
これまでの研究で,全身および脳の炎症がせん妄の発症に重要な役割を果たすことが示唆されている1)5)6)33).実際に,POD患者では血中および脳脊髄液中の炎症マーカーが上昇することが示されている16).免疫から脳への伝達経路がミクログリア細胞による炎症性サイトカイン産生につながるため,末梢で産生されたサイトカインが脳に作用して異常行動を引き起こすと考えられている7).実際,げっ歯類に末梢性リポ多糖を注射したり,開腹手術や肝切除などの外科手術を行うことで,脳内でIL-1β,IL-6,TNF-αなどの炎症性サイトカインが増加し,認知障害関連行動を引き起こすことが示されている28).手術によるエピジェネティクスの影響についてはSadahiro, R.らの報告が新しく,高齢者を対象とした種々の手術により,末梢血単核球(peripheral blood mononuclear cells:PBMC)の免疫系遺伝子のDNAmの急速な変化がもたらされることが示されており,今回のデータと一致している25).本研究は,エピジェネティックな観点からせん妄の病態生理の理解をさらに深めるものであり,エンリッチメント解析で観察されたPOD患者における炎症と免疫に関連する遺伝子のDNAmの変化は,末梢の炎症と免疫,そしてその後の神経炎症とせん妄の発症に関与していることが示唆される.
この研究にはいくつかの強みがある.まず,手術の種類は治療抵抗性てんかんに対する脳外科手術のみであったことである.したがって,本研究の参加者は,コホート全体で比較的類似した侵襲を経験したことになる.これは,多様な背景とせん妄の病因をもつ入院患者を用いたわれわれの以前のアプローチと比較して,決定的な利点である26)27)37).第2に,手術前サンプル採取の設計により,同一人物から手術前と手術後の比較を行い,DNAmシグナルに対する手術の影響を直接測定し,POD症例とnon-POD症例の間の違いを見つけることができたことである.手術後の血液は,PODが発症する前の時期である手術直後に採取された.そのため,発症前から血液データに基づいて,PODに関連するエピジェネティクスの状態の違いをみることができた.手術後,POD発症前に確認された血液に基づくこのようなバイオマーカーは,症状が出現する前からハイリスク患者を特定できる可能性があり,今後の臨床に有用であると考えている.第3に,術前サンプルから得られたDNAmプロファイルは,PODの予測バイオマーカーとして使用できる可能性があることである.今回のデータでは,術前サンプルとの有意な差は認められなかったが,サンプルサイズが大きくなれば,PODの予測に使用できるシグナルが見つかる可能性がある.このようなデータが再現され,確認されれば,術前のDNAmプロファイルに基づくアルゴリズムは,PODの高リスク患者を特定するのに役立ち,適切な介入と予防を採用することができる.全体として,今回のデータは,われわれの仮説と一致し,せん妄の病態生理過程におけるエピジェネティクス機構を支持するものである.
III.展望―今後の課題および方向性―
本研究には以下に記すようにいくつかの限界があり,これらを克服することが同時に今後の課題である.(i)サンプルサイズが小さく,合計37名であり,POD群が10名であったこと.(ii)対象患者が脳切除術を受ける患者であり,脳に直接侵襲が加わった後のせん妄を研究対象としている.さらに,対象患者の年齢層が比較的若い.一般に臨床の場で広くみられるせん妄,すなわち高齢者において中枢以外の身体的問題によって生じるせん妄に,今回の研究結果を般化させることに限界がある.(iii)POD群とnon-POD群の間で,ゲノムワイドレベルで有意な差をもつ遺伝子やCpG部位を発見できなかったこと.(iv)今回のデータは,エピジェネティクスシグナルとPODの関連を示したが,因果関係を示唆するものではないこと.(v)本研究は単一の施設で実施され,被験者の多くは非ヒスパニック系の白人であったこと.(vi)PODの定義が,電子カルテのレトロスペクティブなチャートレビューにのみ依存しており,偽陽性または偽陰性の症例が存在する可能性があること.これらの限界を克服し,高齢者に広くみられるせん妄に般化できるエピジェネティクスな機序を解明するために,高齢者の大腿骨頸部骨折や悪性腫瘍,心血管系に対する手術におけるエピジェネティクス研究を実施することは重要である.
おわりに
これまでせん妄は症状を観察や問診でとらえることで評価してきた.すなわち,せん妄の診断基準や,せん妄のスクリーニングツールが用いられてきた.時にはベテランスタッフによる「この患者さん,せん妄になりそう」といった直感(それは山勘ではなく,数値化,言語化が難しい,微細なせん妄症状をとらえているのであろうが)がせん妄の早期発見に役立ってきた.これらは無論重要な評価方法であるが,同時に生物学的な機序を理解したうえで,客観的な指標があることで,スタッフや施設による評価のばらつきを少なくすることができる.著者らはこれまでに小型脳波デバイスを用いたせん妄検出に関する研究もしてきており18)31)32)38-40),これらのアプローチを組み合わせることで,せん妄の予測,早期検出が可能になり,ハイリスク患者に早期介入するといったアプローチが可能となることが期待される.
本論文はPCN誌に掲載された最新の研究論文41)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
利益相反
篠崎元はPredelix Medical LLCの共同創設者であるが,それに附随する過去の収入はない.また,住友ファーマ株式会社より共同研究費を受けている.山梨豪彦は本論文に関連して開示すべき利益相反はない.
1) Alam, A., Hana, Z., Jin, Z., et al.: Surgery, neuroinflammation and cognitive impairment. EBioMedicine, 37; 547-556, 2018![]()
2) Assenov, Y., Müller, F., Lutsik, P., et al.: Comprehensive analysis of DNA methylation data with RnBeads. Nat Methods, 11 (11); 1138-1140, 2014![]()
3) Braun, P. R., Han, S., Hing, B., et al.: Genome-wide DNA methylation comparison between live human brain and peripheral tissues within individuals. Transl Psychiatry, 9 (1); 47, 2019![]()
4) Braun, P. R., Tanaka-Sahker, M., Chan, A. C., et al.: Genome-wide DNA methylation investigation of glucocorticoid exposure within buccal samples. Psychiatry Clin Neurosci, 73 (6); 323-330, 2019![]()
5) Cerejeira, J., Firmino, H., Vaz-Serra, A., et al.: The neuroinflammatory hypothesis of delirium. Acta Neuropathol, 119 (6); 737-754, 2010![]()
6) Cunningham, C., Maclullich, A. M. J.: At the extreme end of the psychoneuroimmunological spectrum:delirium as a maladaptive sickness behaviour response. Brain Behav Immun, 28; 1-13, 2013![]()
7) Dantzer, R., O'Connor, J. C., Freund, G. G., et al.: From inflammation to sickness and depression: when the immune system subjugates the brain. Nat Rev Neurosci, 9 (1); 46-56, 2008![]()
8) Day, K., Waite, L. L., Thalacker-Mercer, A., et al.: Differential DNA methylation with age displays both common and dynamic features across human tissues that are influenced by CpG landscape. Genome Biol, 14 (9); R102, 2013![]()
9) Dillon, S. T., Vasunilashorn, S. M., Ngo, L., et al.: Higher C-reactive protein levels predict postoperative delirium in older patients undergoing major elective surgery: a longitudinal nested case-control study. Biol Psychiatry, 81 (2); 145-153, 2017![]()
10) Horvath, S.: DNA methylation age of human tissues and cell types. Genome Biol, 14 (10); R115, 2013![]()
11) Horvath, S.: Clock Foundation Team: DNA Methylation Age Calculator. 2019 (https://dnamage.genetics.ucla.edu/home) (参照2023-10-11)
12) Houseman, E. A., Accomando, W. P., Koestler, D. C., et al.: DNA methylation arrays as surrogate measures of cell mixture distribution. BMC Bioinformatics, 13; 86, 2012![]()
13) Inouye, S. K.: Delirium in older persons. N Engl J Med, 354 (11); 1157-1165, 2006![]()
14) Inouye, S. K., Westendorp, R. G., Saczynski, J. S.: Delirium in elderly people. Lancet, 383 (9920); 911-922, 2014![]()
15) Khan, B. A., Zawahiri, M., Campbell, N. L., et al.: Biomarkers for delirium: a review. J Am Geriatr Soc, 59 (Suppl 2); S256-261, 2011![]()
16) Liu, X., Yu, Y., Zhu, S.: Inflammatory markers in postoperative delirium (POD) and cognitive dysfunction (POCD): a meta-analysis of observational studies. PLoS One, 13 (4); e0195659, 2018![]()
17) McCusker, J., Cole, M., Abrahamowicz, M., et al.: Delirium predicts 12-month mortality. Arch Intern Med, 162 (4); 457-463, 2002![]()
18) Nishizawa, Y., Yamanashi, T., Saito, T., et al.: Bispectral EEG (BSEEG) algorithm captures high mortality risk among 1,077 patients: its relationship to delirium motor subtype. Am J Geriatr Psychiatry, 31 (9); 704-715, 2023![]()
19) Numata, S., Ye, T., Hyde, T. M., et al.: DNA methylation signatures in development and aging of the human prefrontal cortex. Am J Hum Genet, 90 (2); 260-272, 2012![]()
20) Pandharipande, P. P., Girard, T. D., Jackson, J. C., et al.: Long-term cognitive impairment after critical illness. N Engl J Med, 369 (14); 1306-1316, 2013![]()
21) Phipson, B., Maksimovic, J., Oshlack, A.: missMethyl:an R package for analyzing data from Illumina's HumanMethylation450 platform. Bioinformatics, 32 (2); 286-288, 2016![]()
22) Portela, A., Esteller, M.: Epigenetic modifications and human disease. Nat Biotechnol, 28 (10); 1057-1068, 2010![]()
23) R Core Team: R: A Language and Environment for Statistical Computing. Vienna, Austria: R Foundation for Statistical Computing. 2019 (https://www.r-project.org/) (参照2023-10-11)
24) Ritchie, M. E., Phipson, B., Wu, D., et al.: limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Res, 43 (7); e47, 2015![]()
25) Sadahiro, R., Knight, B., James, F., et al.: Major surgery induces acute changes in measured DNA methylation associated with immune response pathways. Sci Rep, 10 (1); 5743, 2020![]()
26) Saito, T., Braun, P. R., Daniel, S., et al.: The relationship between DNA methylation in neurotrophic genes and age as evidenced from three independent cohorts: differences by delirium status. Neurobiol Aging, 94; 227-235, 2020![]()
27) Saito, T., Toda, H., Duncan, G. N., et al.: Epigenetics of neuroinflammation: immune response, inflammatory response and cholinergic synaptic involvement evidenced by genome-wide DNA methylation analysis of delirious inpatients. J Psychiatr Res, 129; 61-65, 2020![]()
28) Schreuder, L., Eggen, B. J., Biber, K., et al.: Pathophysiological and behavioral effects of systemic inflammation in aged and diseased rodents with relevance to delirium: a systematic review. Brain Behav Immun, 62; 362-381, 2017![]()
29) Sen, P., Shah, P. P., Nativio, R., et al.: Epigenetic mechanisms of longevity and aging. Cell, 166 (4); 822-839, 2016![]()
30) Shinozaki, G., Braun, P. R., Hing, B. W. Q., et al.: Epigenetics of delirium and aging: potential role of DNA methylation change on cytokine genes in glia and blood along with aging. Front Aging Neurosci, 10; 311, 2018![]()
31) Shinozaki, G., Chan, A. C., Sparr, N. A., et al.: Delirium detection by a novel bispectral electroencephalography device in general hospital. Psychiatry Clin Neurosci, 72 (12); 856-863, 2018![]()
32) Shinozaki, G., Bormann, N. L., Chan, A. C., et al.: Identification of patients with high mortality risk and prediction of outcomes in delirium by bispectral EEG. J Clin Psychiatry, 80 (5); 19m12749, 2019![]()
33) Simone, M. J., Tan, Z. S.: The role of inflammation in the pathogenesis of delirium and dementia in older adults: a review. CNS Neurosci Ther, 17 (5); 506-513, 2011![]()
34) Spronk, P. E., Riekerk, B., Hofhuis, J., et al.: Occurrence of delirium is severely underestimated in the ICU during daily care. Intensive Care Med, 35 (7); 1276-1280, 2009![]()
35) Vasunilashorn, S. M., Ngo, L., Inouye, S. K., et al.: Cytokines and postoperative delirium in older patients undergoing major elective surgery. J Gerontol A Biol Sci Med Sci, 70 (10); 1289-1295, 2015![]()
36) Vasunilashorn, S. M., Dillon, S. T., Inouye, S. K., et al.: High C-reactive protein predicts delirium incidence, duration, and feature severity after major noncardiac surgery. J Am Geriatr Soc, 65 (8); e109-116, 2017![]()
37) Yamanashi, T., Saito, T., Yu, T., et al.: DNA methylation in the TNF-alpha gene decreases along with aging among delirium inpatients. Neurobiol Aging, 105; 310-317, 2021![]()
38) Yamanashi, T., Kajitani, M., Iwata, M., et al.: Topological data analysis (TDA) enhances bispectral EEG (BSEEG) algorithm for detection of delirium. Sci Rep, 11 (1); 304, 2021![]()
39) Yamanashi, T., Marra, P. S., Crutchley, K. J., et al.: Mortality among patients with sepsis associated with a bispectral electroencephalography (BSEEG) score. Sci Rep, 11 (1); 14211, 2021![]()
40) Yamanashi, T., Crutchley, K. J., Wahba, N. E., et al.: Evaluation of point-of-care thumb-size bispectral electroencephalography device to quantify delirium severity and predict mortality. Br J Psychiatry, 220 (6); 322-329, 2022![]()
41) Yamanashi, T., Crutchley, K. J., Wahba, N. E., et al.: The genome-wide DNA methylation profiles among neurosurgery patients with and without post-operative delirium. Psychiatry Clin Neurosci, 77 (1); 48-55, 2023![]()