ECTの際には適切な筋弛緩状態が必須であり,これまでスキサメトニウムが頻用されてきた.スキサメトニウムは重篤な副作用も多く,現在ではその他の臨床麻酔においての使用は限定されている.しかし,施行時間の短いECTにおいては,作用発現が迅速で,作用持続時間が10分程度のスキサメトニウムは有利であることは間違いない.異型コリンエステラーゼ血症などの特殊病態でなければ,筋弛緩効果が残存することなく手技を終えられる.スキサメトニウムの供給停止が危ぶまれた折に,ロクロニウムに変更することが検討されたが,その際は筋弛緩状態の評価は必須となる.ロクロニウムは中時間作用性非脱分極性筋弛緩薬であり,現在,臨床麻酔で主に用いられている薬物で,麻酔導入時の投与量としては0.6~0.9 mg/kgで調整されている.ECTに応用するうえでは,下記の点が危惧される.(i)投与量を0.6 mg/kgとした場合,筋弛緩発現に3分程度を要するとともに筋弛緩深度が不十分となりやすく,ECT時のけいれんが十分に抑制できない場合がある.(ii)高用量0.9 mg/kg投与時には,スキサメトニウムと同等に1~2分で作用発現が得られるが,その分,持続時間が長くなり,拮抗のタイミングまでに高齢者では1時間以上を要してしまう.(iii)持続時間は年齢,性別や個々の患者特性によって大きく異なり予測ができない.(iv)筋弛緩状態の把握,適切な拮抗のためには筋弛緩モニタリングが必須となる.(v)筋弛緩モニタリング,スガマデクスによる適切な拮抗がされない場合,残存筋弛緩の頻度が高くなり,低酸素や肺炎などの呼吸器合併症につながる.いったん筋力が回復した後に再度筋弛緩状態に陥る再クラーレ化が生じ,帰棟後に危機的状態に陥る恐れがある.(vi)人工透析中の患者の場合,連続するECTのなかで,体内に残存するスガマデクスがロクロニウムの作用を阻害する可能性がある.以上の問題点について,適切に対応する必要がある.
https://doi.org/10.57369/pnj.24-130
はじめに
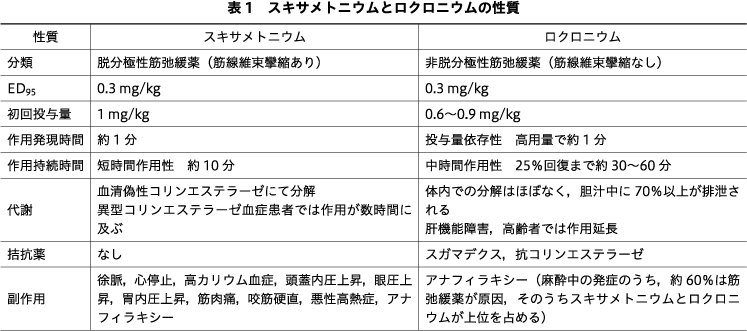
スキサメトニウムの原薬製造所の2021年の行政処分により,国内における原薬製造が困難となったことに端を発し,製薬会社からのスキサメトニウム製剤は限定供給と制限された.外科手術時の麻酔ではロクロニウムが主となっており,ほぼ影響を受けなかったが,電気けいれん療法(electroconvulsive therapy:ECT)施行病院では当院も含め,使い慣れたスキサメトニウムが供給されないことに大きな不安を覚え,筋弛緩薬をスキサメトニウムからロクロニウムへ変更した際の対応について検討を余儀なくされたに違いない.その後,日本薬局方に適合する原薬確保には至っていないが,日本薬局方外の原薬を用いて製造した非日局の製品として承認されたことで安定供給が再開された3).一安心ではあるが,今後も起こりうる事態に備える必要もあるであろう.また,スキサメトニウムが禁忌となる症例も存在することから,精神神経科医もロクロニウムの特性や,ECTにロクロニウムを用いた場合の注意点について認識する必要があるであろう.スキサメトニウムとロクロニウムを対比するように概説したい(表1).
I.スキサメトニウムの副作用と禁忌
スキサメトニウムは徐脈,血圧上昇,眼圧上昇,胃内圧上昇,筋肉痛といった頻度の高い軽度の副作用から,高カリウム血症による心室細動,心停止,アナフィラキシー,咬筋硬直,悪性高熱症などの重篤な合併症も誘発するため,臨床麻酔ではスキサメトニウムが使用される状況は非常に限定的になっている.禁忌は高カリウム血症が誘発される可能性が高いケースとなるが,脳梗塞や脳血管障害など中枢神経疾患による麻痺,広範な末梢神経障害による麻痺,広範囲熱傷後,長期の不動化後(長期臥床など)の患者が挙げられる(表2).これらの患者では,正常な神経筋接合部が破壊された後に,接合部外の筋膜上にアセチルコリン受容体のアップレギュレーションが生じる2).正常患者でも,スキサメトニウムによる筋束攣縮後に血清K+は0.5 mEq/Lほど上昇するが,増生した幼弱な受容体はスキサメトニウムにより脱分極しやすく,心室細動をきたすほどまでにK+値は上昇する場合もある.したがって,血清K+上昇のリスクが高い患者では,筋弛緩薬としてロクロニウムを選択するべきである.その際,受容体のアップレギュレーションが生じている状態ではロクロニウムの効果が減弱するため,ECTに適正な筋弛緩状態が得られているか,筋弛緩モニタリングを用いた評価が必要である.
II.構造
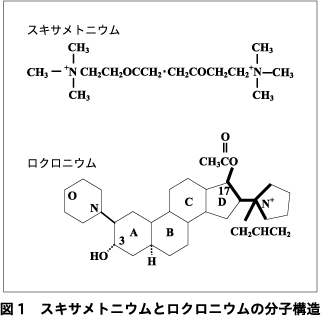
スキサメトニウムは,神経筋接合部における神経伝達物質であるアセチルコリンが2分子結合した構造(di-acetylcholine)となっている(図1).アセチルコリン受容体への結合部位である4級アンモニウム(N+)を2つ有している.ロクロニウムはステロイド型筋弛緩薬であり,A環からD環より成るステロイド骨格の外側に1つの4級アンモニウムを有する.この4級アンモニウムがアセチルコリン受容体の特定のアミノ酸に結合し,脱分極性あるいは非脱分極性筋弛緩作用を発揮する.
III.筋弛緩の機序
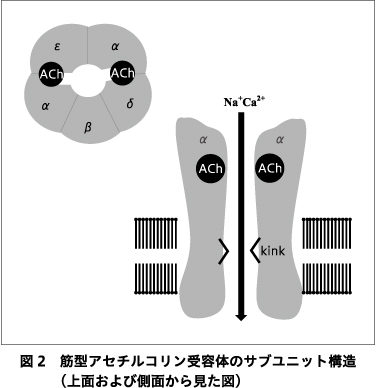
筋型ニコチン性アセチルコリン受容体は,5つのサブユニット(成熟型:ααβδε,幼弱型:ααβδγ)より構成されている(図2).その配列上,α-ε(γ)サブユニット接合部あるいはα-δサブユニット接合部にアセチルコリン結合部を有し,アセチルコリンあるいは脱分極性筋弛緩薬であるスキサメトニウムが2分子共同して結合することによりイオンチャネルが開放され,Na+,Ca2+が細胞内に流入し終板電位を形成する.アセチルコリンは神経筋接合部内でアセチルコリンエステラーゼにて即座に分解されるが,スキサメトニウムが代謝されるには血中に拡散後,偽性コリンエステラーゼで分解される必要があるため,神経筋接合部にとどまる間はアセチルコリン受容体に頻回に結合しながら脱分極を維持し,筋線維束攣縮を起こす.その結果,アセチルコリン受容体は不活化状態になり,筋弛緩状態がもたらされる(Phase Iブロック).偽性コリンエステラーゼにて活性代謝物であるサクシニルモノコリンに分解後,さらにコハク酸に分解され,10分程度で神経筋機能は完全に回復する.ただし,頻回の繰り返し投与後や持続投与した場合には,Phase IIブロックとなり作用が著明に延長する8).通常の作用時には拮抗薬はないが,Phase IIブロック時にはネオスチグミンなどの抗コリンエステラーゼにより拮抗されるようになる.
非脱分極性筋弛緩薬であるロクロニウムが,2つのアセチルコリン結合部のうち1つをアセチルコリンと競合して占拠すれば,アセチルコリンによるイオンチャネルの開放は生じなくなる.ロクロニウムは体内では代謝されず,70%以上が肝臓から胆汁中に,30%未満が尿中に排泄される5).臓器排泄に依存するため,スキサメトニウムに比較して作用持続時間が長く,かつ症例間のばらつきが大きい.拮抗薬として,以前はネオスチグミンが用いられていたが,徐脈,気管支けいれん,粘液分泌などの副作用や高頻度に生じる残存筋弛緩の問題で,現在では特異的拮抗薬であるスガマデクスが用いられている.
IV.作用特徴
1.作用発現時間
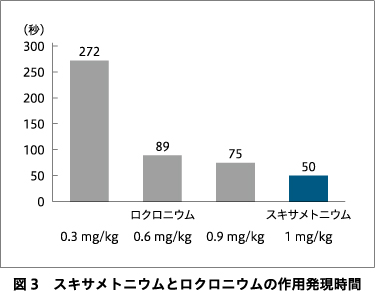
作用発現時間とは,筋弛緩薬投与から筋弛緩作用が最大となるまでの時間を表す.スキサメトニウム1 mg/kg投与後は60秒ほどで完全遮断される(図3)1)6).ロクロニウムは投与量に依存して作用発現は早くなるものの,1分以上を要する.ED95量の0.3 mg/kg投与時には,作用発現は遅延し,かつ平均最大遮断率は90%にとどまるため,ECTによるけいれん抑制が不十分となる可能性が高い.
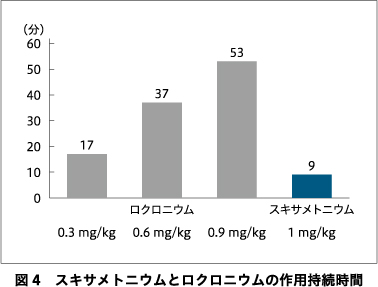
2.作用持続時間
スキサメトニウムでは,投与後10分程度で完全回復が得られる(図4)1)6).ロクロニウムの場合,投与量依存性に作用持続時間は長くなる.この持続時間は100%回復までの時間ではない点に注意が必要である.言葉の定義として,ロクロニウム投与から神経筋機能がコントロールの25%回復するまでの時間を表しており,筋弛緩の継続が必要な臨床麻酔ではこの時点でロクロニウムの追加投与を行うが,そのための指標となっている.つまり,ロクロニウム0.9 mg/kg投与時には25%回復までに約1時間を要し,その後も自然回復させた場合には,さらに1時間程度の観察が必要となるのである.したがってECT後,適切な筋弛緩程度まで自然回復を待ち,その後に至適量のスガマデクスにより筋弛緩を拮抗する必要がある.スガマデクスと筋弛緩モニタリングについては後述するが,ECTにロクロニウムを用いた際にはどちらも欠かせないアイテムとなる.
V.筋弛緩拮抗薬スガマデクス
ロクロニウムの拮抗薬には,特異的筋弛緩回復薬であるスガマデクスと,非脱分極性筋弛緩薬の種類を問わず,間接的な筋弛緩拮抗作用を示す抗コリンエステラーゼのネオスチグミンとエドロホニウムが属する.抗コリンエステラーゼは,徐脈や気管支けいれん,粘液分泌亢進などの副作用のためあまり用いられなくなった.
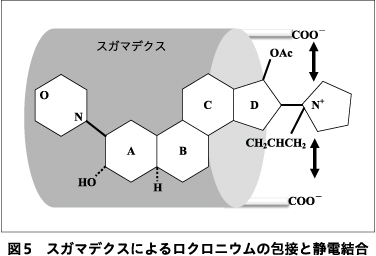
スガマデクスは8個の単糖類がドーナツ型に結合し,分子中央に空洞を有するγ-シクロデキストリンを基本骨格とし,側鎖に8つのカルボキシル基を結合している(図5).ロクロニウムを空洞内に包接するとともに,ロクロニウムの陽荷電した4級アンモニウムとスガマデクスの負電荷のカルボキシル基が静電結合し,1:1の強固なホスト-ゲスト複合体を形成する8).血中でフリーのロクロニウム濃度が急激に下がることで,濃度勾配に従い神経筋接合部からロクロニウムが血中に拡散し,さらに包接されていく.適切量のスガマデクスによる拮抗時間は1分程度であり,心拍出量の減少している高齢者でも3分程度で拮抗可能である7).
スガマデクスあるいはロクロニウムとの包接体は体内で代謝を受けず,投与後24時間以内に90%以上が尿中に排泄される4).したがって,腎不全患者ではスガマデクスおよびロクロニウムとの包接体の排泄が遷延することになる.人工透析にて大部分が除去されるが,フリーのスガマデクスが残存する場合,連続するECTにおいてロクロニウムの効果が得られにくくなる可能性がある.
VI.筋弛緩モニタリングの必要性
ロクロニウムの作用時間は症例間でばらつきが大きく,スガマデクスを至適量投与しなければ,残存筋弛緩や再クラーレ化(いったん筋力が回復した後に再度,筋弛緩作用が発現する危機的な状態)が生じやすくなる.軽度の残存筋弛緩であっても上気道閉塞や胃食道逆流による誤嚥が生じることがあり,低酸素や肺炎などの術後呼吸器合併症につながるため,確実に回避せねばならない.スガマデクスの投与量は筋弛緩モニタリングによる筋弛緩深度評価によって設定されており,深部筋弛緩状態では4 mg/kg,中等度筋弛緩状態以降では2 mg/kgが適正量とされている.したがって,筋弛緩モニタリング下にスガマデクスの投与量を滴定し,完全な神経筋機能の回復を評価する以外に,安全な手段は存在しないのである.
おわりに
安全なECTの麻酔管理のためには,ロクロニウムおよびスガマデクスの作用特徴を理解して使用することと,筋弛緩および拮抗作用の客観的評価が重要である.
編注:本特集は第119回日本精神神経学会学術総会シンポジウムをもとに髙橋英彦(東京科学大学大学院医歯学総合研究科精神行動医科学分野)と鮫島達夫(福井記念病院)を代表として企画された.
利益相反
なお,本論文に関連する利益相反として,日本光電工業株式会社より臨床受託研究費を受けている.
1) Magorian, T., Flannery, K. B., Miller, R. D.: Comparison of rocuronium, succinylcholine, and vecuronium for rapid-sequence induction of anesthesia in adult patients. Anesthesiology, 79 (5); 913-918, 1993![]()
2) Martyn, J. A., White, D. A., Gronert, G. A., et al.: Up-and-down regulation of skeletal muscle acetylcholine receptors. Effects on neuromuscular blockers. Anesthesiology, 76 (5); 822-843, 1992![]()
3) 丸石製薬株式会社: スキサメトニウム製剤に関するお知らせ (第2報). 2023 (https://www.maruishi-pharm.co.jp/media/suxamethonium_oshirase2_20230519.pdf) (参照2023-05-19)
4) Peeters, P., Passier, P., Smeets, J., et al.: Sugammadex is cleared rapidly and primarily unchanged via renal excretion. Biopharm Drug Dispos, 32 (3); 159-167, 2011![]()
5) Proost, J. H., Eriksson, L. I., Mirakhur, R. K., et al.: Urinary, biliary and faecal excretion of rocuronium in humans. Br J Anaesth, 85 (5); 717-723, 2000![]()
6) 鈴木孝浩, 佐伯 茂, 武田純三ほか: バランス麻酔下の成人手術患者におけるOrg9426の薬物動態, 薬力学および安全性試験. 麻酔, 55 (4); 419-427, 2006
7) Suzuki, T., Kitajima, O., Ueda, K., et al.: Reversibility of rocuronium-induced profound neuromuscular block with sugammadex in younger and older patients. Br J Anaesth, 106 (6); 823-826, 2011![]()
8) 鈴木孝浩: 筋弛緩薬. 臨床麻酔科学書 (森田 潔監, 川真田樹人ほか編). 中山書店, 東京, p.201-215, 2022