【目的】近年,一部の精神疾患において,機械学習の技術を応用したアルゴリズムを用いて,少数の安静時脳機能的結合の相関値の加重線形和(WLS)により診断を予測する判別器の作成に成功したことが報告されている.われわれは,このアルゴリズムを用いてギャンブル障害(GD)の判別器の開発に取り組み,さらにWLSとGDの臨床尺度との関連について調査した.【方法】機械学習の訓練データには,2箇所のMRI施設から収集した71名のGD患者と90名の健常対照者(HC)のデータを用いた.訓練データに機械学習のアルゴリズムを適用してGDの判別器を作成し,作成された判別器の汎化性能は別のMRI施設で収集した独立したテストデータ(GD患者6名,HC 14名)を用いて検証した.WLSとGD重症度および罹病期間との相関関係を調査した.【結果】訓練データにおける判別器の一個抜き交差検証の結果は,area under the curve(AUC)が0.89であり,テストデータにおける判別器の判別性能はAUCが0.81であった.GD患者におけるWLSとGD重症度および罹病期間の間には相関関係を認めなかった.【結論】安静時脳機能的結合の情報から汎化性能を有するGDの判別器の開発に成功した.今後,判別器がGDの正確な診断の一助となることが期待される.
2)京都大学大学院医学研究科脳病態生理学講座精神医学
https://doi.org/10.57369/pnj.23-066
はじめに
ギャンブル障害(gambling disorder:GD)とは,ギャンブルを止めることができず,借金や失業などの社会問題を引き起こすことを特徴とする精神疾患である.GDは,DSM-51)では物質関連障害および嗜癖性障害群に分類されており,臨床場面ではアルコールや薬物などの物質依存に対して行為依存に含まれる依存症である.GDをはじめとする依存症の診断基準は,自覚症状や社会的に問題となる行動の組み合わせで構成されており,バイオマーカーのような生物学的情報に基づく指標は含まれていない.
近年,精神疾患においてMRIによる安静時脳機能的結合の変化が盛んに調べられるようになっている.GDにおいても安静時脳機能的結合について調べた研究がすでにいくつか行われているが2)11)24),その結果は一致していない.その原因の一端として,MRI装置の種類4),撮像パラメーター22),研究参加者の年齢層3)や性別23)といった疾患以外のMRIデータに影響を及ぼす要因が考えられている.
精神疾患の診断は自覚症状や社会的に問題となる行動の組み合わせで構成されており,それを補い,診断のサポートのために機械学習の技術を用いたデータ駆動型アプローチが近年用いられるようになってきている9).そして一部の精神疾患では安静時脳機能的結合の情報から汎化性能を有する判別器の開発に成功したことが報告されている10)29)31).これらの研究では,MRI装置/撮像パラメーター/研究参加者の年齢層や性別比などの影響を除外し,疾患の分類に重要な少数の脳機能的結合の選別と各結合の重み付けの算出を行い,選別された脳機能的結合の相関値と各結合の重み付けの積の和,すなわち加重線形和(weighted linear summation:WLS)によって疾患の有無を予測するといった最新の機械学習のアルゴリズムが用いられている.
本研究では,先行研究10)29)31)と同様の機械学習のアルゴリズムを用いて,安静時脳機能的結合の情報から汎化性能を有するGDの判別器の開発をめざした.また,判別器が予測に用いるWLSの特徴を探るため,WLSとGDの臨床尺度との関係を調査した21).本稿では,その研究成果について簡潔に紹介する.
I.研究の方法および結果
1.研究参加者:訓練データ
GDの治療施設からGD患者の研究参加者を募集した.治療施設から募集したため,本研究に参加したGD患者は研究参加時には日常的なギャンブル行動はしていなかった.女性のGD患者の募集は困難であったため,GD患者は男性に限定して募集し,健常対照者(healthy control:HC)も男性に限定した.HCは地域社会から研究参加者を募集した.データは2箇所のMRI施設(施設A,施設B)にて収集した.施設AではGD患者35名,HC 44名,施設BではGD患者38名,HC 46名,からデータを収集し,合計73名のGD患者と90名のHCのデータを収集した.GDの症状は,Structured Clinical Interview for DSM-IV(SCID)の病的賭博のセクション7)を用いて調べ,すべてのGD患者はDSM-5によるGDの診断基準を満たしていた.GD患者の併存する精神疾患はSCIDによりスクリーニングし,他の物質関連障害および嗜癖性障害を含むあらゆる精神疾患を併存する患者を除外した.HCは,SCIDによりスクリーニングを行い,精神疾患の既往がないことを確認した.すべての研究参加者について,研究参加時点で,身体的に健康であること,神経学的な外傷歴がないこと,重度の内科疾患が併存していないこと,違法薬物の使用歴がないことを確認した.本研究は,京都大学医の倫理委員会に承認されたプロトコールに従い,すべての研究参加者から十分なインフォームドコンセントを得て,守秘義務を遵守し,匿名性の保持に配慮して行った.
2.臨床尺度
20項目の自記式質問票からなるSouth Oaks Gambling Screen(SOGS)14)を用いて,GDの重症度を評価した.SOGSは,0点から20点の間の点数で評価され,点数が高いほど重症である.SOGSはGDのスクリーニングにも用いられ,5点以上の場合,GDのリスクがあるとされている.GD患者の罹病期間は,面接により聴取した.
3.MRIデータ
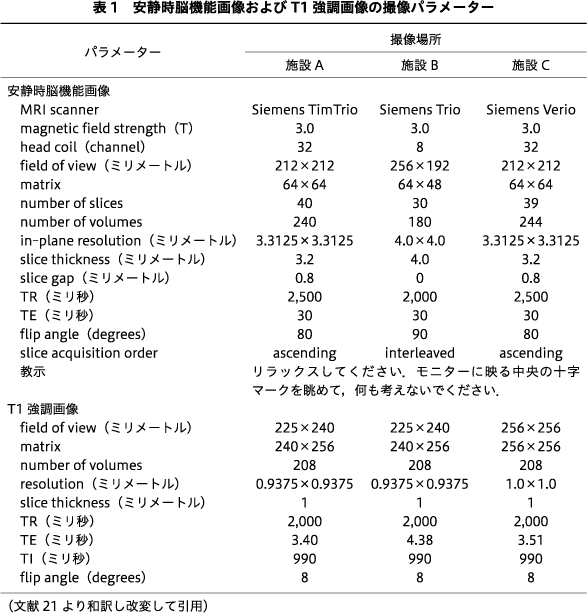
施設Aと施設Bにて,安静時脳機能画像/フィールドマップ画像/T1強調画像のデータを収集した.施設Aと施設BのMRI装置は異なっており,撮像パラメーターも異なっていた(表1).安静時脳機能画像の最初の10秒に相当するボリュームは磁化平衡のために廃棄した.安静時脳機能画像は,MATLAB(R2017a,Mathworks,USA)上で動作するSPM12にて,まずは解析の前処理として,slice timing,realignment,coregistration,normalizationを行い,smoothingを6ミリメートルで行った.なお,フィールドマップ補正にはFieldmap toolbox8)を使用した.その後,“scrubbing”18)を行い,過剰な頭部運動のあるフレームを解析から排除した.先行研究31)と同様に,“scrubbing”の結果,残存データが30%未満の参加者は訓練データから除外した.得られた画像は,Brainvisa Sulci Atlas(BSA)17)およびAutomated Anatomical Labeling(AAL)26)の合成アトラスを用いて140の脳領域に分割し,それぞれの脳領域から大脳皮質の血中酸素濃度依存性信号の時間経過を抽出し,バンドパスフィルター(0.008~0.1 ヘルツ)を適用した.脳機能的結合として140×139/2の9,730の脳の2領域間における血中酸素濃度依存性信号のピアソン相関係数を算出した.
4.機械学習
本研究では,先行研究10)29)31)で確立されている機械学習アルゴリズムを使用した.この機械学習のアルゴリズムは,L1-regularized sparse canonical correlation analysis(L1-SCCA)28)とsparse logistic regressions(SLR)30)のカスケードによる9×9の入れ子型の特徴選択と一個抜き交差検証(leave-one-out cross validation:LOOCV)で構成されている.L1-SCCAは,GDの診断に関連する安静時脳機能的結合を除去しギャンブル障害の診断と関連する脳機能的結合を抽出する機能を有し,SLRは,L1-SCCAにて抽出されたGDの診断に関連する脳機能的結合を自動的に刈り取り,疾患の判別に大きく寄与する少数の脳機能的結合だけを抽出し,抽出した脳機能的結合ごとに重み付けを算出してロジスティック回帰モデルを学習する機能を有する.各参加者の診断は,最終的に選択された少数の脳機能的結合を示す相関値と各結合の重み付けの積の和,すなわちWLSが,正の値の場合はGD患者,負の値の場合はHCと予測される.訓練データにおける判別器のLOOCVの結果から,area under the curve(AUC),精度,感度,特異度を算出した.LOOCVの結果の統計的有意性は,並び替え検定16)によって評価した.並べ替え検定では,各参加者の診断ラベルをランダムに1,000回入れ替え,LOOCVの結果の精度を算出した.P値は,並べ替え後の精度の分布のうち,実際の診断予測の結果と等しいか大きい値をすべて合計し,並べ替えの回数で割って算出した.有意水準はP<0.05とした.画像解析および機械学習のアルゴリズムのより詳細な内容についてはTakeuchi, H. らの論文21)を参照されたい.
5.研究参加者:テストデータ
訓練データから作成した判別器の汎化性能を検証するために,施設Cにて,施設Aおよび施設Bの研究参加者とは異なる独立した男性GD患者6名と男性HC 14名のデータを収集した.施設Cの研究参加者は訓練データの研究参加者と同様の方法で募集した.テストデータでは,安静時脳機能画像/フィールドマップ画像/T1強調画像を,訓練データと異なる3T MRI装置を用いて収集した.安静時脳機能画像とT1強調画像のパラメーターは表1にまとめた.テストデータの研究参加者の診断過程と除外基準は訓練データの研究参加者と同様の方法で行った.テストデータのMRIデータは,訓練データと同じ手順で処理した.テストデータにおける判別器の性能は,AUC,精度,感度,特異度を算出し評価した.
また,テストデータにおける判別器の性能の統計的有意性は,P<0.05の有意水準で並べ替え検定16)により評価した.
6.WLSと臨床尺度との相関
訓練データにおけるGD患者において,WLSとSOGSおよび罹病期間について相関を調査した.有意水準は,P<0.05(両側)とした.テストデータにおいては,GD患者のサンプル数が少ないため(n=6),相関は調べなかった.
7.結 果
GD患者73名とHC 90名のデータを訓練データとして収集したが,施設AのGD患者1名を過去の違法薬物の使用歴が発覚したため除外し,施設Aの別のGD患者1名が安静時脳機能画像データの“scrubbing”の結果,残存データが30%未満であったため,訓練データから除外した.最終的に,合計161データ(GD患者71名,HC 90名)を機械学習の訓練データとして使用した.訓練データにおける研究参加者の年齢は,GD患者35.0歳(±9.6)/HC 34.8歳(±8.2),テストデータにおける研究参加者の年齢は,GD患者31.5歳(±8.7)/HC 29.5歳(±5.7)であった.訓練データにおけるGD患者のSOGSは13.5点(±2.5),罹病期間は11.9年(±8.6),テストデータにおけるGD患者のSOGSは15.0点(±2.6),罹病期間は11.5年(±9.8),であった.本研究に参加したGD患者は,訓練データとテストデータともにGDの重症度が高く平均罹病期間が10年以上と長いという特徴が認められた.
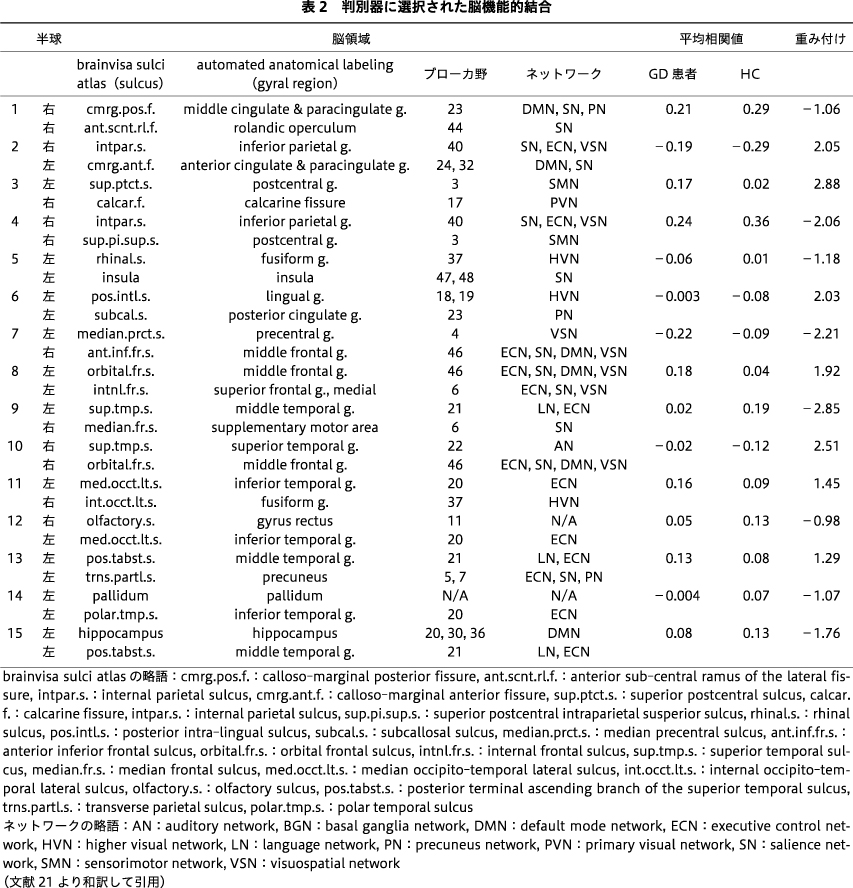
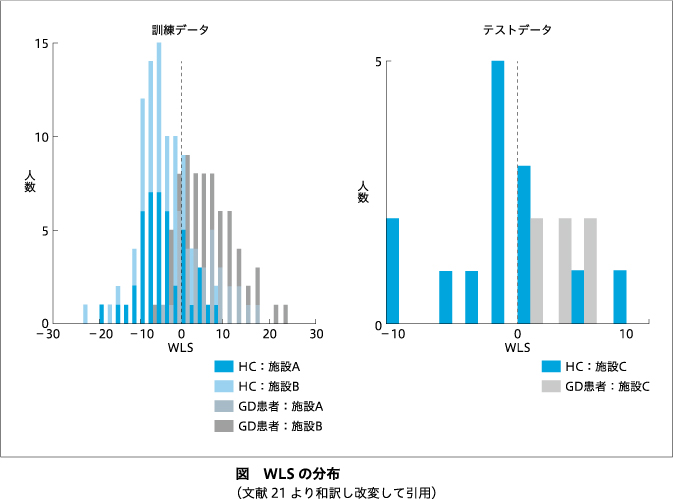
訓練データから作成されたGD判別器は,15本の安静時脳機能的結合から構成されていた(表2).判別器を構成している脳機能的結合はさまざまな機能ネットワークにまたがっており,特定の半球や脳機能ネットワークへの偏りは認めなかった.判別器は,訓練データにおけるLOOCVにおいてAUC=0.89でGD患者とHCを判別していた(精度=0.79,感度=0.79,特異度=0.79).訓練データにおけるGD患者およびHCのWLSの分布を図左に示す.並べ替え検定の結果は,P=0.007であった.判別器は,テストデータにおいてもAUC=0.81と高い判別性能を示した(精度=0.75,感度=1.00,特異度=0.64).テストデータにおけるGD患者およびHCのWLSの分布を図右に示す.並べ替え検定の結果は,P=0.009であった.
WLSとSOGSおよび罹病期間の間の相関は,スピアマンの順位相関係数を用いて調査した.WLSとSOGSの間には,両群で有意な相関は認められなかった(GD患者群,ρ=0.02,P=0.85;HC群,ρ=0.19,P=0.07).GD患者群において,WLSと罹病期間との間に有意な相関は認められなかった(ρ=0.18,P=0.13).
II.考察
安静時脳機能的結合の情報から機械学習のアルゴリズムを用いて,MRI装置や撮像パラメーターの違いを超えた汎化性能を有するGDの判別器の開発に成功した研究は,われわれの知る限り,本研究が初めてである.GD患者において,判別器が判別に用いるWLSとSOGSおよび罹病期間との間に相関は認められなかった.
GDを含む依存症は,自己申告による自覚症状や問題行動に関する情報に基づいて診断される.GDを含む依存症の患者は,自分の症状の否定や,嗜癖対象に関連する行動の隠匿が報告されており5)6)20),このことはGDを含む依存症の正確な診断を困難にしている.本研究の成果が今後のGDの正確な診断の一助になることが期待される.
一方,GD患者におけるWLSはSOGSや罹病期間との間に相関を認めなかった.本研究に参加したGD患者はGDの治療施設から募集したため,本研究参加時には日常的なギャンブル行動はしていなかった.このことが,本研究におけるSOGSとWLSの相関を認めなかった一因となった可能性が考えられ,本研究におけるWLSは日々のギャンブル刺激によって変化する患者の脳の状態(=state)ではなく,主として患者の脳のある程度固定化した特徴(=trait)を反映している可能性が考えられる.また,GD患者において,罹病期間とWLSには相関がなかった.このことは,GDにおいて脳活動に影響を及ぼすことが報告されている疾患の慢性度25)を,本研究におけるWLSが単純に反映しているのではないことを示唆している.今後,本研究におけるWLSが反映しているものを明らかにするために,GD患者におけるWLSの疾患の進行や慢性化による変化やギャンブルの中断やGDの治療に対する反応を調べるような縦断的研究を実施することが期待される.
本研究では,女性のGD患者を募集することが困難であり男性患者のみから判別器を作成したため,女性のGD患者に対する判別器の汎化性能は不明である.また,他の精神疾患による安静時機能的結合の変化が混入することを避けるため,本研究では他の精神疾患の合併するGD患者を除外したが,実際にはGD患者は他の精神疾患を併存していることが多いことが報告されている19).本研究の結果をGD患者に適用する際には,これらの点を考慮する必要がある.最後に,テストデータの収集時期にコロナ禍が始まり,テストデータの研究参加者を集めることが大変難しくなり,最終的にテストデータのサンプルサイズがやや小さくなってしまったことは残念であった.
おわりに
GDのような行為依存は,物質依存と異なり,依存性物質自体の神経毒性による脳変化を伴わない12)27).したがって,GDの脳画像研究は物質依存の理解に有益であると考えられている13).今後,GDの判別器の各種物質依存への適用,あるいはその逆を行うことで,依存症全般に共通する神経基盤や依存症ごとに異なる神経基盤が明らかになる,すなわち依存の本質に迫る手がかりが得られる可能性がある.
安静時脳機能画像には,体動ノイズ,生理ノイズ(呼吸,脈拍など)などさまざまなノイズが含まれており,安静時脳機能的結合の解析を行う際にはノイズの除去が非常に重要である15).近年,ノイズ除去のための洗練された方法が次々と提案されている.機械学習の技術についても新しい手法が次々と開発されている.今後より多くの研究機関が連携することで,バラエティに富んだ多くのGD患者のデータを扱える可能性がある.本研究の成果を利用し新しい知見の探索や臨床応用をめざす一方で,さらに大規模で多様なデータに対して,より洗練された安静時脳機能画像のノイズ除去や新たな機械学習の技術を適用し,より高い性能の判別器の作成をめざすことも重要であろう.
本論文はPCN誌に掲載された最新の研究論文21)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 5th ed (DSM-5). American Psychiatric Publishing, Arlington, 2013 (日本精神神経学会 日本語版用語監修, 髙橋三郎, 大野 裕監訳: DSM-5精神疾患の診断・統計マニュアル. 医学書院, 東京, 2014)
2) Contreras-Rodríguez, O., Albein-Urios, N., Vilar-López, R., et al.: Increased corticolimbic connectivity in cocaine dependence versus pathological gambling is associated with drug severity and emotion-related impulsivity. Addict Biol, 21 (3); 709-718, 2016![]()
3) Dosenbach, N. U. F, Nardos, B., Cohen, A. L., et al.: Prediction of individual brain maturity using fMRI. Science, 329 (5997); 1358-1361, 2010![]()
4) Friedman, L., Glover, G. H., FBIRN Consortium: Reducing interscanner variability of activation in a multicenter fMRI study: controlling for signal-to-fluctuation-noise-ratio (SFNR) differences. Neuroimage, 33 (2); 471-481, 2006![]()
5) Gainsbury, S., Hing, N., Suhonen, N.: Professional help-seeking for gambling problems: awareness, barriers and motivators for treatment. J Gambl Stud, 30 (2); 503-519, 2014![]()
6) Goldstein, R. Z., Craig, A. D. B., Bechara, A., et al.: The neurocircuitry of impaired insight in drug addiction. Trends Cogn Sci, 13 (9); 372-380, 2009![]()
7) Grant, J. E., Steinberg, M. A., Kim, S. W., et al.: Preliminary validity and reliability testing of a structured clinical interview for pathological gambling. Psychiatry Res, 128 (1); 79-88, 2004![]()
8) Hutton, C., Bork, A., Josephs, O., et al.: Image distortion correction in fMRI: a quantitative evaluation. Neuroimage, 16 (1); 217-240, 2002![]()
9) Huys, Q. J. M., Maia, T. V., Frank, M. J.: Computational psychiatry as a bridge from neuroscience to clinical applications. Nat Neurosci, 19 (3); 404-413, 2016![]()
10) Ichikawa, N., Lisi, G., Yahata, N., et al.: Primary functional brain connections associated with melancholic major depressive disorder and modulation by antidepressants. Sci Rep, 10 (1); 3542, 2020![]()
11) Koehler, S., Ovadia-Caro, S., van der Meer, E., et al.: Increased functional connectivity between prefrontal cortex and reward system in pathological gambling. PLoS One, 8 (12); e84565, 2013![]()
12) Lawrence, A. J., Luty, J., Bogdan, N. A., et al.: Problem gamblers share deficits in impulsive decision-making with alcohol-dependent individuals. Addiction, 104 (6); 1006-1015, 2009![]()
13) Leeman, R. F., Potenza, M. N.: Similarities and differences between pathological gambling and substance use disorders: a focus on impulsivity and compulsivity. Psychopharmacology (Berl), 219 (2); 469-490, 2012![]()
14) Lesieur, H. R., Blume, S. B.: The South Oaks Gambling Screen (SOGS): a new instrument for the identification of pathological gamblers. Am J Psychiatry, 144 (9); 1184-1188, 1987![]()
15) Murphy, K., Birn, R. M., Bandettini, P. A.: Resting-state fMRI confounds and cleanup. Neuroimage, 80; 349-359, 2013![]()
16) Noirhomme, Q., Lesenfants, D., Gomez, F., et al.: Biased binomial assessment of cross-validated estimation of classification accuracies illustrated in diagnosis predictions. Neuroimage Clin, 4; 687-694, 2014![]()
17) Perrot, M., Rivière, D., Mangin, J. F.: Cortical sulci recognition and spatial normalization. Med Image Anal, 15 (4); 529-550, 2011![]()
18) Power, J. D., Barnes, K. A., Snyder, A. Z., et al.: Spurious but systematic correlations in functional connectivity MRI networks arise from subject motion. Neuroimage, 59 (3); 2142-2154, 2012![]()
19) Rash, C. J., Weinstock, J., Van Patten, R.: A review of gambling disorder and substance use disorders. Subst Abuse Rehabil, 7; 3-13, 2016![]()
20) Rinn, W., Desai, N., Rosenblatt, H., et al.: Addiction denial and cognitive dysfunction: a preliminary investigation. J Neuropsychiatry Clin Neurosci, 14 (1); 52-57, 2002![]()
21) Takeuchi, H., Yahata, N., Lisi, G., et al.: Development of a classifier for gambling disorder based on functional connections between brain regions. Psychiatry Clin Neurosci, 76 (6); 260-267, 2022![]()
22) Thulborn, K. R., Chang, S. Y., Shen, G. X., et al.: High-resolution echo-planar fMRI of human visual cortex at 3.0 tesla. NMR Biomed, 10 (4-5); 183-190, 1997![]()
23) Tomasi, D., Volkow, N. D.: Gender differences in brain functional connectivity density. Hum Brain Mapp, 33 (4); 849-860, 2012![]()
24) Tschernegg, M., Crone, J. S., Eigenberger, T., et al.: Abnormalities of functional brain networks in pathological gambling: a graph-theoretical approach. Front Hum Neurosci, 7; 625, 2013![]()
25) Tsurumi, K., Kawada, R., Yokoyama, N., et al.: Insular activation during reward anticipation reflects duration of illness in abstinent pathological gamblers. Front Psychol, 5; 1013, 2014![]()
26) Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., et al.: Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. Neuroimage, 15 (1); 273-289, 2002![]()
27) Verdejo-García, A., Lawrence, A. J., Clark, L.: Impulsivity as a vulnerability marker for substance-use disorders: review of findings from high-risk research, problem gamblers and genetic association studies. Neurosci Biobehav Rev, 32 (4); 777-810, 2008![]()
28) Witten, D. M., Tibshirani, R., Hastie, T.: A penalized matrix decomposition, with applications to sparse principal components and canonical correlation analysis. Biostatistics, 10 (3); 515-534, 2009![]()
29) Yahata, N., Morimoto, J., Hashimoto, R., et al.: A small number of abnormal brain connections predicts adult autism spectrum disorder. Nat Commun, 7; 11254, 2016![]()
30) Yamashita, O., Sato, M., Yoshioka, T., et al.: Sparse estimation automatically selects voxels relevant for the decoding of fMRI activity patterns. Neuroimage, 42 (4); 1414-1429, 2008![]()
31) Yoshihara, Y., Lisi, G., Yahata, N., et al.: Overlapping but asymmetrical relationships between schizophrenia and autism revealed by brain connectivity. Schizophr Bull, 46 (5); 1210-1218, 2020![]()