アンフェタミン使用障害(AUD)/メタンフェタミン使用障害(MUD)は近年急速に増加しており,アンフェタミン/メタンフェタミンの過剰摂取に関連する死亡は特定の年齢層における最も重要な死因の1つになっている.非侵襲的脳刺激(NIBS)はAUD/MUDへの有望な治療法の1つであるが,NIBSプロトコルによるAUD/MUDへの効果の差異はいまだに明らかになっていない.そこで今回,AUD/MUDへのさまざまなNIBSプロトコルと薬物療法の有効性と受容性を比較することを目的とし,NIBSあるいはガイドラインが推奨する薬物療法のAUD/MUDの渇望への効果を比較したランダム化比較試験を組み入れ,頻度主義的モデルを用いたnetwork meta-analysisを実施した.1,888名の被験者を含む22本のランダム化比較試験がnetwork meta-analysisに組み込まれた.すべてのランダム化比較試験はMUDを対象としていた.シャム/プラセボ群と比較して,左背外側前頭前野皮質への間欠的シータバースト刺激と左腹内側前頭前野皮質への連続シータバースト刺激の組み合わせが最も渇望を減少させた.左背外側前頭前野皮質への高頻度反復経頭蓋磁気刺激はうつ症状と睡眠の質を最も改善させた.ほとんどの治療法において脱落率に有意な群間差は認められなかった.結論として,前頭前野皮質へのシータバースト刺激を組み合わせたプロトコルがMUDにおける渇望の重症度を最も大きく改善した.Network meta-analysisに含めることができた研究数は多くなく,今後の大規模ランダム化比較試験の実施が期待される.
2)公益財団法人浅香山病院臨床研究研修センター
3)大阪公立大学大学院リハビリテーション学研究科
4)和歌山県立医科大学医学部神経精神医学教室
5)国立中山大学生物医学研究所,高雄市,台湾
6)亜洲大学医学及健康管理学院心理学科,台中市,台湾
7)高雄元景耳鼻咽喉科神経科診療所,高雄市,台湾
8)台北榮民總醫院精神医学部,台北市,台湾
9)国立台湾陽明交通大学医学院精神医学科,台北市,台湾
10)国立台湾陽明交通大学医学院及脳科学研究科,台北市,台湾
https://doi.org/10.57369/pnj.23-132
はじめに
アンフェタミン使用障害(amphetamine use disorder:AUD)/メタンフェタミン使用障害(methamphetamine use disorder:MUD)は過去10年間で急速に増加し,一部の地域/国では有病率が少なくとも2倍に増加している34).さらに,アンフェタミン/メタンフェタミンの過剰摂取に関連する死亡率はこの10年間に3倍となり,特定の年齢層における最も重要な死因の1つになっている15).これらの依存性疾患は公衆衛生上の顕著な問題であるにもかかわらず,治療エビデンスはまだまだ乏しい14).
依存性薬物への渇望(craving),特に手がかり誘発性渇望(cue-induced craving)はAUD/MUDへの新規治療の研究の主要なターゲットとなっている3).先行研究では,経頭蓋直流電気刺激(transcranial direct current stimulation:tDCS)または反復経頭蓋磁気刺激(repetitive transcranial magnetic stimulation:rTMS)などの非侵襲的脳刺激(noninvasive brain stimulation:NIBS)が物質使用障害や肥満などのいくつかの疾患において渇望を低減することが示唆されている47).tDCSは直流電流によって神経細胞膜の分極を変化させ,皮質興奮性をanodal tDCSは増加させ,cathodal tDCSは減少させる5).rTMSは電磁界によって脳領域を刺激するが,高頻度rTMSや間欠的シータバースト刺激(intermittent theta burst stimulation:iTBS)は皮質興奮性を増強し,低頻度rTMSと連続シータバースト刺激(continuous TBS:cTBS)は皮質興奮性を抑制する28)29).
NIBSがAUD/MUDの患者の渇望を減少させる効果について,ランダム化比較試験(randomized controlled trial:RCT)では一定した結果を得られていない.左背外側前頭前野皮質(dorsolateral prefrontal cortex:DLPFC)に低頻度rTMSを適用したRCTでは,シャム刺激と比較して渇望が低減することが示されている46).同様の知見は高頻度rTMSを適用した研究20)やiTBSを適用した研究7)でも観察されている.さらに,左DLPFCにanodal tDCSを適用した試験においてもシャム刺激と比較して渇望が低減している1).一方で,コカイン,アンフェタミン,メタンフェタミンなどのさまざまな物質使用障害のペアワイズメタ解析では,高頻度rTMSのみが渇望を有意に減少し,低頻度rTMSでは減少しないことが示されている24).
RCTのnetwork meta-analysis(NMA)は,さまざまな治療アプローチの有効性,リスク/受容性を比較推定し,さらに,複数の介入の相対的な有用性を明らかにできる統計解析手法である31).われわれの知る限り,本研究はAUD/MUDを対象にしたさまざまなNIBSプロトコルの有効性と受容性を比較する初めての包括的なNMAである.なお,本研究はPsychiatry and Clinical Neurosciences誌の2022年76巻第12号に掲載されており45),本誌面に記載できなかった事項に関しては当該論文を参照されたい.
I.方法
本NMAは,Preferred Reporting Items for Systematic Reviews and Meta-Analyses Guidelines 2020 version33)に沿って実施され,Tri-Service General Hospital,National Defence Medical Center(Taipei,Taiwan)の倫理審査委員会に承認され(承認番号TSGHIRB No. B-109-29),PROSPEROに登録されている(登録番号CRD42021274059).
本研究ではNIBSと薬物療法の両方の介入法を検討に含めるため,二段階の検索法を用いた.第1段階では,“(deep transcranial magnetic stimulation OR dTMS OR repetitive transcranial magnetic stimulation OR rTMS OR TMS OR noninvasive brain stimulation OR theta burst stimulation OR transcranial direct current stimulation OR TBS OR tDCS OR vagus nerve stimulation OR vagal nerve stimulation OR tVNS OR nVNS OR VNS OR static magnetic field stimulation OR colon electric stimulation)AND(amphetamine dependence OR methamphetamine dependence OR methamphetamine addiction OR methamphetamine use disorder OR amphetamine use disorder OR amphetamine addiction OR methylenedioxymethamphetamine OR MDMA OR dextroamphetamine OR methylphenidate)AND(random OR randomised OR randomized)”のキーワードを用いてClinicalKey,Cochrane CENTRAL,EMBASE,ProQuest,PubMed,ScienceDirect,Web of Science databases for RCTsを検索した.第2段階では,AUD/MUDに対してガイドライン11)18)で推奨されている薬物療法の効果と安全性のエビデンスを比較するためbupropion,mirtazapine,sertraline,imipramine,dexamphetamine,methylphenidate,modafinil,aripiprazole,risperidone,gabapentin,hydroxyzine,flumazenil,topiramate,naltrexone,St John’s Wort,acetylcysteineの効果を検討するRCTを検索した.未発表論文についてはClinicalTrials.govを検索した.本NMAに含めるべき文献について,総説やペアワイズメタ解析の先行論文の文献リストも探索した2)11)24)25).持ち越し効果の可能性を避けるため,本解析にはクロスオーバーデザインのRCTは含めず,パラレルデザインのRCTのみを組み入れた.本研究のprimary outcomeは渇望の重症度の変化とし,secondary outcomeをうつ症状の重症度,不安症状の重症度,睡眠の質の変化とした.受容性は脱落率(研究が完了する前の何らかの理由での研究からの離脱)で評価した.バイアスリスクについては,Cochrane risk-of-bias tool16)に記載されている各ドメインに対して2人の著者が独立して検討した(検者間信頼性=0.86).
NMAはSTATA(バージョン16.0;StataCorp LLC,College Station,TX,USA)のmvmetaコマンド44)を使用して実施された.連続変数は95%信頼区間(confidence intervals:CI)で標準化平均差(standardized mean differences:SMD)を推定し,脱落率はオッズ比(odds ratios:OR)と95%CIを推定した.すべてのペアワイズメタ解析とNMAは,それぞれランダム効果モデルと頻度主義的モデルを使用して実施された.すべての比較は両側検定を使用し,P値<0.05を統計的に有意とした.本検討では一般化線形混合モデルの混合比較を使用してNMAでの直接比較と間接比較を分析し42),累積順位曲線下面積(surface under the cumulative ranking curve:SUCRA)を用いてそれぞれの介入についての累積順位確率を算出した38).さまざまなシャムまたはプラセボ介入または待機リストコントロールの有効性も評価された.プラセボ効果のメタ解析は少なくとも5本の研究がある場合にのみ実行した9).シャム治療,待機リストコントロール,プラセボの矛盾した効果が確認された場合,感度テストを実施して特定のシャム治療,待機リストコントロール,プラセボを採用した試験を削除した後に主要なNMA結果を再計算した.
II.結果
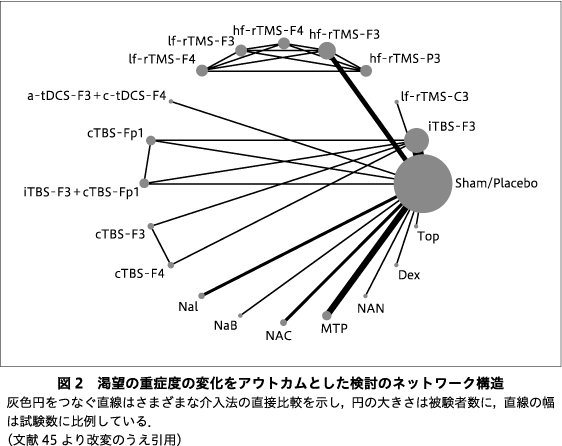
100論文が全文査読され,最終的に22本のRCT(被験者総計1,888名)1)6-8)10)12)17)20-23)26)27)30)36)37)39-41)43)46)48)がNMAに組み込まれた(図1, 図2).平均治療期間は6.8週,平均研究期間(治療+追跡期間)は11.2週であった.組み入れられた研究のバイアスリスクは,68.8%(106/154項目)がlow,28.6%(44/154項目)がunclear,および2.6%(4/154項目)がhigh riskであった.出版バイアスのfunnel plotはおおむね対称性を示した.Egger’s testによると本NMAに含まれる論文の間に有意な出版バイアスは検出されなかった.GRADE評価では,本NMAで比較検討されているエビデンスの質の最も多くは低から中の範囲であった.
Primary outcomeである渇望の重症度は,左DLPFCへのiTBS+左腹内側前頭前野皮質(ventromedial prefrontal cortex:vmPFC)へのcTBS(iTBS-F3+cTBS-Fp1)(研究=1,被験者=19,クラスII)(SMD=-1.50;95%CI=-2.70~-0.31),左vmPFCへのcTBS(cTBS-Fp1)(研究=1,被験者=18,クラスII)(SMD=-1.38;95%CI=-2.57~-0.18),左DLPFCへの高頻度rTMS(hf-rTMS-F3)(研究=3,被験者=86,1つの研究はクラスI,2つの研究はクラスIII,エビデンスレベルB)(SMD=-1.34;95%CI=-2.26~-0.41),左DLPFCへのiTBS(iTBS-F3)(研究=6,被験者=218,5つの研究はクラスI,1つの研究はクラスIII,エビデンスレベルA)(SMD=-0.98;95%CI=-1.55~-0.42)においてシャム/プラセボ群(研究=19,被験者=891)よりも有意に減少していた(図3).SUCRAによると,iTBS-F3+cTBS-Fp1が最大の減少に関連し,cTBS-Fp1,hf-rTMS-F3がそれに続いた.
Secondary outcomeのうち,うつ症状はhf-rTMS-F3(研究=3,被験者=86)(SMD=-2.48;95%CI=-3.25~-1.71)およびnaltrexone+bupropion(SMD=-0.26;95%CI=-0.48~-0.04)においてシャム/プラセボ群よりも有意な改善が認められた.一方,cTBS-F4(SMD=1.12;95%CI=0.46~1.77)は,シャム/コントロール群よりもうつ症状を有意に悪化させた.SUCRAによると,hf-rTMS-F3が最も改善に関連していた.シャム/コントロール群と比較して,不安症状の重症度を減少させるNIBSはなく,一方で,左DLPFCへのcTBS(cTBS-F3)(SMD=1.29;95%CI=0.28~2.30)およびcTBS-F4(SMD=0.98;95%CI=0.03~1.94)はシャム/コントロール群よりも不安症状の重症度を有意に悪化させた.睡眠の質は,hf-rTMS-F3(研究=3,被験者=86)(SMD=-2.43;95%CI=-3.38~-1.48)およびiTBS-F3+cTBS-Fp1(SMD=-0.86;95%CI=-1.66~-0.07)においてシャム/コントロール群と比較して有意な改善が認められた.一方で,cTBS-F4(SMD=1.40;95%CI=0.42~2.39)は,シャム/コントロール群よりも有意に睡眠の質を悪化させた.脱落率については,cTBS-F3(OR=69.33;95%CI=3.50~1373.07)のみが,シャム/プラセボ群よりも有意に高い脱落率と関連していた.SUCRAによると,cTBS-F3が最も不安症状の悪化と関連し,hf-rTMS-F3が最も睡眠の質の改善と関連し,N-acetyl cysteine+naltrexoneが最も低い脱落率を示した.
III.考察
本研究は,われわれの知る限り,MUDへのさまざまなNIBSプロトコルとガイドライン推奨の薬物療法の有効性と安全性を比較検討した最初のNMAである.前頭前野皮質に対する興奮性刺激が,他の抑制性刺激プロトコルと組み合わされているかどうかにかかわらず,渇望の重症度とうつ症状の重症度を最も減少させ,睡眠の質を最も改善した.cTBS-F3をのぞくNIBSプロトコルおよび薬物療法とシャム/プラセボ群の脱落率の差異は統計的に有意ではなかった.
本NMAの最も重要な知見は,vmPFC(Fp1)領域に対する抑制性刺激(cTBS)が,DLPFC(F3)領域に対する興奮性刺激(iTBS)の併用の有無にかかわらず,調査されたすべてのNIBSおよびガイドラインで推奨される薬物療法のなかで最も大きく渇望の重症度を改善させたことである.一方で,iTBS-F3+cTBS-Fp1は,うつ症状,不安症状に対しては有意な改善効果はなく,睡眠に対しても最小限の有効性にとどまった.これらの結果は,渇望の重症度の低下が,うつ症状,不安症状,および睡眠の質の改善と関連している可能性は低く,むしろvmPFC+/-DLPFCへの刺激の効果は,手がかり誘発性渇望の理論を反映している可能性を示唆している.手がかり誘発性渇望は実行制御ネットワーク(DLPFCおよび背側線条体)の活動の低下と辺縁神経回路(vmPFCおよび腹側線条体)の活動の強化に関連するとされることから13),vmPFCへの抑制性刺激とDLPFCへの興奮性刺激が渇望への有望なプロトコルとなる.この仮説を支持するものとして,vmPFC刺激による報酬回路/大脳辺縁系システムの調整効果4),DLPFC刺激による実行ネットワークシステムへの調整効果19)といった報告があるが,一方で,vmPFC/DLPFC同時刺激によるネットワーク機能の変化を直接に検討した臨床研究はまだなく,この仮説を検討するための直接的な証拠は不足している.
本NMAのもう1つの重要な知見は,左DLPFCに対する興奮性刺激(hf-rTMS-F3)が,うつ症状,不安症状の重症度の改善と関連した一方で,抑制性刺激(cTBS-F4およびcTBS-F3)はうつ症状,不安の重症度の悪化と関連したことである.これらの脳領域はうつ病へのrTMS治療の主要な刺激領域である35).特に,うつ病患者を対象にした興奮性rTMSプロトコルのほとんどは左DLPFCを標的とし,同部位の皮質興奮性の回復と前部帯状皮質と前部側頭極の活動の調整が報告されている32).これらの知見と同様に,左DLPFCへの興奮性rTMSプロトコルはMUD患者のうつ症状,不安症状を改善する可能性がある.
本NMAでは前頭前野皮質に対する抑制性刺激プロトコル(F4またはF3に対するcTBS)が,シャム/プラセボ群よりも有意にうつ症状および不安症状の悪化と関連していることが示されたが,これらの結果の解釈には注意が必要である.これらの結果は,メタンフェタミンへの渇望への3つの異なるNIBSプロトコル(F3へのiTBS,F3へのcTBS,F4へのcTBS)を適用した1つのRCT48)から主に導かれているが,同研究では3群間でベースラインのうつ症状と不安症状の重症度に統計学的に有意に至らない差異(それぞれP=0.1と0.07)があり,潜在的なバイアスの可能性がある.
本NMAにはいくつかの限界がある.第1に,本NMAに含まれたRCTの数は比較的少なく(総計1,888名の被験者を対象とした22本のRCT),それぞれのRCTのサンプルサイズも小さく,主要な知見のエビデンスレベルはAからBの範囲であり,エビデンスの質の強度が不十分な可能性がある.第2に,本NMAはパラレルデザインのRCTのみを組み入れたものの,盲検化のデザインや渇望の測定法は研究間で統一されていない.これらの研究デザインの違いによりバイアスリスクが生じた可能性がある.第3に,本NMAは脱落率のみを安全性の指標としている.第4に,本NMAではキーワードに「アンフェタミン」を含めることでAUDのRCTを含めようとしたが,AUDに対するNIBS介入のRCTは検索されなかった.第5に,本NMAは,渇望の重症度の変化を報告するRCTのみを組み入れたため,うつ症状と不安症状の変化およびAUD/MUDの他の結果を報告しているいくつかのRCTが見逃されている可能性がある.第6に,組み入れられたRCTのすべてが渇望の重症度をprimary outcomeとしているわけではなく,この不一致は望ましくないバイアスをもたらす可能性がある.最後に,データ入手の可否,縦断的な研究の欠如も本NMAの限界となっている.
おわりに
本NMAの結論として,MUDに対するNIBSは受容性が高く,ガイドラインで推奨されている薬物療法に劣らない有効性があり,iTBS-F3+cTBS-Fp1はすべての介入のなかで最も渇望の重症度を減少させ,hf-rTMS-F3はうつ症状の重症度と睡眠の質を最も大きく改善させていた.MUDへのNIBSの効果を長い追跡期間をもって検討する大規模RCTはいまだ実施されておらず,本NMAの知見は今後の臨床研究をデザインするための理論的根拠となることが期待される.
本論文はPCN誌に掲載された最新の研究論文45)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) Alizadehgoradel, J., Nejati, V., Movahed, F. S., et al.: Repeated stimulation of the dorsolateral-prefrontal cortex improves executive dysfunctions and craving in drug addiction: a randomized, double-blind, parallel-group study. Brain Stimul, 13 (3); 582-593, 2020![]()
2) AshaRani, P. V., Hombali, A., Seow, E., et al.: Non-pharmacological interventions for methamphetamine use disorder: a systematic review. Drug Alcohol Depend, 212; 108060, 2020![]()
3) Bedi, G., Preston, K. L., Epstein, D. H., et al.: Incubation of cue-induced cigarette craving during abstinence in human smokers. Biol Psychiatry, 69 (7); 708-711, 2011![]()
4) Bruchim-Samuel, M., Lax, E., Gazit, T., et al.: Electrical stimulation of the vmPFC serves as a remote control to affect VTA activity and improve depressive-like behavior. Exp Neurol, 283 (Pt A); 255-263, 2016![]()
5) Brunoni, A. R., Nitsche, M. A., Bolognini, N., et al.: Clinical research with transcranial direct current stimulation (tDCS): challenges and future directions. Brain Stimul, 5 (3); 175-195, 2012![]()
6) Chen, T., Su, H., Jiang, H., et al.: Cognitive and emotional predictors of real versus sham repetitive transcranial magnetic stimulation treatment response in methamphetamine use disorder. J Psychiatr Res, 126; 73-80, 2020![]()
7) Chen, T., Su, H., Li, R., et al.: The exploration of optimized protocol for repetitive transcranial magnetic stimulation in the treatment of methamphetamine use disorder: a randomized sham-controlled study. EBioMedicine, 60; 103027, 2020![]()
8) Coffin, P. O., Santos, G. M., Hern, J., et al.: Extended-release naltrexone for methamphetamine dependence among men who have sex with men: a randomized placebo-controlled trial. Addiction, 113 (2); 268-278, 2018![]()
9) Davey, J., Turner, R. M., Clarke, M. J., et al.: Characteristics of meta-analyses and their component studies in the Cochrane Database of Systematic Reviews: a cross-sectional, descriptive analysis. BMC Med Res Methodol, 11; 160, 2011![]()
10) Galloway, G. P., Buscemi, R., Coyle, J. R., et al.: A randomized, placebo-controlled trial of sustained-release dextroamphetamine for treatment of methamphetamine addiction. Clin Pharmacol Ther, 89 (2); 276-282, 2011![]()
11) Gouzoulis-Mayfrank, E., Petri, R., Härtel-Hamdorf, W., et al.: Methamphetamine-related disorders. Dtsch Arztebl Int, 114 (26); 455-461, 2017![]()
12) Grant, J. E., Odlaug, B. L., Kim, S. W.: A double-blind, placebo-controlled study of N-acetyl cysteine plus naltrexone for methamphetamine dependence. Eur Neuropsychopharmacol, 20 (11); 823-828, 2010![]()
13) Hanlon, C. A., Dowdle, L. T., Austelle, C. W., et al.: What goes up, can come down: novel brain stimulation paradigms may attenuate craving and craving-related neural circuitry in substance dependent individuals. Brain Res, 1628 (Pt A); 199-209, 2015![]()
14) Härtel-Petri, R., Krampe-Scheidler, A., Braunwarth, W. D., et al.: Evidence-based guidelines for the pharmacologic management of methamphetamine dependence, relapse prevention, chronic methamphetamine-related, and comorbid psychiatric disorders in post-acute settings. Pharmacopsychiatry, 50 (3); 96-104, 2017![]()
15) Hedegaard, H., Bastian, B. A., Trinidad, J. P., et al.: Drugs most frequently involved in drug overdose deaths: United States, 2011-2016. Natl Vital Stat Rep, 67 (9); 1-14, 2018![]()
16) Higgins, J., Green, S.: Cochrane Handbook for Systematic Reviews of Interventions, Version 5.0.2. Cochrane Collaboration. 2009
17) Kohno, M., Morales, A. M., Dennis, L. E., et al.: Effects of naltrexone on large-scale network interactions in methamphetamine use disorder. Front Psychiatry, 10; 603, 2019![]()
18) Li, K. X., Loshak, H.: Treatment for Methamphetamine Addiction: A Review of Guidelines. Canadian Agency for Drugs and Technologies in Health. Ottawa, 2019
19) Li, X., Du, L., Sahlem, G. L., et al.: Repetitive transcranial magnetic stimulation (rTMS) of the dorsolateral prefrontal cortex reduces resting-state insula activity and modulates functional connectivity of the orbitofrontal cortex in cigarette smokers. Drug Alcohol Depend, 174; 98-105, 2017![]()
20) Liang, Y., Wang, L., Yuan, T. F.: Targeting withdrawal symptoms in men addicted to methamphetamine with transcranial magnetic stimulation: a randomized clinical trial. JAMA Psychiatry, 75 (11); 1199-1201, 2018![]()
21) Ling, W., Chang, L., Hillhouse, M., et al.: Sustained-release methylphenidate in a randomized trial of treatment of methamphetamine use disorder. Addiction, 109 (9); 1489-1500, 2014![]()
22) Liu, Q., Shen, Y., Cao, X., et al.: Either at left or right, both high and low frequency rTMS of dorsolateral prefrontal cortex decreases cue induced craving for methamphetamine. Am J Addict, 26 (8); 776-779, 2017![]()
23) Liu, T., Li, Y., Shen, Y., et al.: Gender does not matter: add-on repetitive transcranial magnetic stimulation treatment for female methamphetamine dependents. Prog Neuropsychopharmacol Biol Psychiatry, 92; 70-75, 2019![]()
24) Ma, T., Sun, Y., Ku, Y.: Effects of non-invasive brain stimulation on stimulant craving in users of cocaine, amphetamine, or methamphetamine: a systematic review and meta-analysis. Front Neurosci, 13; 1095, 2019![]()
25) Mahoney, J. J. 3rd., Hanlon, C. A., Marshalek, P. J., et al.: Transcranial magnetic stimulation, deep brain stimulation, and other forms of neuromodulation for substance use disorders: review of modalities and implications for treatment. J Neurol Sci, 418; 117149, 2020![]()
26) McKetin, R., Dean, O. M., Turner, A., et al.: N-acetylcysteine (NAC) for methamphetamine dependence: a randomised controlled trial. EClinicalMedicine, 38; 101005, 2021![]()
27) Miles, S. W., Sheridan, J., Russell, B., et al.: Extended-release methylphenidate for treatment of amphetamine/methamphetamine dependence: a randomized, double-blind, placebo-controlled trial. Addiction, 108 (7); 1279-1286, 2013![]()
28) Milev, R. V., Giacobbe, P., Kennedy, S. H., et al.: Canadian Network for Mood and Anxiety Treatments (CANMAT) 2016 clinical guidelines for the management of adults with major depressive disorder: Section 4. Neurostimulation treatments. Can J Psychiatry, 61 (9); 561-575, 2016![]()
29) Mix, A., Benali, A., Eysel, U. T., et al.: Continuous and intermittent transcranial magnetic theta burst stimulation modify tactile learning performance and cortical protein expression in the rat differently. Eur J Neurosci, 32 (9); 1575-1586, 2010![]()
30) Mousavi, S. G., Sharbafchi, M. R., Salehi, M., et al.: The efficacy of N-acetylcysteine in the treatment of methamphetamine dependence: a double-blind controlled, crossover study. Arch Iran Med, 18 (1); 28-33, 2015![]()
31) Naci, H., Salcher-Konrad, M., Kesselheim, A. S., et al.: Generating comparative evidence on new drugs and devices before approval. Lancet, 395 (10228); 986-997, 2020![]()
32) Nahas, Z., Teneback, C. C., Kozel, A., et al.: Brain effects of TMS delivered over prefrontal cortex in depressed adults: role of stimulation frequency and coil-cortex distance. J Neuropsychiatry Clin Neurosci, 13 (4); 459-470, 2001![]()
33) Page, M. J., McKenzie, J. E., Bossuyt, P. M., et al.: The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ, 372; n71, 2021![]()
34) Paulus, M. P., Stewart, J. L.: Neurobiology, clinical presentation, and treatment of methamphetamine use disorder: a review. JAMA Psychiatry, 77 (9); 959-966, 2020![]()
35) Paus, T., Barrett, J.: Transcranial magnetic stimulation (TMS) of the human frontal cortex: implications for repetitive TMS treatment of depression. J Psychiatry Neurosci, 29 (4); 268-279, 2004![]()
36) Rezaei, F., Emami, M., Zahed, S., et al.: Sustained-release methylphenidate in methamphetamine dependence treatment: a double-blind and placebo-controlled trial. Daru, 23 (1); 2, 2015![]()
37) Rezaei, F., Ghaderi, E., Mardani, R., et al.: Topiramate for the management of methamphetamine dependence: a pilot randomized, double-blind, placebo-controlled trial. Fundam Clin Pharmacol, 30 (3); 282-289, 2016![]()
38) Salanti, G., Ades, A. E., Ioannidis, J. P. A.: Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol, 64 (2); 163-171, 2011![]()
39) Su, H., Chen, T., Zhong, N., et al.: γ-aminobutyric acid and glutamate/glutamine alterations of the left prefrontal cortex in individuals with methamphetamine use disorder: a combined transcranial magnetic stimulation-magnetic resonance spectroscopy study. Ann Transl Med, 8 (6); 347, 2020![]()
40) Su, H., Chen, T., Jiang, H., et al.: Intermittent theta burst transcranial magnetic stimulation for methamphetamine addiction: a randomized clinical trial. Eur Neuropsychopharmacol, 31; 158-161, 2020![]()
41) Trivedi, M. H., Walker, R., Ling, W., et al.: Bupropion and naltrexone in methamphetamine use disorder. N Engl J Med, 384 (2); 140-153, 2021![]()
42) Tu, Y. K.: Use of generalized linear mixed models for network meta-analysis. Med Decis Making, 34 (7); 911-918, 2014![]()
43) Wang, L. J., Mu, L. L., Ren, Z. X., et al.: Predictive role of executive function in the efficacy of intermittent theta burst transcranial magnetic stimulation modalities for treating methamphetamine use disorder-a randomized clinical trial. Front Psychiatry, 12; 774192, 2021![]()
44) White, I. R.: Network meta-analysis. Stata J, 15 (4); 951-985, 2015
45) Wu, M. K., Satogami, K., Liang, C. S., et al.: Multiple comparison of different noninvasive brain stimulation and pharmacologic interventions in patients with methamphetamine use disorders: a network meta-analysis of randomized controlled trials. Psychiatry Clin Neurosci, 76 (12); 633-643, 2022![]()
46) Yuan, J., Liu, W., Liang, Q., et al.: Effect of low-frequency repetitive transcranial magnetic stimulation on impulse inhibition in abstinent patients with methamphetamine addiction: a randomized clinical trial. JAMA Netw Open, 3 (3); e200910, 2020![]()
47) Zeng, B. Y., Zeng, B. S., Chen, Y. W., et al.: Efficacy and acceptability of noninvasive brain stimulation interventions for weight reduction in obesity: a pilot network meta-analysis. Int J Obes (Lond), 45 (8); 1705-1716, 2021![]()
48) Zhao, D., Li, Y., Liu, T., et al.: Twice-daily theta burst stimulation of the dorsolateral prefrontal cortex reduces methamphetamine craving: a pilot study. Front Neurosci, 14; 208, 2020![]()