近年の研究から,さまざまな精神疾患が,中脳辺縁系ドパミン関連回路の変化と関連していることがわかってきた.しかし,この神経回路において,統合失調症(SCZ),大うつ病(MDD),自閉スペクトラム症(ASD)に共通する変化や疾患特異的な変化はまだ検討されていない.そこで本研究では,中脳辺縁系回路における疾患共通の,もしくは疾患特異的な特徴を検討する.本研究では555名の被験者が参加した〔SCZ群140名(女性45.0%),MDD群127名(44.9%),ASD群119名(15.1%),健常対照群169名(34.9%)〕.参加者全員が機能的磁気共鳴画像法による安静時脳機能計測(rs-fMRI)を実施した.推定された安静時脳機能結合(effective connectivity)を群間で比較するために,パラメトリック経験的ベイズアプローチ(parametric empirical Bayes approach)を使用した.腹側被蓋野(VTA),側坐核(NAc)のshell部とcore部,内側前頭前皮質(mPFC)を関心領域(ROI)と設定し,これらのROIを含む中脳辺縁系ドパミン関連回路内の安静時脳機能結合を,これらの精神疾患群間で動的因果関係モデル解析(DCM analysis)により比較,検討した.興奮性のshell-to-core結合は,健常対照群よりもすべての患者群で大きかった.抑制性のshell-to-VTAおよびshell-to-mPFC結合は,ASD群で健常対照群,MDD群,SCZ群よりも大きかった.さらに,VTA-to-coreおよびVTA-to-shellの結合は,ASD群では興奮性であったが,健常対照群,MDD群,SCZ群では抑制性であった.本研究結果から,中脳辺縁系ドパミン関連回路におけるシグナル伝達障害は,さまざまな精神疾患の神経病態に関連する可能性が示唆された.これらの知見は,各疾患に特有の神経回路の障害に対する理解を深め,疾患特異的な治療法の開発に貢献することが期待される.
2)東京大学心の多様性と適応の連携研究機構
3)和歌山県立医科大学神経精神科
4)東京大学国際高等研究所ニューロインテリジェンス国際研究機構
https://doi.org/10.57369/pnj.24-029
はじめに
中脳辺縁系ドパミン関連回路は,腹側被蓋野(ventral tegmental area:VTA)を起点とし,側坐核(nucleus accumbens:NAc)や前頭前皮質(prefrontal cortex:PFC)などのさまざまな脳領域とつながっている3)10)13)16)18)28)30)35)37).VTAとNAcは双方向的な神経結合をもつ3)9).NAcは解剖学的にも機能的にもshellとcoreの2つのサブ領域に分かれており2),それぞれ個別の経路でPFCに投射している2)3)10)16)37).一方で,shellとcoreは互いに密に連絡し合っている3)34).
中脳辺縁系ドパミン関連回路は,報酬,嫌悪,痛み,意欲,社会的動機,強化学習,注意,意思決定,運動制御など,さまざまな機能に関与している2)10)11)16)18)30)35)36).これらの機能障害は,多くの精神疾患で報告されており7)8)38),また,中脳辺縁系回路の変化と関連している可能性があ
る1)4)6)7)9)10)11)13)17)19)20)25)26)28)29)33)38).
例えば,統合失調症(schizophrenia:SCZ)の精神病症状(妄想や幻覚など)には中脳辺縁系回路の活動亢進があり,実際,薬理学的治療の標的となっている31).一方,ドパミン神経機能の低下や線条体機能障害は,感情の平板化や意欲の欠如といった陰性症状の一因となる4)21)22).加えて,中脳辺縁系回路の活動鈍化は,無感情や抑うつ気分などを特徴とする大うつ病(major depressive disorder:MDD)にも関係している6)7)11)12)15)17)36)39).
脳深部刺激療法は,脳に電極を埋め込み,標的部位を電気的に刺激する外科的な治療法であるが,MDD患者のNAcを刺激するために応用されている5).さらに,自閉スペクトラム症(autism spectrum disorder:ASD)が中脳辺縁系回路の障害と関連しており9)19)25)26)33),中脳辺縁系回路の活動低下は社会的交流19)や報酬処理26)の障害と関連していることが報告されている.
これらの先行研究から,中脳辺縁系回路の異常がさまざまな精神疾患の根底にある可能性があり,これらの疾患に共通する異常と疾患特異的な異常があることが予想できる.
われわれが以前に行った安静時脳機能計測(resting-state functional magnetic resonance imaging:rs-fMRI)を用いた研究では,中脳辺縁系回路と関連するとされるVTA関連の安静時脳機能結合の違いと共通性をSCZ,MDD,双極性障害において調べた23).内側上前頭皮質(VTA-PFC)の結合性において,健常対照群やSCZより,MDDと双極性障害の安静時脳機能結合が低かったが,VTA-NAcの安静時脳機能結合には疾患群で違いがみられなかった23).そこで,本研究では,VTA,NAcのcoreとshell,内側PFC(medial prefrontal cortex:mPFC)を関心領域(region of interest:ROI)として,動的因果モデリング解析(dynamic casual modeling analysis:DCM analysis)により,さまざまな精神疾患(MDD,ASD,SCZ)と健常対照群(healthy controls:HC)における中脳辺縁系回路の詳細な相違点や類似点を検討するためにrs-fMRIによる安静時脳機能結合の計測を行った24).
I.研究の方法および結果
本研究では,Japanese Strategic Research Program for the Promotion of Brain Science(SRPBS)Decoded neurofeedback(DecNef)Consortium8)のデータベース32)40)と東京大学精神科で取得した555名:SCZ群140名(女性45.0%),MDD群127名(44.9%),ASD群119名(15.1%),HC群169名(34.9%)のrs-fMRIデータを使用した.本研究は,適切な施設審査委員会の承認を得ており32),すべての参加者に書面によるインフォームド・コンセントを提供した.
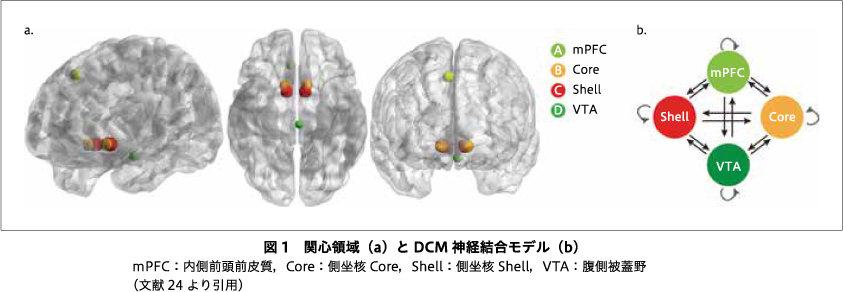
関心領域として,VTA,NAcのcoreとshell,mPFCを設定し(図1),スペクトルDCM27)によりrs-fMRIデータを解析し,ROI間の安静時脳機能結合を群間比較した.さらに,群間差を認めた安静時脳機能結合において,各群における症状との相関を解析した.
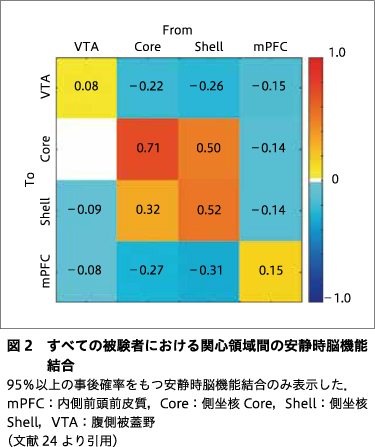
すべての被験者群に共通して,shell-to-coreおよびcore-to-shellの結合に興奮性結合が認められた.一方,VTA-to-VTA,core-to-core,shell-to-shell,mPFC-to-mPFC,core-to-VTA,shell-to-VTA,mPFC-to-VTA,mPFC-to-core,VTA-to-shell,mPFC-to-shell,VTA-to-mPFC,core-to-mPFC,shell-to-mPFCに抑制性結合が認められた(図2).
抑制性のVTA-to-VTAは,SCZ群でHC群よりも大きかった.VTA-to-mPFCは,SCZ群では抑制性であったが,HC群では興奮性であった.抑制性のVTA-to-VTAおよびcore-to-VTAは,MDD群でHC群よりも大きかった.抑制性のshell-to-VTA,core-to-core,core-to-mPFC,shell-to-mPFCは,HC群よりもASD群で大きかった.興奮性のshell-to-coreもHC群よりASD群で大きかった.VTA-to-core,mPFC-to-core,VTA-to-shell,mPFC-to-shellは,ASD群では興奮性であったが,HC群では抑制性であった.逆に,VTA-to-mPFCはASD群では抑制性であったが,HC群では興奮性であった.
疾患群での比較において,SCZ群ではMDD群に比べ,抑制性のshell-to-VTAが小さく,抑制性のVTA-to-coreおよびVTA-to-shellが大きかった.VTA-to-mPFCは,SCZ群では抑制性であったが,MDD群では興奮性であった.抑制性のshell-to-VTA,core-to-core,shell-to-mPFCは,MDD群よりもASD群で大きかった.VTA-to-core,mPFC-to-core,VTA-to-shell,mPFC-to-shellは,ASD群では興奮性であったが,MDD群では抑制性であった.抑制性のcore-to-VTAおよびshell-to-VTAは,ASD群よりもSCZ群で低かった.VTA-to-coreおよびVTA-to-shellは,SCZ群では抑制性であったが,ASD群では興奮性であった.
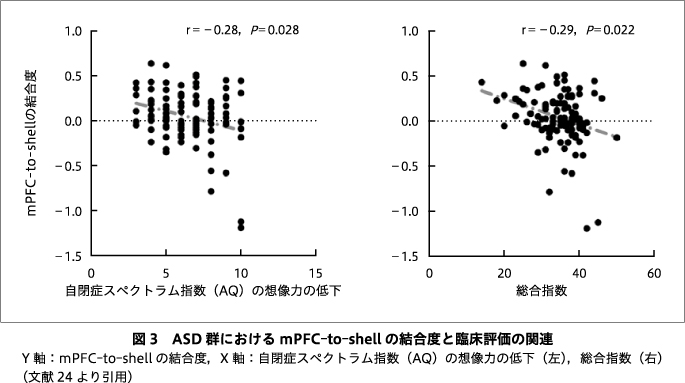
ASD群において,mPFC-to-shellは,自閉症スペクトラム指数(Autism-spectrum Quotient:AQ)の下位尺度である想像力(imagination)の低下,およびAQの総合指数と負の相関を示した(r=-0.28,PBonferroni-corrected=0.028,r=-0.29,PBonferroni-corrected=0.022)(図3).その他の安静時脳機能結合と症状の関連はみられなかった.
II.考察
本研究では,rs-fMRIデータを用いて,VTA,NAcのcoreとshell,mPFC間の安静時脳機能結合をMDD,ASD,SCZ,HC群間で比較し,中脳辺縁系回路における疾患共通,もしくは特異的な変異を検出した.
HC群と比較して,SCZ,MDD,ASD群では,興奮性のshell-to-coreが大きかった.NAcにおいてshellとcoreは密に相互的な神経結合を形成していることから3)34),これらの結果は,shell-to-core結合における不均衡な神経情報の流れが,精神症状と関連している可能性を示唆しているといえる.抑制性のshell-to-VTAおよびshell-to-mPFCは,ASD群でMDD群,SCZ群,HC群よりも大きかった.逆に,VTA-to-coreおよびVTA-to-shellは,ASD群では興奮性であったが,MDD,SCZ,HC群では抑制性であった.したがって,NAcに関連する結合性の障害はASDの神経病理と関連する可能性がある.さらに,MDD群とSCZ群では,VTAの抑制性入力が上昇しており,これは中脳辺縁系回路のドパミン神経機能の低下と関連している可能性がある.
以上をまとめると,各疾患は,中脳皮質辺縁系ドパミン関連回路における特異的な変化と関連しており,これらの神経回路における神経結合の障害は,これらの精神疾患の神経病理にかかわっている可能性がある.したがって,本研究結果は,各精神疾患の効果的な治療法開発につながる重要なターゲットを示唆しているといえる.
おわりに
本研究にはいくつかの課題が残る.第1に,SCZとMDDの参加者のほとんどが薬物治療を受けていたことから,薬物治療が結果に及ぼす影響を除外することはできなかった.今後は薬物治療を受けていない被験者も含め,追加で解析を行う必要がある.第2に,本研究では中脳辺縁系回路の検討を目的としていたため,VTA,NAcのshellとcore,mPFCの4領域を対象とした.しかし,mPFCは比較的広大な領域であり,さまざまな亜領域を含んでいる.さらに,他の脳領域も精神疾患の神経基盤に関与している可能性もある.今後の研究では,MDDなどの主な症状である無快感症(anhedonia)と関連があるとされる前帯状皮質など36)39),他の脳領域も含めるべきである.第3に,安静時脳機能結合は神経伝達物質の動態を反映すると言われているが,今回の研究ではドパミン神経伝達そのものを測定しているわけではない.したがって,将来的には,さまざまな精神疾患におけるドパミン神経伝達を測定または操作するために,PET研究や薬理学的研究を併用すべきである.第4に,群間比較において,スキャナーやプロトコルの違いによる影響を統計的に排除したが,それでもなお,これらの要因が群間比較の結果に影響を及ぼす可能性がある.今後,DCM解析のためにComBatのようなハーモナイズ法14)が開発されるべきである.
本論文はPCN誌に掲載された最新の研究論文24)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) Abi-Dargham, A.: Schizophrenia: overview and dopamine dysfunction. J Clin Psychiatry, 75 (11); e31, 2014![]()
2) Baliki, M. N., Mansour, A., Baria, A. T., et al.: Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain. J Neurosci, 33 (41); 16383-16393, 2013![]()
3) Beier, K. T., Steinberg, E. E., DeLoach, K. E., et al.: Circuit architecture of VTA dopamine neurons revealed by systematic input-output mapping. Cell, 162 (3); 622-634, 2015![]()
4) Brisch, R., Saniotis, A., Wolf, R., et al.: The role of dopamine in schizophrenia from a neurobiological and evolutionary perspective: old fashioned, but still in vogue. Front Psychiatry, 5; 47, 2014![]()
5) Cleary, D. R., Ozpinar, A., Raslan, A. M., et al.: Deep brain stimulation for psychiatric disorders: where we are now. Neurosurg Focus, 38 (6); E2, 2015![]()
6) Cléry-Melin, M. L., Jollant, F., Gorwood, P.: Reward systems and cognitions in major depressive disorder. CNS Spectr, 24 (1); 64-77, 2019![]()
7) Coccurello, R.: Anhedonia in depression symptomatology: appetite dysregulation and defective brain reward processing. Behav Brain Res, 372; 112041, 2019![]()
8) DecNef Project. (https://bicr.atr.jp/decnefpro/) (参照2024-01-09)
9) Fernández, M., Mollinedo-Gajate, I., Peñagarikano, O.: Neural circuits for social cognition: implications for autism. Neuroscience, 370; 148-162, 2018![]()
10) Haber, S. N.: The place of dopamine in the cortico-basal ganglia circuit. Neuroscience, 282; 248-257, 2014![]()
11) Hamon, M., Blier, P.: Monoamine neurocircuitry in depression and strategies for new treatments. Prog Neuropsychopharmacol Biol Psychiatry, 45; 54-63, 2013![]()
12) Han, M. H., Nestler, E. J.: Neural substrates of depression and resilience. Neurotherapeutics, 14 (3); 677-686, 2017![]()
13) Islam, K. U. S., Meli, N., Blaess, S.: The Development of the mesoprefrontal dopaminergic system in health and disease. Front Neural Circuits, 15; 746582, 2021![]()
14) Johnson, W. E., Li, C., Rabinovic, A.: Adjusting batch effects in microarray expression data using empirical Bayes methods. Biostatistics, 8 (1); 118-127, 2007![]()
15) Koo, J. W., Chaudhury, D., Han, M. H., et al.: Role of mesolimbic brain-derived neurotrophic factor in depression. Biol Psychiatry, 86 (10); 738-748, 2019![]()
16) Lammel, S., Lim, B. K., Malenka, R. C.: Reward and aversion in a heterogeneous midbrain dopamine system. Neuropharmacology, 76 (Pt B0 0); 351-359, 2014![]()
17) Lammel, S., Tye, K. M., Warden, M. R.: Progress in understanding mood disorders: optogenetic dissection of neural circuits. Genes Brain Behav, 13 (1); 38-51, 2014![]()
18) Liu, H., Zakiniaeiz, Y., Cosgrove, K. P., et al.: Toward whole-brain dopamine movies: a critical review of PET imaging of dopamine transmission in the striatum and cortex. Brain Imaging Behav, 13 (2); 314-322, 2019![]()
19) Mandic-Maravic, V., Grujicic, R., Milutinovic, L., et al.: Dopamine in autism spectrum disorders-Focus on D2/D3 partial agonists and their possible use in treatment. Front Psychiatry, 12; 787097, 2022![]()
20) McCutcheon, R., Beck, K., Jauhar, S., et al.: Defining the locus of dopaminergic dysfunction in schizophrenia: a meta-analysis and test of the mesolimbic hypothesis. Schizophr Bull, 44 (6); 1301-1311, 2018![]()
21) McCutcheon, R. A., Abi-Dargham, A., Howes, O. D.: Schizophrenia, dopamine and the striatum: from biology to symptoms. Trends Neurosci, 42 (3); 205-220, 2019![]()
22) McCutcheon, R. A., Reis Marques, T., Howes, O. D.: Schizophrenia-an overview. JAMA Psychiatry, 77 (2); 201-210, 2020![]()
23) Nakamura, Y., Okada, N., Koshiyama, D., et al.: Differences in functional connectivity networks related to the midbrain dopaminergic system-related area in various psychiatric disorders. Schizophr Bull, 46 (5); 1239-1248, 2020![]()
24) Nakamura, Y., Ishida, T., Tanaka, S. C., et al.: Distinctive alterations in the mesocorticolimbic circuits in various psychiatric disorders. Psychiatry Clin Neurosci, 77 (6); 345-354, 2023![]()
25) Pavăl, D.: A dopamine hypothesis of autism spectrum disorder. Dev Neurosci, 39 (5); 355-360, 2017![]()
26) Pavăl, D., Micluţia, I. V.: The dopamine hypothesis of autism spectrum disorder revisited: current status and future prospects. Dev Neurosci, 43 (2); 73-83, 2021![]()
27) Razi, A., Kahan, J., Rees, G., et al.: Construct validation of a DCM for resting state fMRI. Neuroimage, 106; 1-14, 2015![]()
28) Reneman, L., van der Pluijm, M., Schrantee, A., et al.: Imaging of the dopamine system with focus on pharmacological MRI and neuromelanin imaging. Eur J Radiol, 140; 109752, 2021![]()
29) Robison, A. J., Thakkar, K. N., Diwadkar, V. A.: Cognition and reward circuits in schizophrenia: synergistic, not separate. Biol Psychiatry, 87 (3); 204-214, 2020![]()
30) Soares-Cunha, C., Coimbra, B., Sousa, N., et al.: Reappraising striatal D1- and D2-neurons in reward and aversion. Neurosci Biobehav Rev, 68; 370-386, 2016![]()
31) Strange, P. G.: Antipsychotic drugs: importance of dopamine receptors for mechanisms of therapeutic actions and side effects. Pharmacol Rev, 53 (1); 119-133, 2001![]()
32) Tanaka, S. C., Yamashita, A., Yahata, N., et al.: A multi-site, multi-disorder resting-state magnetic resonance image database. Sci Data, 8 (1); 227, 2021![]()
33) Trujillo Villarreal, L. A., Cárdenas-Tueme, M., Maldonado-Ruiz, R., et al.: Potential role of primed microglia during obesity on the mesocorticolimbic circuit in autism spectrum disorder. J Neurochem, 156 (4); 415-434, 2021![]()
34) van Dongen, Y. C., Deniau, J. M., Pennartz, C. M. A., et al.: Anatomical evidence for direct connections between the shell and core subregions of the rat nucleus accumbens. Neuroscience, 136 (4); 1049-1071, 2005![]()
35) Volman, S. F., Lammel, S., Margolis, E. B., et al.: New insights into the specificity and plasticity of reward and aversion encoding in the mesolimbic system. J Neurosci, 33 (45); 17569-17576, 2013![]()
36) Wang, S., Leri, F., Rizvi, S. J.: Anhedonia as a central factor in depression: neural mechanisms revealed from preclinical to clinical evidence. Prog Neuropsychopharmacol Biol Psychiatry, 110; 110289, 2021![]()
37) Weele, C. M. V., Siciliano, C. A., Tye, K. M.: Dopamine tunes prefrontal outputs to orchestrate aversive processing. Brain Res, 1713; 16-31, 2019![]()
38) Weidenauer, A., Bauer, M., Sauerzopf, U., et al.: Making Sense of: sensitization in schizophrenia. Int J Neuropsychopharmacol, 20 (1); 1-10, 2016![]()
39) Whitton, A. E., Treadway, M. T., Pizzagalli, D. A.: Reward processing dysfunction in major depression, bipolar disorder and schizophrenia. Curr Opin Psychiatry, 28 (1); 7-12, 2015![]()
40) Yamashita, A., Yahata, N., Itahashi, T., et al.: Harmonization of resting-state functional MRI data across multiple imaging sites via the separation of site differences into sampling bias and measurement bias. PLoS Biol, 17 (4); e3000042, 2019![]()