双極性障害や統合失調症などの精神疾患は高い遺伝性をもつことが知られているが,その遺伝情報の実体は長らく謎であった.しかし,近年のゲノム解析技術の発展によってDNAにコードされた情報を網羅的に読み取り解析することが可能になり,精神疾患と関連するゲノム特徴が徐々に明らかになってきた.統合失調症・自閉スペクトラム症については,ゲノム解析技術の発展により,効果の大きな関連レアバリアントが見いだされてきたが,双極性障害に対する理解は相対的に遅れており,特に関連レアバリアントに未知が多い.われわれは,レアバリアントのなかでも,特に稀な変異であるデノボ変異に注目し,発端者のみが双極性障害で両親が非罹患という孤発例を中心に,双極性障害に関連する遺伝子・変異を354家系から探索し,この報告により精神医学奨励賞をいただいた(Nishioka, et al., Nature Communications, 2021).本研究により,双極性障害デノボ変異の特徴として,(i)進化的に自然淘汰を受けやすい遺伝子,high pLI遺伝子の機能喪失変異が多いこと,(ii)シナプス・イオンチャネル関連遺伝子の機能障害変異が多いこと,(iii)XKR6機能障害変異が双極性障害で2例あり,広義の精神疾患・神経発達障害で有意に多いこと,(iv)KMT2Cをはじめ,体細胞モザイク性の機能障害変異は,発達障害原因遺伝子上に多く,SRCAP遺伝子で2例検出した.これまでのゲノム研究により双極性障害と関連するバリアントの特徴が明らかになってきた一方で,双極性障害と呼ばれる疾患群のなかでの異質性と,統合失調症や神経発達障害との疾患をまたいだ共通性も同時に明らかになってきた.ゲノム特徴と表現型の対応づけを,従来の診断分類より詳細に,あるいはそれを横断して行う必要性も示されたともいえる.本稿では,双極性障害デノボ変異研究を中心に,その背景と今後の展望を述べたい.
2)順天堂大学医学部気分障害分子病態学講座
3)理化学研究所脳神経科学研究センター分子精神病理研究チーム
https://doi.org/10.57369/pnj.23-099
はじめに
双極性障害や統合失調症などの精神疾患は,家系内の集積がみられることが昔から知られている.例えば,親が精神疾患をもつ場合,その子どもは同様の表現型をもつ可能性が一般集団よりも高くなる.この観察から,何らかの意味で遺伝因子が精神疾患にかかわっているであろう,と考えられてきた.例えばうつ状態の患者がいたときに,家族に双極性障害の患者がいれば,双極性障害の可能性を念頭におくなど,臨床でも役に立ってきた知見でもある.研究の文脈では,特に一卵性双生児の診断一致率というのが遺伝因子の理解に重要となる.一卵性双生児は原則同じ遺伝情報をもつので,一卵性双生児での一致率が高い表現型・疾患というのは,その表現型・疾患に遺伝情報が深く関与しているといえる.例えば,双極性障害の診断一致率は40~50%である一方,一般集団における生涯罹患率は1%程度であることから,双極性障害の発症に遺伝因子が深く関与しているであろうと想定される7).しかし,このような家系の情報だけでは,遺伝情報の実体はわからず,現象の理解にとどまっていた.
I.ゲノム解析と精神疾患
遺伝情報がDNAという化学物質にコードされていることは周知の事実であるが,近年のゲノミクス技術によって,DNAから遺伝情報を読み解く技術が目覚ましく進んだ.マイクロアレイや次世代シーケンサーと呼ばれる機器によって,DNAにコードされた遺伝情報を広く,地引網のように網羅的にとらえることが可能となってきたのである.ヒト一人のゲノム情報1セットを文字におこすと,およそ60億文字,文庫本にしておよそ6万冊にあたるが5),このような膨大な情報は,通常の本のように目で順次読むことで処理しきれるものではない.DNA配列決定技術と並行して,並列計算システムなど大規模な情報解析技術が整備されることによって,ヒトゲノムの膨大な情報を処理することが現実的に可能となった.この新しい解析手法・学術体系は,「ゲノミクス」と呼ばれている.ゲノム(genome)とは,「gene」(遺伝子)と「-ome」(全体を意味する接尾語)からなる,遺伝子の総体という意味である.個別の遺伝子ではなく,遺伝子の総体を地引網のようにとらえようとする点が,古典的な遺伝学的解析と異なる点である.ゲノム情報・遺伝情報というのは,その個人の基盤として存在するので,関連といいつつも,原因であることを期待しているのは言うまでもない.
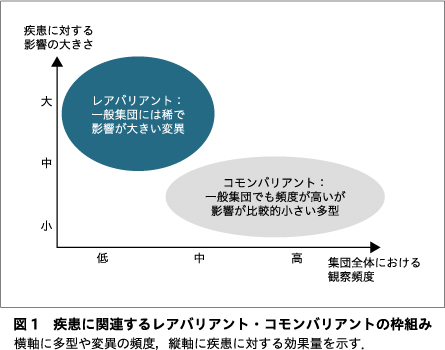
ゲノム解析技術によってヒトゲノムが網羅的に探索できるようになってきたが,ヒトゲノムのような膨大な情報から疾患に関連しそうな情報を取り出すには,効率的な探索戦略が必要となる.探索戦略の基礎となるフレームワークに,図1のようなものがある6).多型や変異と疾患に対する効果量が,逆相関するという考え方である.仮に疾患に大きく影響するような変異であれば,個体にとって不利なので,負の自然選択を受け,人口全体での頻度は低くとどまり,稀な変異(レアバリアント)にならざるをえない.逆に,人口全体での頻度が高いようなありふれた一塩基多型(single nucleotide polymorphism:SNP)といったコモンバリアントについては,疾患に対する影響は大きくないであろうと推定される.影響が大きな変異であれば,単一の変異(バリアント)で疾患をもたらすようなモノジェニック(単一遺伝子)なモデルで説明できることもあるが,影響が小さい多型・変異であれば,単一で疾患をもたらすことはなく,より集まって疾患に寄与するというポリジェニック(多数遺伝子)な疾患理解のモデルになる.疾患と関連するコモンバリアントは,主にマイクロアレイ(SNPチップ)を用いたゲノムワイド関連解析(genome wide association study:GWAS)によって検出されてきた.SNPチップは数百万のSNPを同時にジェノタイピングできるが,あらかじめ設定されたSNPに限定されるという欠点がある.疾患に関連するレアバリアントは,超並列シーケンサー(いわゆる次世代シーケンサー)を用いた全エクソームシーケンスによって,主に検出されてきた.エクソームシーケンスでは,エクソン領域(タンパク質コード領域)のバリアントを網羅的に検出することができ,これまで知られていなかった新しいバリアントも検出できるが,SNPチップに比べコストが高くなる.SNPのようなコモンバリアントを対象とするか,レアバリアントを対象とするかは,戦略上大きな検討ポイントとなる.
II.主要精神疾患におけるゲノム解析の知見
実際,精神疾患を対象としたゲノム解析のアプローチにより,精神疾患に関連する遺伝情報が徐々に明らかになってきている.統合失調症では,図1のフレームワークにあてはまる形で知見が重ねられてきており,この枠組みの意義を実証するとともに,統合失調症の遺伝学的理解・診断に向けて研究が進んでいる.一方の極であるレアバリアントとしては,NMDA(N-methyl D-aspartate)型グルタミン酸受容体サブユニットをコードする遺伝子GRIN2Aをはじめ,10程度の遺伝子の機能喪失変異や,複数種類のコピー数変化が,大きな効果量をもつものとして同定されている16).グルタミン酸神経伝達の重要な構成要素〔AMPA(α-3-hydroxy-5-methyl-4-isoxazolepropionate)型グルタミン酸受容体〕をコードするもう1つの遺伝子GRIA3も含め,統合失調症の病因として最も有力な仮説の1つであるグルタミン酸作動性神経伝達仮説を支持する結果が得られている.他方の極であるコモンバリアントとしては,数百の遺伝子座が,効果量としては小さい(オッズ比1.3程度)ものの,頻度が高いものとして同定されている15)17).後者のコモンバリアントにもシナプス関連遺伝子が多いという病態理解を進める知見も得られており,当初の目的である疾患病態解明に向かって着実に進んでいる.ゲノム研究の観点から,統合失調症は大枠としてシナプス機能不全の疾患といえる可能性が高く,関連遺伝子には,シナプス後構造におけるドパミン受容体のサブユニットをコードするDRD2が含まれている.統合失調症の病因として最も有力な仮説の1つがドパミン作動性システムの調節障害仮説であるが,ゲノム研究は,精神医学において長年信じられてきたこの仮説を支持するものである.
自閉スペクトラム症でもゲノム解析の知見が多く積み重ねられている.自閉スペクトラム症では,稀な変異の寄与が中心に明らかになっており,機能喪失変異を中心に,単一の原因遺伝子として説明できる水準の遺伝子が多数同定されている.コモンバリアントの寄与は相対的に小さいとされており,自閉スペクトラム症についてはレアバリアントを中心に理解が進んでいる.自閉スペクトラム症と関連するものとして,CHD8,SCN2A,ARID1Bなどをはじめ,百を超える遺伝子がレアバリアントを通した関連遺伝子として同定されている14).
双極性障害も,統合失調症を例に考えると,コモンバリアント・レアバリアントの双方が関連していると予想される.統合失調症に比べて双極性障害は相対的に重症度が低く,自然選択圧がより小さいと考えられるので,まずコモンバリアントの解析が先行した.Ikeda, M.らの報告をはじめ,国内外でGWASが進んでおり,シナプス関連遺伝子の領域を中心に数十のゲノム領域が関連することが示されている2)8).一方,双極性障害のレアバリアントは,統合失調症や自閉スペクトラム症に比べると十分には進んでおらず未知が多い.双極性障害の理解のために相対的に手つかずの領域といえる.国際コンソーシアムでのエクソームデータ・メタアナリシスで,AKAP11という遺伝子が,双極性障害と関連する(正確には双極性障害と統合失調症を一群としたときに有意に関連する)ことが報告されている13).Kushima, I. らがいくつかの短いコピー数変化との関連を報告している4).これら報告は,双極性障害研究に重要なマイルストンだが,双極性障害のレアバリアント理解は完全に尽くされたものではなく,双極性障害のゲノム構造理解のために,レアバリアント探索が課題となっている.
III.双極性障害におけるわれわれのゲノム解析
そこでわれわれは,レアバリアントのなかでも,特に稀な変異としてデノボ変異に注目し,双極性障害に対して大きな影響をもつ変異・遺伝子を探索した12).
1.方 法
双極性障害研究ネットワーク(Bipolar Disorder Research Network Japan:BDRNJ)からの参加者の方を中心に,本人は双極性障害であるが,両親は非罹患という孤発例の家族を中心に,合計171家族の方に参加いただき,他国のデータを合わせて,計354家系について,デノボ変異の解析を行った.ヘルシンキ宣言・関連ガイドラインを遵守し,関連施設の倫理承認を得て,計画を実行した.両親には存在しないが,発端者である子どもには存在する変異をデノボ変異といい〔デノボ(de novo):新たに生じるというラテン語表現〕,まさに新しく生じたばかりの変異であることから,レアバリアントのなかのレアバリアントといえ,効果が大きな変異が含まれていると期待できる.われわれは,2022年現在,双極性障害トリオ研究として世界最多354家系でのデノボ変異解析を行ったが,特にBDRNJの力によるところが大きい.また,受精卵前に生じる生殖系列のデノボ変異,先天的デノボ変異に加え,受精卵後の発生発達の過程で生じる体細胞性のデノボ変異,すなわち後天的デノボ変異も含めて解析したことが,本研究のもう1つの特徴である(図2).
2.high pLI遺伝子におけるデノボ変異
まず先天的デノボ変異について,双極性障害の子をもつ家族と対照群の家族を比較して双極性障害におけるデノボ変異の特徴を調べたところ,一般集団に観察されない稀な機能障害性のレアバリアントの数が多い傾向にあった.機能喪失変異によって表現型が不利になりやすくなるような遺伝子をhigh pLI遺伝子と定義すると3),双極性障害ではhigh pLI遺伝子における機能喪失変異が多いという結果となった.これは理論的にも自然な結果といえる.
3.稀な機能障害性デノボ遺伝子の生物学的特徴
稀な機能障害性のデノボ変異をもつ遺伝子の特徴として,シナプスやカルシウムイオンにかかわる遺伝子が多いという従来の双極性障害研究と一致する結果となった.稀な機能障害デノボ変異は,全臓器のなかでも特に前部帯状回で発現が多い遺伝子にみられるという傾向があり,単一核RNAseqデータ(アレン脳科学研究所パブリックデータ)を用いて解析したところ,興奮性神経細胞のあるサブタイプの一群に,特に発現の多い遺伝子に認められた.この興奮性神経細胞の一群は,発達障害原因遺伝子の発現やGWASで検出されたタグ遺伝子も多いという傾向があり,これらの重複する遺伝子がCACNA1Cというカルシウムチャネルをコードする遺伝子であった.CACNA1Cは,これまで双極性障害との関連が特に探索されてきた遺伝子であり,この結果は予想したものではなかったものの,これまでの解析の妥当性とCACNA1Cの重要性を間接的に裏付けるものだと考えられる.
4.広く精神疾患・神経発達障害と関連する遺伝子
双極性障害にかぎらず広く精神疾患・神経発達障害と関連する遺伝子を調べることで,精神症状に広く関与しているであろう遺伝子を探索したところ,XKR6という遺伝子が,稀な機能障害性のデノボ変異を通じて広義の精神神経疾患に関連していることが見いだされた.この遺伝子は,GWASで神経症傾向・リスク行動と関連しているなど,双極性障害と関連する要素がうかがえるものの,これまで注目されておらず,精神疾患との関連としては新規に見いだされた遺伝子といえる.KMT2Cは,重篤な神経発達障害であるKleefstra症候群の原因遺伝子として知られているが,本研究により双極性障害から統合失調症,自閉スペクトラム症まで広く機能喪失変異が検出される,すなわち多面発現を通して広く精神症状に関連することがわかった.
5.双極性障害における体細胞変異(後天的デノボ変異)
しかし,双極性障害におけるKMT2C機能喪失変異は,実は,体細胞モザイク変異,初期発生で生じた体細胞変異(後天的デノボ変異)であった.この例から,「神経発達障害原因遺伝子上のモザイク変異は,双極性障害を含むよりマイルドな表現型をもたらす」のではないかと考え,体細胞モザイク変異(後天的デノボ変異)を網羅的に検出した.2例から独立して,同じ遺伝子SRCAP上の機能障害モザイク変異を検出し,SRCAPはFloating-Harbor症候群の原因遺伝子であることから,作業仮説に支持的な結果を得た.KMT2CやSRCAPの変異が生殖系列として生じると,重篤な神経発達障害になり,体細胞変異として生じると,双極性障害や統合失調症など,内因性の精神疾患になる,というシナリオが想定される.
おわりに
本研究により,双極性障害のデノボ変異について知見が得られたものの,課題も多く残されている.今回は双極性障害と遺伝型の対応を探索したが,実際に見つかった遺伝子や変異は,双極性障害にとどまらず,他の疾患に関連している可能性が高く,また双極性障害を限られた遺伝子で説明できる可能性はきわめて低いと考えられる.遺伝型と表現型の対応という意味では,より踏み込んだ詳細な表現型を調べ,従来の診断とは異なる軸でも表現型を評価する必要があるというのが導かれる議論の1つである.近年,ゲノミクスによる疾患概念の精緻化の必要性が提唱されているが1),ゲノム解析による分類は,レアバリアント,コモンバリアントで総合的に行う必要があり,その点でもまだまだ解析の余地が多い.今後は,ゲノム特徴を起点として詳細な臨床評価を行い,遺伝型と表現型の対応を精緻にする必要がある.
また体細胞変異については探索的な結果であり,サンプルサイズを大きくして十分な数で疾患との関連を検討する必要がある11).この数年で,精神疾患における体細胞変異のデータは徐々に蓄積されているが,まだ検証できるほど十分なサンプルサイズではなく,データをさらに蓄積していく必要がある9)10).体細胞変異の寄与が実際にあるとすると,理論的に寄与が推定できるか,というのも課題である.生殖系列のゲノミクスは,一卵性双生児の診断一致率から計算される遺伝率の大きさを理論的な根拠・探索の原動力として進んできたが,体細胞変異の関連は理論的な根拠が強くなく,理論的推定が可能かどうかというのも大きな課題といえる.
利益相反
著者は,住友ファーマ株式会社と順天堂大学の共同研究講座である気分障害分子病態学講座に併任しているが,本研究には住友ファーマ株式会社の関与はない.
謝 辞 本研究は,双極性障害研究ネットワークの参加者の皆さんによって可能となりました.この場をお借りして御礼申し上げます.また本研究とその先行研究は,順天堂大学の加藤忠史教授,理化学研究所の高田篤チームリーダーを中心に多くの方のご支援・ご指導により可能となりました.この場をお借りして御礼申し上げます.
1) Geschwind, D. H., Flint, J.: Genetics and genomics of psychiatric disease. Science, 349 (6255); 1489-1494, 2015![]()
2) Ikeda, M., Takahashi, A., Kamatani, Y., et al.: A genome-wide association study identifies two novel susceptibility loci and trans population polygenicity associated with bipolar disorder. Mol Psychiatry, 23 (3); 639-647, 2018![]()
3) Karczewski, K. J., Francioli, L. C., Tiao, G., et al.: The mutational constraint spectrum quantified from variation in 141,456 humans. Nature, 581 (7809); 434-443, 2020![]()
4) Kushima, I., Nakatochi, M., Aleksic, B., et al.: Cross-disorder analysis of genic and regulatory copy number variations in bipolar disorder, schizophrenia, and autism spectrum disorder. Biol Psychiatry, 92 (5); 362-374, 2022![]()
5) Lander, E. S., Linton, L. M., Birren, B., et al.: Initial sequencing and analysis of the human genome. Nature, 409 (6822); 860-921, 2001![]()
6) Manolio, T. A., Collins, F. S., Cox, N. J., et al.: Finding the missing heritability of complex diseases. Nature, 461 (7265); 747-753, 2009![]()
7) McGuffin, P., Rijsdijk, F., Andrew, M., et al.: The heritability of bipolar affective disorder and the genetic relationship to unipolar depression. Arch Gen Psychiatry, 60 (5); 497-502, 2003![]()
8) Mullins, N., Forstner, A. J., O'Connell, K. S., et al.: Genome-wide association study of more than 40,000 bipolar disorder cases provides new insights into the underlying biology. Nat Genet, 53 (6); 817-829, 2021![]()
9) Nishioka, M., Bundo, M., Ueda, J., et al.: Identification of somatic mutations in postmortem human brains by whole genome sequencing and their implications for psychiatric disorders. Psychiatry Clin Neurosci, 72 (4); 280-294, 2018![]()
10) Nishioka, M., Bundo, M., Ueda, J., et al.: Identification of somatic mutations in monozygotic twins discordant for psychiatric disorders. NPJ Schizophr, 4 (1); 7, 2018![]()
11) Nishioka, M., Bundo, M., Iwamoto, K., et al.: Somatic mutations in the human brain: implications for psychiatric research. Mol Psychiatry, 24 (6); 839-856, 2019![]()
12) Nishioka, M., Kazuno, A. A., Nakamura, T., et al.: Systematic analysis of exonic germline and postzygotic de novo mutations in bipolar disorder. Nat Commun, 12 (1); 3750, 2021![]()
13) Palmer, D. S., Howrigan, D. P., Chapman, S. B., et al.: Exome sequencing in bipolar disorder identifies AKAP11 as a risk gene shared with schizophrenia. Nat Genet, 54 (5); 541-547, 2022![]()
14) Satterstrom, F. K., Kosmicki, J. A., Wang, J., et al.: Large-scale exome sequencing study implicates both developmental and functional changes in the neurobiology of autism. Cell, 180 (3); 568-584, e23, 2020![]()
15) Sekar, A., Bialas, A. R., de Rivera, H., et al.: Schizophrenia risk from complex variation of complement component 4. Nature, 530 (7589); 177-183, 2016![]()
16) Singh, T., Poterba, T., Curtis, D., et al.: Rare coding variants in ten genes confer substantial risk for schizophrenia. Nature, 604 (7906); 509-516, 2022![]()
17) Trubetskoy, V., Pardiñas, A. F., Qi, T., et al.: Mapping genomic loci implicates genes and synaptic biology in schizophrenia. Nature, 604 (7906); 502-508, 2022![]()