近年,小脳と統合失調症の関連性が再注目されている.特に,Crus I/IIは,統合失調症の症状や認知障害と関連する前頭前野と解剖学的・機能的な結合をもち,統合失調症に大きく関与していることが示唆されている.統合失調症は,その経過のなかで,進行性の脳体積の変化が生じることが明らかにされているが,Crus I/IIの構造にどのような差異がみられるかは不明であった.本研究の目的は,統合失調症の臨床病期でCrus I/IIの構造にどのような差異がみられるかを明らかにすることである.本研究の対象には,統合失調症73名(精神病発症ハイリスク者28名,初回エピソード統合失調症17名,慢性統合失調症28名)と健常対照者79名が含まれる.小脳に最適化された半自動分割化法を用いて,Crus I/IIを抽出し,その灰白質・白質の体積について,グループ,性,およびそれらの交互作用の効果を解析した.その結果,両側Crus I/IIの白質体積にグループ×性の交互作用が有意であり,精神病発症ハイリスク群の男性グループで,Crus I/IIの白質体積は有意に増大していた.一方,女性では,有意なグループの効果は示されなかった.さらに,Crus I/IIの白質および灰白質体積は,精神病発症ハイリスク群では,症状の重症度と正の相関を示したが,対照的に初回エピソード群では,灰白質体積は,症状の重症度とは負の相関を示した.本結果は,Crus I/IIの形態が統合失調症に性差および病期差をもって関与していることを示すとともに,Crus I/IIの白質体積の変化は,精神病発症ハイリスクの早期発見や治療の生物学的指標となる可能性があることを示唆する.
2)東京大学大学院医学系研究科精神医学分野
3)東京大学心の多様性と適応の連携研究機構
4)東京大学大学院総合文化研究科進化認知科学研究センター
5)東京大学ニューロインテリジェンス国際研究機構
https://doi.org/10.57369/pnj.23-037
はじめに
小脳は,その名が示すように,大脳と比較して圧倒的に小さく,その体積は大脳の10分の1ほどである.体積とは対照的に,小脳に含まれる細胞の数は,脳全体の約8割を占める11).このことは,小脳が高次の情報機能に関与していることを示唆するものであるが,精神医学において,小脳を主な対象とした研究報告はほとんどなかった.従来,小脳は,主に運動機能を担うと考えられてきた.しかし近年,小脳の機能や構造について研究が進むにつれて,高次の認知機能にも重要な役割を果たすことが支持されるようになってきた.このように小脳が果たす役割が拡大されるなか,複雑な精神機能の障害を呈する統合失調症に,小脳が関与しているという仮説が注目されるようになってきた1).
統合失調症は,幻覚・妄想などの陽性症状,感情鈍麻・意欲低下などの陰性症状を主症状として,精神機能に多様な病態を呈する.一般的に思春期から青年期にかけて発症することが多く,慢性的な経過を辿る.そして,その経過のなかで,進行性の脳体積の変化が生じることが明らかにされている.脳体積の変化は,発症前の精神病発症ハイリスクの段階でも生じており2)7)29),実際に統合失調症を発症するグループとしないグループでは,その特性が異なることも報告されている28).このようなことから,統合失調症のそれぞれの臨床病期で,異なる脳病態が観察されることが想定される.また,それぞれの臨床病期に関与する脳構造変化を特定することは,精神病発症ハイリスク状態から精神病の発症を予防することや,症状の進行を抑止する生物学的指標候補として有用であること,さらに,病態基盤の解明に役立つことが期待されている25).
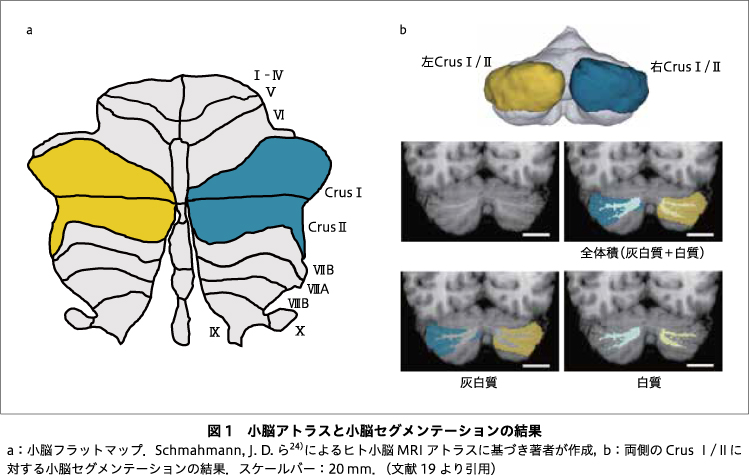
これまでに,統合失調症のそれぞれの臨床病期で脳構造にどのような差異がみられるかについて,多くの磁気共鳴画像(magnetic resonance imaging:MRI)研究は,大脳構造や皮質下体積に着目して実施されてきた.しかし,小脳については,統合失調症の特定のステージに焦点を当てたものがほとんどであり,それぞれの臨床病期における小脳構造の差異は不明である.精神医学における小脳構造研究は,大脳に比べ圧倒的に少ないものの,ある程度の知見が得られてきている.統合失調症を対象とした初期の小脳構造研究の多くは,小脳虫部を対象としている15)16)30).また,初期の研究では,主にマニュアルトレーシングにより小脳虫部の構造を評価していたが,脳画像解析技術の進歩とともに,小脳半球部を含めて自動解析による評価も可能となってきた.そして,これまでの解析から,小脳の小葉構造のなかでも,Crus I/IIが統合失調症に関与していることが示唆されている.Crus I/IIは,小葉VIとともに小脳半球部の側方・後方に位置する(図1a).ヒト小脳において,側方・後方の半球領域は,高次の機能と密接に関連しているとされ,形態的にも最も発達した部位である.Crus Iは,最も外側に突き出しており,最も大きい小脳領域である.一方,Crus IIは,Crus Iと隣接した下方に位置し,Crus Iに次いで大きく発達している.このような形態的特徴をもつCrus I/IIは,特に統合失調症の症状や認知障害と関連する前頭前野と解剖学的・機能的な結合をもつ3)4)26).そのため,それぞれの臨床病期で小脳Crus I/IIの構造にどのような差異がみられるかを明らかにすることは,統合失調症の病態理解や,予防や治療法の開発につながる可能性がある.
本研究は19),統合失調症の異なる臨床病期である,精神病発症ハイリスク,初回エピソード統合失調症,慢性期統合失調症において,小脳Crus I/IIの構造にどのような差異がみられるか,また,それぞれの病期における症状の重症度との関連を概説することを目的とした.この成果を踏まえ,今後の統合失調症における小脳構造研究の展望について述べたい.
I.研究の方法および結果
1.方 法
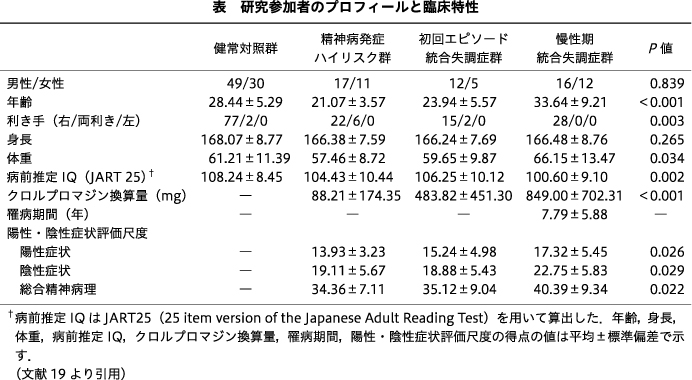
対象は,73名の統合失調症群と,健常対照群79名であった(表).統合失調症の参加者の臨床病期は,28名が精神病発症ハイリスク,17名が初回エピソード統合失調症,28名が慢性期統合失調症であった.全参加者について,MRI撮像と,利き手,病前推定知能指数について評価を行った.また,精神病発症ハイリスク群,初回エピソード統合失調症群,慢性期統合失調症群については,陽性・陰性症状評価尺度(Positive and Negative Syndrome Scale:PANSS)を用いて精神症状を評価した13).画像解析については,半自動分割化法を用いてCrus I/IIへの分割を行った後,詳細な評価を行うために,灰白質・白質への分割を行った(図1b).さらに,小脳体積と精神症状の重症度との関連を調べるため,重回帰分析を実施した.
本研究は,ヘルシンキ宣言に基づき計画され,東京大学医学部附属病院倫理委員会の承認を経て実施された(第397号,第2226号).研究参加に関する十分な説明の後,参加者全員から書面によるインフォームド・コンセントを得たのち,計測を行った.
2.結 果
1)統合失調症の臨床病期における小脳体積の違い
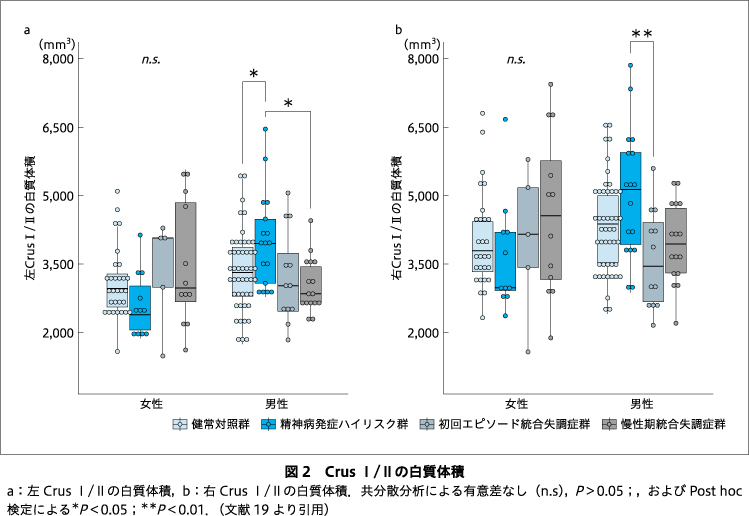
Crus I/IIの両側の白質において,グループ×性別の交互作用に有意な効果がみられた.単純主効果の検定の結果,男性群において,グループの主効果が有意であった.Holm法を用いた多重比較から,男性群では,左Crus I/IIの白質体積が,精神病発症ハイリスク群において,健常対照群,慢性期統合失調症群よりも有意に増大していた(図2a).また,右Crus I/IIの白質体積については,精神病発症ハイリスク群で,初回エピソード統合失調症群よりも有意に増大していた(図2b).このような有意な体積の変化は,白質体積のみに観察され,灰白質体積,およびCrus I/IIの全体積(灰白質+白質)には確認されなかった.一方,女性群においては,どの領域においても,グループの主効果はみられなかった.
2)Crus I/IIの体積と統合失調症の重症度との関連性
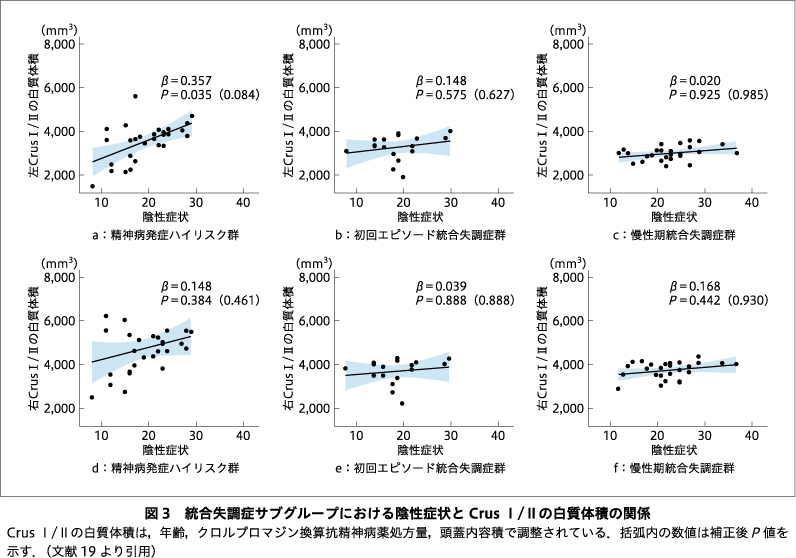
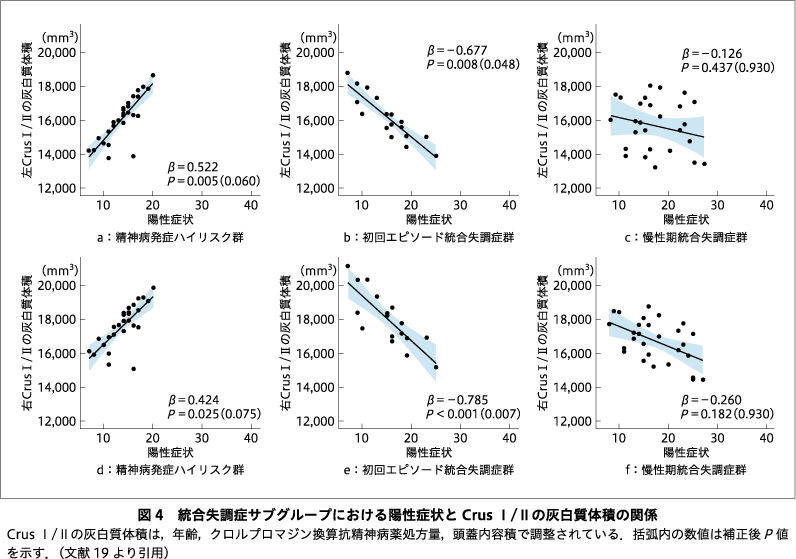
精神病発症ハイリスク群では左Crus I/IIの白質体積と陰性症状の重症度との間に正の関連が認められたが,右Crus I/IIの白質体積では関連が認められなかった(図3a,d).また,精神病発症ハイリスク群とは対照的に,初回エピソード統合失調症群および慢性期統合失調症群では,両側のCrus I/IIの白質体積と陰性症状の重症度との間に有意な関連は認められなかった(図3b,c,e,f).両側Crus I/IIの灰白質体積は,精神病発症ハイリスク群では陽性症状の重症度と正の相関を示した一方で,初回エピソード統合失調症群では,陽性症状と有意な負の関連が認められた(図4a,b,d,e).しかしながら,どの関連性も,多重比較補正では有意差が残らなかった.一方,精神病発症ハイリスク群や初回エピソード統合失調症群とは対照的に,慢性期統合失調症群では有意な関連は認められなかった(図4c,f).
II.考察―本論文の意義,苦労・工夫したことなどを含めて―
本研究では,統合失調症のそれぞれの臨床病期(精神病発症ハイリスク,初回エピソード統合失調症,慢性期統合失調症)で,小脳構造にどのような特性がみられるか,また,症状の重症度との関連性を,性別を考慮しながら,検討した.本研究は,限られた参加者を対象としており,予備的な結果ではあるが,統合失調症の各臨床病期における,小脳Crus I/IIの体積を詳細に調査した初めての研究である.本研究の解析から,精神病発症ハイリスクの男性では,両側の小脳Crus I/IIの白質体積が有意に増大していることが示された.さらに,それぞれの臨床病期ごとで,小脳Crus I/IIの体積と精神病症状の重症度の関係性に異なる関連パターンが見いだされた.本研究結果は,統合失調症の臨床病期と性別により,小脳が関与する神経基盤が異なることを示唆するとともに,その理解と治療において,臨床病期と性別にも注目することの重要性を強調する.
統合失調症では,疫学,抗精神病薬に対する反応,臨床経過など,さまざまな側面に性差があるにもかかわらず,脳構造を調べた研究において,性差を検討した研究は少なかった.いくつかの先行研究において,本研究と同様に,統合失調症では,複数の脳領域で,男女で脳構造の変化に違いがあることが認められている5)20)27).臨床的には,女性に比べて男性のほうが,発症が早く,陰性症状の重症化もよくみられ,さらに,女性より男性のほうが,精神病発症ハイリスクの状態から,実際に精神病を発症するリスクが高い6)17)22).統合失調症における,このような男性特有の特性を考慮すると,本研究における,精神病発症ハイリスクの男性特有の白質体積の変化は,統合失調症の臨床諸症状の性差を反映している可能性がある.さらに,本研究において,精神病発症ハイリスク群では陰性症状の重症度と,左Crus I/IIの白質体積の間に正の関係があることが確認された.これらのことから,Crus I/IIの白質体積の増大は,精神病発症ハイリスクの臨床症状に関連する生物学的特徴となりうることや,早期発見や早期治療のターゲットとして有用である可能性がある.このことをより正確に検証するためには,今後,より多くの参加者を対象とした研究の実施が必要である.
一方,統合失調症における灰白質体積の減少を示したいくつかの先行研究14)18)とは対照的に,灰白質体積に統計的な有意差を見いだせなかった.この原因として,先行研究では,数百人から数千人の参加者が含まれていることや,病期や性差の違いを検討していないといった研究デザインの違いが考えられる.しかし,本研究において,Crus I/IIの両側の灰白質体積と陽性症状との関連については,精神病発症ハイリスク群と初回エピソード統合失調症群との間で逆方向の関連が観察されたことは興味深く,それぞれの臨床病期で小脳が関与するメカニズムが異なる可能性を示唆する.
脳画像構造解析は,体積の変化など構造をとらえることができる一方,その変化をもたらすメカニズムまでは,検証することができない.そこで,過去の知見を活用しながら,精神病発症ハイリスクの男性における白質体積の増加を引き起こすメカニズムと,精神病発症ハイリスク群と初回エピソード統合失調症群でCrus I/IIの灰白質体積と陽性症状に異なる関連パターンがみられたことについて考察したい.まず,本研究において,精神病発症ハイリスク群に観察された白質体積の性差は,性ステロイドホルモンが関与している可能性がある.性ステロイドホルモンは,思春期における白質体積の微細構造の発達に関与しており9)23),その作用は男女で異なることが報告されている.例えば,思春期の男児においてテストステロンは,拡散異方性の指標であるfractional anisotropyや軸索の長さと正の相関がある一方,女児では,これらの値は血清エストラジオールと負の相関を示した12).さらに,精神病発症ハイリスク群では,健常群に比べ,性ステロイドホルモンのレベルに異常があることが報告されている10).このような知見から,性ステロイドホルモンは,精神病発症ハイリスク群でみられた白質体積の男女差を引き起こす要因として推測される.次に,精神病発症ハイリスク群と初回エピソード統合失調症群でCrus I/IIの灰白質体積と陽性症状に異なる関連パターンがみられたことについて,サイトカインによる神経炎症仮説を用いて検討したい.プリオン病やアルツハイマー病のような進行性の脳構造変化を伴う疾患では,神経細胞の損失や臨床症状が出現する前に,ミクログリアが活性化することが示されている.そして,このミクログリアの活性化は,灰白質体積の増大を引き起こす8).このことから,ミクログリア活性化は,精神病発症ハイリスク群におけるCrus I/IIの灰白質体積と陽性症状に正の相関を引き起こす要因となる可能性がある.一方,初回エピソード統合失調症群における負の相関パターンは,ミクログリアの活性化の後に引き続いて起こる神経細胞の減少を反映している可能性がある.
本研究の実施にあたり,苦労した点・および工夫した点を述べたい.まず,苦労した点としては,小脳の各小葉への分割が挙げられる.本研究では,米国の研究グループが開発した小脳自動分割化法を使用した31).2010年頃から,複数の欧米の研究グループが,脳構造画像を用いた小脳自動分割化法をそれぞれ開発している.しかし,それらの分割化法で用いられているテンプレートは,欧米人のアトラスを使用しているため,日本人の小脳分割に最適ではないと考えられる.本研究においては,小脳実質ではない部分まで含むものがほとんどであったため,マニュアルで修正を行うといった工夫が必要であった.昨今,精神疾患を対象として,国際的なビックデータを用いた研究が多く実施されている.今後,小脳を対象として,そのような研究が実施される場合,人種の違いを考慮したアトラスやテンプレートを作成し,より正確に小脳構造をとらえる工夫が求められると考える.
おわりに
現在,著者らは,小脳の思春期発達と,思春期におけるメンタルヘルスや社会行動の問題の関連を検証するために,東京ティーンコホートMRIデータ21)を使用して,縦断的解析に取り組んでいる.本解析では,そのメカニズムを検証するために,精神保健に重要な乳幼児期および思春期の心身発育・社会環境要因を含めた解析を実施している.さらに,本解析に加え,統合失調症や気分障害,発達障害などを含む,国内の数千人規模の大規模データを使用して,疾患横断的に小脳の構造・機能の特性の理解につなげる研究についても,今後実施する予定である.これらの解析のなかで,本研究結果との連続性や一貫性などについて検討し,小脳と精神疾患との関連の理解をさらに深めていく.
今回,著者らは,統合失調症の臨床病期や性別による小脳構造の差異について示したが,そのメカニズムに迫るためには,遺伝子やホルモンなどの生化学因子を含めた研究や,動物を用いたリバーストランスレーショナルリサーチなどの学際的な研究の展開が必要である.今回の研究結果は,日本小脳学会小脳システム研究セクションセミナーで講演されたが,基礎研究者からは,上記のサイトカインによる神経炎症仮説を証明するには,脳脊髄液を評価することが役に立つだろうといったことなど,今後の研究に重要な示唆を含んだ意見が複数出された.引き続き,異分野の研究者と知識や技術を共有しながら,小脳が統合失調症にかかわる病態メカニズムを追求していきたい.
最後に技術面について展望を述べる.今回の研究において,自動分割化法だけでは,十分に正確な結果が得られず,用手的な補正を要したことから,小脳分割化の難しさを痛感した.そして,今回の研究を通して,より正確な評価が実施できる小脳自動分割化法プロトコルの確立が必要だと考えた.そこで,著者らが現在実施している解析では,日本人小脳アトラスを作成し,それらを用いた解析プロトコルを用いている.この解析法は,先行研究よりも,より良い分割結果が得られることが予備解析で示されている.前述の通り,精神医学研究において,数百人から数千人規模の脳画像研究が盛んに実施されている.異質性の高い精神疾患の特性をとらえるために,多くの参加者を対象とした研究の実施は重要だが,同時に,それぞれの構造特性を正確に評価できる自動分割化法の確立も不可欠である.今後は,上記したような解析プロトコルに関する工夫の提案や,日本人小脳テンプレートの作成を行うことを通して,小脳脳画像解析の促進に貢献したい.
本論文はPCN誌に掲載された最新の研究論文19)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) Andreasen, N. C., Pierson, R.: The role of the cerebellum in schizophrenia. Biol Psychiatry, 64 (2); 81-88, 2008![]()
2) Borgwardt, S. J., Riecher-Rössler, A., Dazzan, P., et al.: Regional gray matter volume abnormalities in the at risk mental state. Biol Psychiatry, 61 (10); 1148-1156, 2007![]()
3) Bostan, A. C., Dum, R. P., Strick, P. L.: Cerebellar networks with the cerebral cortex and basal ganglia. Trends Cogn Sci, 17 (5); 241-254, 2013![]()
4) Brady, R. O. Jr., Gonsalvez, I., Lee, I., et al.: Cerebellar-prefrontal network connectivity and negative symptoms in schizophrenia. Am J Psychiatry, 176 (7); 512-520, 2019![]()
5) Bryant, N. L., Buchanan, R. W., Vladar, K., et al.: Gender differences in temporal lobe structures of patients with schizophrenia: a volumetric MRI study. Am J Psychiatry, 156 (4); 603-609, 1999![]()
6) Cotter, J., Drake, R. J., Bucci, S., et al.: What drives poor functioning in the at-risk mental state? A systematic review. Schizophr Res, 159 (2-3); 267-277, 2014![]()
7) Cropley, V. L., Lin, A., Nelson, B., et al.: Baseline grey matter volume of non-transitioned "ultra high risk" for psychosis individuals with and without attenuated psychotic symptoms at long-term follow-up. Schizophr Res, 173 (3); 152-158, 2016![]()
8) Eikelenboom, P., Bate, C., Van Gool, W. A., et al.: Neuroinflammation in Alzheimer's disease and prion disease. Glia, 40 (2); 232-239, 2002![]()
9) Genc, S., Seal, M. L., Dhollander, T., et al.: White matter alterations at pubertal onset. Neuroimage, 156; 286-292, 2017![]()
10) Hayes, L. N., Severance, E. G., Leek, J. T., et al.: Inflammatory molecular signature associated with infectious agents in psychosis. Schizophr Bull, 40 (5); 963-972, 2014![]()
11) Herculano-Houzel, S.: Coordinated scaling of cortical and cerebellar numbers of neurons. Front Neuroanat, 4; 12, 2010![]()
12) Herting, M. M., Maxwell, E. C., Irvine, C., et al.: The impact of sex, puberty, and hormones on white matter microstructure in adolescents. Cereb Cortex, 22 (9); 1979-1992, 2012![]()
13) Kay, S. R., Fiszbein, A., Opler, L. A.: The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull, 13 (2); 261-276, 1987![]()
14) Laidi, C., Hajek, T., Spaniel, F., et al.: Cerebellar parcellation in schizophrenia and bipolar disorder. Acta Psychiatr Scand, 140 (5); 468-476, 2019![]()
15) Lee, K. H., Farrow, T. F. D., Parks, R. W., et al.: Increased cerebellar vermis white-matter volume in men with schizophrenia. J Psychiatr Res, 41 (8); 645-651, 2007![]()
16) Levitt, J. J., McCarley, R. W., Nestor, P. G., et al.: Quantitative volumetric MRI study of the cerebellum and vermis in schizophrenia: clinical and cognitive correlates. Am J Psychiatry, 156 (7); 1105-1107, 1999![]()
17) Malda, A., Boonstra, N., Barf, H., et al.: Individualized prediction of transition to psychosis in 1,676 individuals at clinical high risk: development and validation of a multivariable prediction model based on individual patient data meta-analysis. Front Psychiatry, 10; 345, 2019![]()
18) Moberget, T., Doan, N. T., Alnæs, D., et al.: Cerebellar volume and cerebellocerebral structural covariance in schizophrenia: a multisite mega-analysis of 983 patients and 1349 healthy controls. Mol Psychiatry, 23 (6); 1512-1520, 2018![]()
19) Morimoto, C., Uematsu, A., Nakatani, H., et al.: Volumetric differences in gray and white matter of cerebellar Crus I/II across the different clinical stages of schizophrenia. Psychiatry Clin Neurosci, 75 (8); 256-264, 2021![]()
20) Nopoulos, P., Flaum, M., Andreasen, N. C.: Sex differences in brain morphology in schizophrenia. Am J Psychiatry, 154 (12); 1648-1654, 1997![]()
21) Okada, N., Ando, S., Sanada, M., et al.: Population-neuroscience study of the Tokyo TEEN Cohort (pn-TTC): cohort longitudinal study to explore the neurobiological substrates of adolescent psychological and behavioral development. Psychiatry Clin Neurosci, 73 (5); 231-242, 2019![]()
22) Oliver, D., Reilly, T. J., Baccaredda Boy, O., et al.: What causes the onset of psychosis in individuals at clinical high risk? A meta-analysis of risk and protective factors. Schizophr Bull, 46 (1); 110-120, 2020![]()
23) Peper, J. S., HulshoffPol, H. E., Crone, E. A., et al.: Sex steroids and brain structure in pubertal boys and girls: a mini-review of neuroimaging studies. Neuroscience, 191; 28-37, 2011![]()
24) Schmahmann, J. D., Doyon, J., McDonald, D., et al.: Three-dimensional MRI atlas of the human cerebellum in proportional stereotaxic space. Neuroimage, 10 (3 Pt 1); 233-260, 1999![]()
25) Smieskova, R., Fusar-Poli, P., Allen, P., et al.: Neuroimaging predictors of transition to psychosis: a systematic review and meta-analysis. Neurosci Biobehav Rev, 34 (8); 1207-1222, 2010![]()
26) Stoodley, C. J., Valera, E. M., Schmahmann, J. D.: An fMRI study of intra-individual functional topography in the human cerebellum. Behav Neurol, 23 (1-2); 65-79, 2010![]()
27) Szeszko, P. R., Strous, R. D., Goldman, R. S., et al.: Neuropsychological correlates of hippocampal volumes in patients experiencing a first episode of schizophrenia. Am J Psychiatry, 159 (2); 217-226, 2002![]()
28) Walterfang, M., McGuire, P. K., Yung, A. R., et al.: White matter volume changes in people who develop psychosis. Br J Psychiatry, 193 (3); 210-215, 2008![]()
29) Witthaus, H., Kaufmann, C., Bohner, G., et al.: Gray matter abnormalities in subjects at ultra-high risk for schizophrenia and first-episode schizophrenic patients compared to healthy controls. Psychiatry Res, 173 (3); 163-169, 2009![]()
30) Womer, F. Y., Tang, Y., Harms, M. P., et al.: Sexual dimorphism of the cerebellar vermis in schizophrenia. Schizophr Res, 176 (2-3); 164-170, 2016![]()
31) Yang, Z., Ye, C., Bogovic, J. A., et al.: Automated cerebellar lobule segmentation with application to cerebellar structural analysis in cerebellar disease. Neuroimage, 127; 435-444, 2016![]()