遺伝子解析研究を含む人間を対象とする精神医学研究は,2021年6月に施行された『人を対象とする生命科学・医学系研究に関する倫理指針』(以下「生命科学・医学系指針」)を遵守して実施することが求められる.新しい生命科学・医学系指針では,中央審査,一研究一計画書,電磁的手法によるインフォームド・コンセント,研究協力機関など新しい概念が導入されている.このような新しい仕組みをうまく研究に活用することができれば,適正かつ効率的な研究実施につながる可能性がある.一方,生命科学・医学系指針のもとでは,研究における最終的な責任を研究責任者が負うなど,研究者は,以前より指針遵守を厳格に求められるようになっている.人を対象とする研究においては,個人を特定可能な試料や情報を利用するため,研究対象者のプライバシーの保護や研究結果の社会へのインパクトなどに十分配慮することが要請されている.研究対象者からの同意取得のあり方,ゲノム情報など試料・情報の共有のあり方,個人情報保護管理など安全管理体制,試料・情報の商業利用についての考え方などを検討する際には,関係法令や生命科学・医学系指針などの倫理指針を参照することになるが,最終的には研究者が決定しなければならない事項が多い.本稿では,生命科学・医学系指針を概観するとともに,これまで日本精神神経学会倫理委員会での議論にて経験した事例を考察し,科学的・倫理的に質の高い精神医学研究を実施するうえでの課題を明らかにした.
はじめに
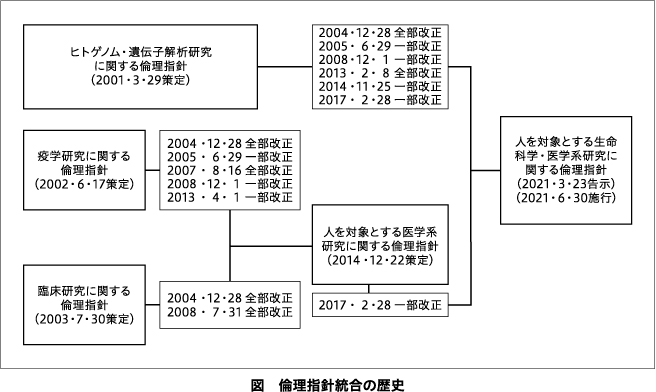
『人を対象とする生命科学・医学系研究に関する倫理指針』(以下「生命科学・医学系指針」という)が2021年3月23日告示,同年6月30日に施行された7).『人を対象とする医学系研究に関する倫理指針』と『ヒトゲノム・遺伝子解析研究に関する倫理指針』それぞれは,5年を目途に見直しをされることになっており,指針を所管する文部科学省,厚生労働省および経済産業省は,両指針の見直しに関する合同会議8)を設置し,さらなる制度改善に向けて,両指針で共通して規定されている項目の整合性について検討された結果,留意点を考慮したうえで両指針を統合することが可能とされ,生命科学・医学系指針が策定された(図).
日本精神神経学会(以下「本学会」という)の会員は,1997年に本学会が策定した『臨床研究における倫理綱領』9)を参考にしつつ,生命科学・医学系指針などの法令・指針を遵守して研究を実施しなければならない10).著者は2011年より本学会倫理委員会の外部委員として,精神医学研究の倫理的課題を取り扱ってきた.その経験を踏まえ,生命科学・医学系指針のもと,本学会の会員が精神医学研究を立案・実施するうえで特に知っておくべき事項を取り上げ,検討を行いたい.
I.日本精神神経学会倫理委員会について
本学会は,研究倫理に係る問題への対応に早期から取り組んできた.2009年には現行の委員会となる倫理委員会を設置し,同委員会は本学会が主導または関与する研究計画を審査するとともに,研究倫理に関するシンポジウムや教育・研修を年次大会にて企画し,学会員の研究倫理リテラシーの向上を図ってきた(表1).また,目まぐるしく変貌する研究への規制に対応すべく,精神医学研究の研究倫理に関しての提言やガイドラインを適宜作成している.2011年3月,東日本大震災後には,東日本大震災被災地における調査・研究に関する緊急声明文を発出2),2016年には,臨床研究における倫理綱領の補遺を公表している10).さらに同年,症例報告の重要性に鑑み,『症例報告を含む医学論文及び学会発表におけるプライバシー保護に関するガイドライン』を策定した11).
倫理委員会が審査する本学会が関与する研究は,年間数件であり,審査件数は必ずしも多くなく,無記名アンケート調査など,生命科学・医学系指針の適用のない研究も多い.一方,精神科の患者を対象とする場合には,「特段の配慮」を要する場合もあり,慎重に審議を行っている.
II.広がる生命科学・医学系指針の適用範囲
研究者が研究を立案・実施するにあたってどの法令・指針が適用されるかは重要である.生命科学・医学系指針は,人文・社会科学分野の研究でも,人を対象とするものは適用される可能性がある.例えば,医工連携でのドライブシミュレーターを使用する研究,教育発達学分野で行うMRI撮像をする研究,経済学分野で行うゲーム理論に基づく行動対応調査などは,「医学系」の定義に該当するか否かで,生命科学・医学系指針の対象となる場合とならない場合があるため,注意が必要である.なお,「すでに学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報」のみを用いる研究,例えば,商用バイオバンクから提供される試料などを使用する研究は本指針の適用はないと考えられるが,具体的に判断するにあたっては,自施設の倫理審査委員会などにあらかじめ確認しておくことが望ましい.
本学会で発表の多い個別の症例を報告する,いわゆる「症例報告」は研究には該当せず,原則として生命科学・医学系指針の適用はない.本学会では,症例報告の重要性に鑑みガイドラインを作成・公表している11).同ガイドラインは,報告対象者のプライバシー保護を図るため匿名化を行うとともに可能な限り同意の取得を求めている.また,当該症例報告が研究に該当するかどうか判断に迷う場合には所属する機関の倫理審査委員会などの意見を聴くことを推奨している.
III.レジストリ研究では研究協力機関の活用を
精神医学分野では,試料・情報を収集するレジストリ研究が行われることもある.レジストリ研究にて,試料・情報の提供をする提供機関は,必ずしも当該研究を遂行する目的や意思はなく,研究機関および研究者としての種々の責務を提供機関および提供者に課すことは結果として過剰な負担を課すことになる.診療目的で採取した既存試料・情報を他の研究機関へ提供するだけの場合は,今までも提供者は「既存試料・情報の提供のみを行う者」として匿名化の程度に応じて機関の長に届出書を提出し,機関の長が把握できるようにする,あるいは許可を得ることで,研究者としての責務を負わなくて済んだが,研究目的で新たに試料・情報を取得する場合でも侵襲が軽微な場合には,「研究協力機関」として研究組織から外れ,研究者としての責務を負わないとしうることも明確化された.研究協力機関の規定を活用する想定事例として,研究機関の近くのクリニックで診療目的で取得されたMRI画像データを提供する場合,希少疾患の患者が研究機関から遠隔地に所在するクリニックにおいて研究目的で採血を行い,研究機関に提供する場合などがある.
本学会の会員である医師のクリニックで,希少疾患を診断する目的で試料を研究機関に提供する場合や,レジストリ研究に協力する目的で画像データや診療情報を提供するだけの場合,研究協力機関や「既存試料・情報の提供のみを行う者」として提供を行えば,研究機関としての体制整備は免除される.ただし,2022年度より改正個人情報保護法が学術研究にも直接適用され「例外規定」との扱いになるため,個人情報の安全管理体制は必要となる.
ただし,研究対象者からのインフォームド・コンセントは,提供を受ける機関の「研究者」が取得する必要があり,提供機関と研究機関が遠く隔たっている場合には,後で述べる電磁的手法によるインフォームド・コンセント(e-consent)の活用が合理的である場合もある.レジストリ研究を統括する研究代表者は,「研究協力機関」および「試料・情報の提供のみを行う者」の規定を活用して,研究の活性化を図ることが望まれる.
IV.多機関共同研究を実施するにあたって―一研究一計画書および中央審査―
生命科学・医学系指針は,1つの研究計画書に基づき複数の研究機関において実施される研究を「多機関共同研究」と定義している.多機関共同研究では,研究に参加する研究機関の各研究責任者からこの研究を代表する研究代表者を選任する必要がある.多機関共同研究の研究代表者は,各共同研究機関の研究責任者の役割を明確にしたうえで1つの研究計画書を作成し,各研究者は同一の計画書に基づいて研究を実施しなければならない(一研究一計画書).医薬品などの安全性・有効性を検証する臨床試験においては通常参加機関は1つの研究計画書に基づいて研究を実施しているが,研究のあり方が多様な観察研究では,機関ごとに異なる研究計画書に基づいて実施されている場合もあり,今後は1つの研究計画書に基づいて研究を実施する必要がある.
生命科学・医学系指針では,多機関共同研究を主宰する研究代表者は,原則として1つの倫理審査委員会に対して,研究計画書について審査(中央審査)を申請しなければならない.研究代表者は,指針上は機関の長を通さず直接研究機関内外の倫理審査委員会に審査の申請を行うことになる.倫理審査委員会の承認を経た後,研究代表者および研究代表者から審査承認書の送付を受けた共同研究機関の各研究責任者は,各々の研究機関の長に対して研究の実施許可を得る.倫理審査を申請するにあたって,申請先は自機関の倫理審査委員会に限定されることはないが,倫理審査委員会の質のばらつきが指摘されているなかで,所属する機関外の倫理審査委員会に倫理審査を申請する場合には,事前に自施設のルールについて事務局などによる確認を求める機関もあるので注意が必要である.中央審査の導入により倫理審査が有料化される傾向があり,研究代表者など研究者は,審査料を研究費に計上しておく必要があるといった場合も増えている.
生命科学・医学系指針は,各参加機関の個別の倫理審査を排除しているわけではない.研究代表者は,各参加機関の研究責任者に対して自施設における倫理審査の要否を確認し,中央審査を認める機関に所属する研究責任者からは,中央審査を行う倫理審査委員会が求める場合には,審査に必要な機関要件確認書などの審査に係る資料(倫理審査委員会により相違がある)を取りまとめて審査を行う倫理審査委員会に提出する.
1つの倫理審査委員会による中央審査は,今までの医学系指針のもとでも実施できたが,手続きが煩雑であること,過大な事務負担を負うことなど課題も多かった3).生命科学・医学系指針では臨床研究法と類似する手続きを導入することにより,一定程度中央審査の事務負担などの軽減を図っている.
V.研究の登録
生命科学・医学系指針は,介入研究を実施するにあたっては必ず研究の登録を行い,観察研究も登録に「努めなければならない」(努力義務)としている.国際的な研究倫理綱領であるヘルシンキ宣言12)は,宣言の適用範囲内の研究に対して登録を求めており,この点国際基準に近づいたと評価できる.登録先は,厚生労働省の公開データベースであるjRCT(Japan Registry of Clinical Trials)5)への登録が推奨されているが,これまで使用されてきたUMIN―CTR1)でもよい.研究者が海外の公開データベースへも登録するかどうかは,任意である.
研究の登録は研究の開始までに行わなければならないことに注意が必要である.また,開始時だけではなく,研究内容の変更や終了時にも対応する必要がある.多機関共同研究では,研究代表者が一元的に登録することが可能である.
VI.電磁的手法によるインフォームド・コンセント(e-consent)
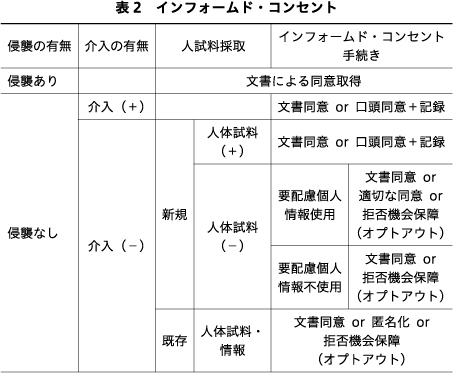
生命科学・医学系指針は,研究対象者からのインフォームド・コンセントに関する規定については,新たに規定された電磁的方法によるインフォームド・コンセント(e-consent)以外に大きい変更点はない.研究への参加に係る同意は,研究参加者へのリスク・負担の程度に応じて,「文書による同意」「適切な同意」「口頭同意+記録作成」「情報公開+拒否機会の保障(オプトアウト手続き)」を状況により使い分ける(表2).
e-consentは,研究対象者から電磁的に記録された文章等により説明し,同意を受けることを意味する.特に非対面(テレビ電話等の対面を含む)の場合,研究対象者などが確実に説明を受け,説明内容を理解したことを確認しなければ同意を受けてはならない.e-consentは,患者が来院して対面で説明する機会がある治験や臨床試験ではなく,レジストリ研究などの観察研究でより活用の余地があると考える.今後,e-consentによるオプトインの充実が試料・情報の利活用の促進に重要となると思われ,試料・情報の有償提供の是非や,営利企業への提供を想定した場合のインフォームド・コンセントのあり方が問われることに注意が必要である.
非対面のe-consentの実施においては,本人確認と双方向性の確保が重要となる.本人確認の方法は研究の内容や性質に応じて適切な強度で行わなければならない.研究対象者等が説明内容に関する質問をする機会を与え,かつ,当該質問に十分に答え,研究対象者などが同意後も規定による説明事項を含めた同意事項を容易に閲覧できるようにし,特に研究対象者などが求める場合には文書を交付することが求められる.
VII.研究により得られた結果等の説明
従来の『ヒトゲノム・遺伝子解析研究に関する倫理指針』での遺伝子解析に関する結果の開示が生命科学・医学系指針では,「研究により得られた結果等の説明」として規定された.研究全体の成果ではなく,偶発的所見など個々の研究対象者の検査などによって偶発的に得られた情報などを返却する際の方針に関するもので(返却しない場合も含む),開示する検査結果などの性質により,開示が研究対象者に資する場合には開示に積極的であるべきであるが,一方,不利益になる場合には慎重な対応が望まれる.研究者は,これから実施する研究について,(i)結果の精度や確実性,(ii)研究対象者の健康にとっての重要性,(iii)研究業務の適正な実施への支障など,研究計画の特徴に合わせて,研究者が説明方針を定めて,当該方針を研究対象者に開示することになる.
おわりに
生命科学・医学系指針は,「研究実施の基本方針」など,旧指針と比し骨子の変更はないため,研究者は,基本的には今まで通り研究を進めていけばよいと考える.生命科学・医学系指針では,研究者が研究機関の長を介さずに倫理審査を申請できるため,倫理審査の承認をもって,機関の長による実施許可を得ずに研究を開始しないよう注意が必要である.研究代表者など研究者の研究実施上の責任と業務が増大しているため,多機関共同研究では,研究の遂行をサポートする研究事務局を設置するとともに,必要に応じて所属機関の臨床研究支援部門によるサポートを受けることも重要である.レジストリ研究などでは,研究協力機関やe-consentの規定を活用して,研究を推進することが可能であり,うまく運用するためには,生命・医学系指針について,研究機関ではない医療機関や個人経営のクリニックの研究者に理解してもらうことが重要となる.
なお,個人情報保護法の改正に伴い,生命科学・医学系指針が改正され2022年度には施行予定である6).本稿執筆時の2021年11月,「人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件(概要)」に対する意見募集(パブリック・コメント)が開始された4).
学術研究に係る個人情報保護法の適用除外規定について,項目ごとの例外規定として精緻化するなど,研究を実施するうえで理解をしなければならない事項も多く,改正に係る情報をキャッチアップする必要がある.
編注:本特集は,第117回日本精神神経学会学術総会シンポジウムをもとに栗原千絵子(量子科学技術研究開発機構)を代表として企画された.
なお,本論文に関連して開示すべき利益相反はない.
謝 辞 本稿はムーンショット型研究開発事業(JPMJMS2021)および厚生労働科学研究費補助金小児がん拠点病院等及び成人診療科との連携による長期フォローアップ体制の構築のための研究(20EA1022)の助成を受けたものである.
1) 大学病院医療情報ネットワーク: 臨床試験登録システムUMIN-CTR. (https://www.umin.ac.jp/ctr/index-j.htm) (参照2021-10-20)
2) Iijima, Y., Aleksic, B., Ozaki, N.: Necessity for ethical consideration of research in the aftermath of disaster. Psychiatry Clin Neurosci, 65 (5); 535-536, 2011![]()
3) Iijima, Y., Takano, T., Murayama, T.: The status of central ethical reviewing and challenges regarding its introduction to non-interventional studies in Japan. Nagoya J Med Sci, 83 (2); 299-309, 2021![]()
4) 厚生労働省: 「人を対象とする生命科学・医学系研究に関する倫理指針の一部を改正する件(概要)」に対する意見募集について (https://public-comment.e-gov.go.jp/servlet/Public?CLASSNAME=PCMMSTDETAIL&id=495210269&Mode=0) (参照2021-11-10)
5) 厚生労働省: 臨床研究等提出・公開システム(jRCT). (https://jrct.niph.go.jp/) (参照2021-10-20)
6) 厚生労働省大臣官房厚生科学課: 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第1回)〔厚生科学審議会科学技術部会 医学研究における個人情報の取扱いの在り方に関する専門委員会(第1回)〕資料. (https://www.mhlw.go.jp/stf/newpage_18443.html) (参照2021-10-20)
7) 文部科学省, 厚生労働省, 経済産業省: 人を対象とする生命科学・医学系研究に関する倫理指針 2021 (https://www.mhlw.go.jp/content/000757566.pdf) (参照2021-10-20)
8) 文部科学省, 厚生労働省, 経済産業省: 医学研究等に係る倫理指針の見直しに関する合同会議 (https://www.mext.go.jp/b_menu/shingi/gijyutu/gijyutu1/018/index.htm) (参照2021-08-20)
9) 日本精神神経学会: 臨床研究における倫理綱領. 精神経誌, 99 (7); 525-531, 1997
10) 日本精神神経学会: 臨床研究における倫理綱領の補遺(2016年). 2016 (https://www.jspn.or.jp/modules/adovocacy/index.php?content_id=30) (参照2021-10-20)
11) 日本精神神経学会: 症例報告を含む医学論文及び学会発表におけるプライバシー保護に関するガイドライン. 2016 (https://www.jspn.or.jp/uploads/uploads/files/activity/patient_privacy_considerations_guideline20210116.pdf) (参照2021-10-20)
12) World Medical Association: Declaration of Helsinki: Ethical Principles for Medical Research Involving Human Subjects (https://www.med.or.jp/dl-med/wma/helsinki2013e.pdf) (参照2021-08-20)