統合失調症患者は便秘症になりやすく,下剤の使用頻度が高い.その主な原因は向精神薬の副作用にあると考えられている.便秘症は重症化すれば麻痺性イレウスに発展し,さらに,腸管虚血,腸管穿孔に進行すれば死に至る例もある.統合失調症患者の麻痺性イレウスに関する症例報告は多く存在するが,リスク因子研究は多くなく,十分とはいえない.そこで,本研究の目的は,統合失調症患者の麻痺性イレウスと向精神薬・下剤との関連を明らかにすることにある.2014年11月から2019年10月までの5年間に,当院に入院した統合失調症患者全例を後方視的に調査した.統合失調症患者3,775名のうち,25名が麻痺性イレウスと診断された.多変量解析では,麻痺性イレウスの発症には,clozapineの使用(OR 71.815;95%CI 12.838~401.733;P<0.001),magnesium oxideの使用(OR 3.536;95%CI 1.544~8.099;P=0.003),haloperidolの使用(OR 3.079;95%CI 1.192~7.954;P=0.020),sennosideの使用(OR 2.376;95%CI 1.048~5.388;P=0.038),年齢が高いこと(OR 1.053;95%CI 1.023~1.084;P=0.001)がそれぞれ独立に関連していた.統合失調症患者において,高齢者や,clozapine,haloperidol,下剤を使用している者は麻痺性イレウスの発症に注意が必要である.
2)東京都立松沢病院薬剤科
3)東京都立松沢病院内科
4)東京都立健康長寿医療センター認知症支援推進センター
受理日:2021年10月6日
はじめに
統合失調症患者は消化管運動が低下しやすいことが知られている.De Hert, M. らは,統合失調症患者の36.3%で便秘症が認められると報告している2).便秘症は適切な介入が行われなければ麻痺性イレウスに発展し,さらに重症化すると,腸管虚血から腸管穿孔をきたし,致死的となりうる3)7)15).そのため,消化管運動低下の予防や早期発見,治療は精神科医療において看過できない課題であるといえる.
統合失調症患者のイレウスに関する症例報告は多く存在する9)21)24)が,リスク因子研究は少ない.Nielsen, Jらの症例対照研究では,デンマークにおける全国的データベースを用いて1996年から2007年までに統合失調症に罹患した26,720名を対象に,イレウス症例123名を抽出し,高齢,女性,clozapine,高力価定型抗精神病薬,三環系抗うつ薬,抗コリン薬,オピオイドがイレウスにそれぞれ独立に関連したと報告している15).Chen, H. K. らの後ろ向きコホート研究では,台湾における大規模データベースを用い,2001年から2011年までに統合失調症と初めて診断された患者27,178名を追跡し,イレウス症例419名を抽出し,clozapine,高力価定型抗精神病薬がそれぞれ独立に関連したと報告している1).しかし,これらの研究は,保護因子である下剤が調査されていない点が限界の1つとして挙げられていた.本邦においては,菊池らの症例対照研究では,2002年から2007年までに単施設の精神科入院中に生じたイレウス症例31名を,2007年の一時点で同院に入院していた患者239名と比較し,単変量解析を行い,イレウスの既往,重度の精神症状,下剤,抗パーキンソン病薬,低体重,ヘモグロビン低値,中性脂肪低値をリスク因子として報告している12).しかし,対象が統合失調症患者に限られていない点や群間で特性が異なりうる点が限界として考えられた.そこで本研究の目的は,対象を統合失調症患者に限定して症例対照研究を実施し,麻痺性イレウスと向精神薬・下剤の関係を明らかにすることとした.
I.方法
1.対 象
2014年11月から2019年10月までの5年間に,当院に新たに入院した統合失調症患者全例を診療録から後方視的に調査し,麻痺性イレウス発症者を抽出した.統合失調症の診断は精神科医によりICD-10に基づいて行われた.麻痺性イレウスの診断は消化器内科医により臨床所見と腹部X線写真をもとに行われた.特に麻痺性イレウスの診断において,結腸癌,直腸癌が併存する症例と腹部手術歴がある症例はイレウスの機序として麻痺性イレウスではなく癒着性イレウスが想定されるため,麻痺性イレウス発症者として抽出しなかった.
2.調査項目
調査項目は,性別,年齢,身長,体重,body mass index,処方内容とした.処方内容は,定型抗精神病薬(haloperidol, chlorpromazine, levomepromazine),非定型抗精神病薬(clozapine, olanzapine, quetiapine, risperidone, aripiprazole),抗パーキンソン病薬(biperiden, promethazine, trihexyphenidyl),刺激性下剤(sennoside, picosulfate),非刺激性下剤(magnesium oxide, lubiprostone, mosapride, dai-kenchu-to, probiotics)について,処方箋から,麻痺性イレウスを発症した者(以下,麻痺性イレウス群)は,麻痺性イレウス発症直前の処方内容を抽出し,麻痺性イレウスを発症しなかった者(以下,非麻痺性イレウス群)は,chlorpromazine換算値(以下,CP換算値)が最大であったときの処方内容を抽出した.CP換算値は,稲垣らの向精神薬の等価換算表に基づいて算出した10).なお,麻痺性イレウスのリスクとされている三環系抗うつ薬,オピオイドについては統合失調症患者における処方自体がほとんどないと考えられたため,今回の調査項目から除外した.
3.統計解析
麻痺性イレウス群と非麻痺性イレウス群の比較は,カテゴリー変数はχ2検定,もしくは度数が5未満の場合はFisherの正確確率検定を行い,量的変数はt検定を行った.有意水準はP<0.05とした.多変量解析は尤度比による変数減少法を用いてロジスティック回帰分析を実施した.独立変数は,単変量解析で有意差が認められた全薬剤(haloperidol, clozapine, biperiden, sennoside, magnesium oxide, mosapride, dai-kenchu-to)の使用有無,および,年齢を採用した.統計ソフトはSPSS(version 26.0;SPSS Inc., Chicago, IL, USA)を用いた.
本研究は都立松沢病院倫理委員会の承認を受け,プライバシーに配慮して行った.
II.結果
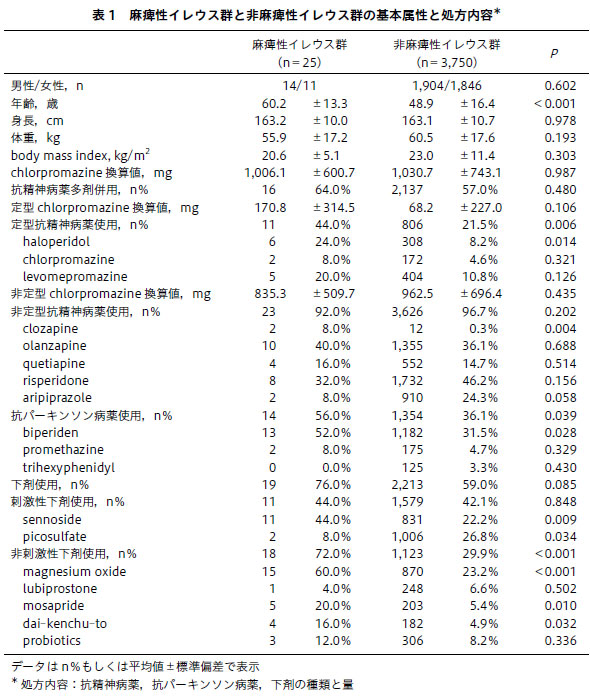
調査期間中の統合失調症患者の新入院は3,775名であり,そのうち25名が麻痺性イレウスを発症していた.表1に麻痺性イレウス群と非麻痺性イレウス群の単変量解析の結果を示した.麻痺性イレウス群は非麻痺性イレウス群に比べて,年齢が高かった(60.2±13.3歳vs 48.9±16.4歳,P<0.001).抗精神病薬に関して,麻痺性イレウス群は非麻痺性イレウス群と比較して,定型抗精神病薬全体の使用率が高く(44.0% vs 21.5%,P=0.006),なかでもhaloperidolの使用率が高かった(24.0% vs 8.2%,P=0.014).非定型抗精神病薬全体の使用率は両群において有意差が認められなかった(92.0% vs 96.7%,P=0.202)が,麻痺性イレウス群のほうがclozapineの使用率が有意に高かった(8.0% vs 0.3%,P=0.004).抗精神病薬処方量全体のCP換算値は両群で有意差が認められなかった(1,006.1±600.7 mg vs 1,030.7±743.1 mg,P=0.987).抗パーキンソン病薬の使用率は,麻痺性イレウス群のほうが高かった(56.0% vs 36.1%,P=0.039).下剤全体の使用率は,麻痺性イレウス群のほうが高い傾向が認められた(76.0% vs 59.0%,P=0.085).刺激性下剤に関しては,麻痺性イレウス群のほうがsennosideの使用率が有意に高く(44.0% vs 22.2%,P=0.009),picosulfateの使用率は有意に低かった(8.0% vs 26.8%,P=0.034).
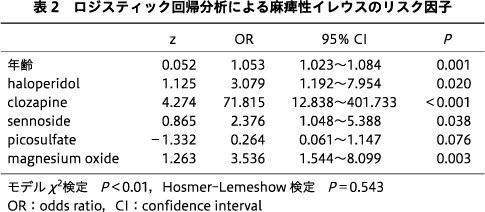
ロジスティック回帰分析を用いた多変量解析の結果は表2の通りであった.モデルχ2検定の結果はP<0.01と有意であり,麻痺性イレウスの発症には,clozapineの使用〔odds ratio(OR)71.815;95% confidence interval(CI)12.838~401.733;P<0.001)〕,magnesium oxideの使用(OR 3.536;95%CI 1.544~8.099;P=0.003),haloperidolの使用(OR 3.079;95%CI 1.192~7.954;P=0.020),sennosideの使用(OR 2.376;95%CI 1.048~5.388;P=0.038),年齢が高いこと(OR 1.053;95%CI 1.023~1.084;P=0.001)がそれぞれ独立に関連していた.Hosmer-Lemeshow検定の結果はP=0.543であり,解析結果は適合していないとはいえない結果であった.
麻痺性イレウス群25名の治療経過・転帰について,死亡したのは2名であり,死因はそれぞれ消化管出血,消化管穿孔であった.抗精神病薬の減量が試行されたのは17名であった.このうち,入院中に精神症状が悪化して抗精神病薬の増量が必要となったのは3名であった.麻痺性イレウス発症前にhaloperidolを使用していた6名中4名について,麻痺性イレウスの治療過程でhaloperidolの減量・中止が試みられたが,1名を除いて精神症状の悪化は認められなかった.麻痺性イレウス発症前にclozapineを使用していた2名について,麻痺性イレウスの治療過程でclozapineの減量・中止が試みられた結果,1名に精神症状の悪化が認められた.抗パーキンソン病薬の減量が試行されたのは8名であった.下剤に関して,刺激性下剤の連用が消化管運動低下に影響したと考えられた8名ではsennosideが減量・中止された.非刺激性下剤が追加・増量されたのは17名であった.追加される頻度が高かった非刺激性下剤はdai-kenchu-to(12名),magnesium oxide(8名),mosapride(8名),lubiprostone(5名)であった.
III.考察
1.年 齢
年齢が高いことは麻痺性イレウスの発症に独立に関連していた.一般に高齢になると消化管運動は低下しやすいことが知られている.すなわち,高齢者では水分摂取量の低下や運動量の減少,併存症の影響,内服薬の副作用,歯の喪失による嚥下困難,それによる食物繊維の多い食品の摂取困難などが消化管運動低下につながりうる6).統合失調症患者は高齢となっても抗精神病薬を必要とするので,一般の高齢者よりも消化管運動低下のリスクが高いと考えられる.高齢の統合失調症患者に対して,食生活,運動習慣,口腔衛生などにも配慮した包括的な排便管理が必要と考えられる.
2.haloperidol
Haloperidolは麻痺性イレウスの発症に独立に関連していた.これは,Nielsenらの症例対照研究やChenらの後ろ向きコホート研究の結果と一致している1)15).抗コリン作用が弱いとされるhaloperidolなどbutyrophenone系の高力価定型抗精神病薬とイレウス発症の関係について,Nielsenらは,併用された抗パーキンソン病薬が影響した可能性があると指摘しているが,Chenらは,抗パーキンソン病薬の影響を排除して解析すると,むしろhazard ratioが増加したと報告している.Haloperidolを含む高力価定型抗精神病薬が麻痺性イレウスを引き起こす機序はいまだ明らかではないため,さらなる研究が必要である.Suzuki, T. らはbutyrophenone系であるbromperidol単剤治療下で麻痺性イレウスを発症した統合失調症患者において,bromperidolを減量したところ浣腸をほとんど使用しなくなったことを報告して,消化管運動低下に対して抗精神病薬を減量する有効性を説いている24).本研究においても,麻痺性イレウス発症前にhaloperidolを使用していた患者6名のうち4名は,麻痺性イレウスの治療過程でhaloperidolの減量が試みられたが,1名を除いて精神症状の悪化は認められなかった.消化管運動低下が認められる患者にはhaloperidolの投与は慎重に判断して,減量を考慮する必要がある.
3.clozapine
Clozapineは麻痺性イレウスの発症に独立に関連していた.ORが高値になっている理由としては,clozapineは本邦では厳格に流通管理されているため,今回の対象者には処方された人数が少なかったうえに,非麻痺性イレウス群に比べて麻痺性イレウス群はclozapineの処方割合が20倍以上であったことが影響していると考えられる.Clozapineと消化管運動低下の関連は多くの文献で報告されている.Shirazi, A. らのシステマティックレヴューでは,clozapine関連の便秘症の有病率は31.2%と高いことが報告されている23).また,Ingimarsson, O. らは,clozapineによる治療中の統合失調症患者188名のうち4名(2.1%)にイレウスが発症したと報告している11).Clozapineの消化管運動低下の機序としては,clozapineが抗精神病薬のなかで最大の抗コリン作用をもつことに関連すると考えられている19).Clozapineによる消化管運動低下を実証する研究もあり,Every-Palmer, S. らは,clozapineを内服している患者は他の薬剤を内服している患者に比べて結腸通過時間が4倍であったと報告している4).さらに,Every-Palmerらは,clozapine内服下に消化管運動低下が生じた102名のうち28名が死亡の転帰となったと報告し,重症化の危険が説かれている3).Clozapine使用時は排便状況の適切なモニタリングが重要であると考えられる.
4.抗パーキンソン病薬
抗パーキンソン病薬は,その抗コリン作用により消化管運動低下を引き起こすことは周知の事実である6).しかし,今回の多変量解析では抗パーキンソン病薬は変数に選択されなかった.これは,定型抗精神病薬よりも錐体外路症状が少ないとされる,非定型抗精神病薬が広く普及したことにより,統合失調症患者における抗パーキンソン病薬の使用頻度が全体的に減少しているためと考えられる.精神科臨床薬学研究会が行った全国規模の統合失調症患者の処方実態調査では,抗パーキンソン病薬の使用頻度は2010年の58.6%から2016年には42.8%まで減少したことが示されている22).時代の流れにより抗パーキンソン病薬の使用頻度が減少していることは,統合失調症患者における消化管運動低下を予防する観点において,望ましい変化と考えられる.
5.sennoside
Sennosideは麻痺性イレウスの発症に独立に関連していた.これは麻痺性イレウス群では重症な便秘症が存在していたことを示唆する.Sennosideなどのanthraquinone系下剤は大腸のAuerbach神経叢に働いて消化管運動を刺激する17).しかし,その長期間投与はAuerbach神経叢の変性をもたらし,消化管運動低下を引き起こすという報告がある16)18)20).今回の結果はsennosideによる消化管神経叢の障害を示しているかもしれない.Sennosideの長期間投与の安全性についてさらなる調査が必要である現況では,sennosideは短期間の使用にとどめるほうが安全であると考えられる8).
6.magnesium oxide
Magnesium oxideは麻痺性イレウスの発症に独立に関連していた.これは本剤が本邦で便秘症の第一選択薬として汎用されている実情を表したものと解釈でき13),麻痺性イレウス群では慢性的な便秘症が存在していたことが示唆される.Magnesium oxideは浸透圧性下剤の一種であり,消化管への水分の移動を促進させる作用がある14).ただし,magnesium oxideの高用量投与や長期間投与,腎機能が低下している患者への投与は高マグネシウム血症になるリスクがあるため,注意が必要である25).抗精神病薬に関連した消化管運動低下に対する各種下剤の有効性や安全性を評価する研究は不十分であることが指摘されている5).今後は,さまざまな下剤における有効性や安全性を比較する研究が望まれる.
7.本研究の限界
本研究の限界としては,まず,観察研究であるため,介入研究に比べるとエビデンスレベルは限定的であることが挙げられる.また,身体活動量や食事内容など測定されていない項目が交絡因子になる可能性がある.統合失調症患者における麻痺性イレウスをより正確に調べるには,イレウスの一般的なリスク因子とされる食物繊維の摂取量,身体活動量,それに影響すると考えられる統合失調症の重症度・陰性症状の程度,抗精神病薬,抗パーキンソン病薬,下剤を含めた処方内容,処方量,処方期間といった項目を測定してコホート研究やランダム化比較試験を行うことが望まれる.
おわりに
統合失調症患者において,高齢者,clozapine,haloperidolを使用している者,下剤を使用するほどの便秘症が存在している者は,麻痺性イレウスの発症に注意が必要である.平素より,便秘症の有無に留意して,抗精神病薬の減量を可能な限り試行することが大切である.
なお,本論文に関連して開示すべき利益相反はない.
1) Chen, H. K., Hsieh, C. J.: Risk of gastrointestinal hypomotility in schizophrenia and schizoaffective disorder treated with antipsychotics: a retrospective cohort study. Schizophr Res, 195; 237-244, 2018![]()
2) De Hert, M., Dockx, L., Bernagie, C., et al.: Prevalence and severity of antipsychotic related constipation in patients with schizophrenia: a retrospective descriptive study. BMC Gastroenterol, 11 (1); 17, 2011![]()
3) Every-Palmer, S., McLean, R. M., Ellis, P. M., et al.: Life-threatening clozapine-induced gastrointestinal hypomotility: an analysis of 102 cases. J Clin Psychiatry, 69 (5); 759-768, 2008![]()
4) Every-Palmer, S., Nowitz, M., Stanley, J., et al.: Clozapine-treated patients have marked gastrointestinal hypomotility, the probable basis of life-threatening gastrointestinal complications: a cross sectional study. EBioMedicine, 5; 125-134, 2016![]()
5) Every-Palmer, S., Newton-Howes, G., Clarke, M. J.: Pharmacological treatment for antipsychotic-related constipation. Cochrane Database Syst Rev, 1 (1); CD011128, 2017![]()
6) Forootan, M., Bagheri, N., Darvishi, M.: Chronic constipation: a review of literature. Medicine (Baltimore), 97 (20); e10631, 2018![]()
7) Giordano, J., Canter, J. W., Huang, A.: Fatal paralytic ileus complicating phenothiazine therapy. South Med J, 68 (3); 351-353, 1975![]()
8) Hayat, U., Dugum, M., Garg, S.: Chronic constipation: update on management. Cleve Clin J Med, 84 (5); 397-408, 2017![]()
9) Hibbard, K. R., Propst, A., Frank, D. E., et al.: Fatalities associated with clozapine-related constipation and bowel obstruction: a literature review and two case reports. Psychosomatics, 50 (4); 416-419, 2009![]()
10) 稲垣 中, 稲田俊也, 藤井康男ほか: 向精神薬の等価換算. 星和書店, 東京, 1999
11) Ingimarsson, O., MacCabe, J. H., Sigurdsson, E.: Constipation, ileus and medication use during clozapine treatment in patients with schizophrenia in Iceland. Nord J Psychiatry, 72 (7); 497-500, 2018![]()
12) 菊池 章, 寺尾 敦: 精神科入院患者におけるイレウスのリスクファクター. 精神医学, 50 (10); 981-989, 2008
13) 厚生労働省医薬・生活衛生局: 酸化マグネシウムによる高マグネシウム血症について. 医薬品・医療機器等安全性情報, 328; 3-6, 2015 (https://www.pmda.go.jp/files/000208517.pdf) (参照2021-08-01)
14) Mori, H., Tack, J., Suzuki, H.: Magnesium oxide in constipation. Nutrients, 13 (2); 421, 2021
15) Nielsen, J., Meyer, J. M.: Risk factors for ileus in patients with schizophrenia. Schizophr Bull, 38 (3); 592-598, 2012
16) 日本消化器病学会関連研究会慢性便秘の診断・治療研究会: 慢性便秘症診療ガイドライン2017. 南江堂, 東京, 2017
17) 西尾彰泰, 植木啓文: 精神科患者における慢性便秘の治療. 精神科治療学, 23 (10); 1271-1278, 2008
18) 庭本博文, 大橋秀一, 岡本英三: 重症特発性慢性便秘における結腸壁内神経叢機能に関する細胞計測学的および薬理学的研究. 日本消化器外科学会雑誌, 26 (2); 203-213, 1993
19) Richelson, E., Souder, T.: Binding of antipsychotic drugs to human brain receptors focus on newer generation compounds. Life Sci, 68 (1); 29-39, 2000![]()
20) Riecken, E. O., Zeitz, M., Emde, C., et al.: The effect of an anthraquinone laxative on colonic nerve tissue: a controlled trial in constipated women. Z Gastroenterol, 28 (12); 660-664, 1990![]()
21) Rondla, S., Crane, S.: A case of clozapine-induced paralytic ileus. Emerg Med J, 24 (2); e12, 2007![]()
22) 精神科臨床薬学研究会: 統合失調症処方調査学会発表資料. 2020 (http://pcp-rg.org/relateddoc/index.htm#001) (参照2021-08-01)
23) Shirazi, A., Stubbs, B., Gomez, L., et al.: Prevalence and predictors of clozapine-associated constipation: a systematic review and meta-analysis. Int J Mol Sci, 17 (6); 863, 2016![]()
24) Suzuki, T., Uchida, H., Watanabe, K., et al.: Minimizing antipsychotic medication obviated the need for enema against severe constipation leading to paralytic ileus: a case report. J Clin Pharm Ther, 32 (5); 525-527, 2007![]()
25) Wakai, E., Ikemura, K., Sugimoto, H., et al.: Risk factors for the development of hypermagnesemia in patients prescribed magnesium oxide: a retrospective cohort study. J Pharm Health Care Sci, 5; 4, 2019![]()