遺伝学的研究や疫学的研究から,統合失調症の背景病態の1つに自己免疫が疑われているが,その詳細は不明である.われわれは,日本人の統合失調症患者(n=223)と健常者(n=201)をスクリーニングし,統合失調症患者12名(223名中5.4%)からneural cell adhesion molecule 1(NCAM1)に対する自己抗体を発見した.統合失調症患者から精製した抗NCAM1自己抗体は,NCAM1-NCAM1およびNCAM1-GDNFの結合を阻害する.さらに,抗NCAM1自己抗体はマウスの髄液中に投与すると,NCAM1とFynの結合を阻害し,FAK,MEK1,ERK1のリン酸化を抑制し,前頭葉のスパインとシナプスの数を減少させる.さらに,抗NCAM1自己抗体は,マウスのプレパルス抑制の障害や認知機能障害など,統合失調症に関連した行動を誘発する.まとめると,統合失調症患者の抗NCAM1自己抗体は,マウスにおいて統合失調症関連行動とシナプスの変化を引き起こす.本研究により統合失調症の一部に存在する抗NCAM1自己抗体は除去すべき病態形成因子である可能性があり,これらの自己抗体は治療標的となる可能性がある.また,異種性の症候群である統合失調症において,そのような治療が可能なサブグループを区別するバイオマーカーとして役立つ可能性がある.
https://doi.org/10.57369/pnj.25-042
受付日:2024年4月10日
受理日:2024年12月2日
はじめに
統合失調症は症状的にも遺伝的にも異種性の症候群であり,その背景にはさまざまな病態やサブグループが存在すると推測されている.そのサブグループを明らかにする臨床的に有用なバイオマーカーを開発し,治療抵抗性の患者の病態を明らかにすることが必要である.
統合失調症の遺伝子解析から,シナプス関連遺伝子の異常とならんで,免疫関連遺伝子の異常も統合失調症のリスクになることが報告されている.特に,ヒトの主要組織適合性複合体(human leukocyte antigen:HLA)領域の変異との関連は繰り返し報告されてきた11).また,統合失調症と自己免疫の間には疫学的な関係も指摘されている6).しかし,より詳細な統合失調症と自己免疫の関係は不明である.
自己抗体は自己免疫の主要な構成要素である.シナプス膜分子に対する自己抗体が自己免疫性脳炎で見つかっている7)19).自己免疫性脳炎のなかには精神病症状を引き起こすものもある.最も広く研究されている脳炎の1つに,抗NMDA受容体抗体脳炎があり,統合失調症に類似した症状を呈することが報告されている17).また,抗GABAARα1抗体脳炎も精神病症状を引き起こす15).これらの自己抗体は統合失調症患者でも報告されているが,実際に統合失調症の症状に関与しているかは不明である14)20).
これらを背景に,われわれは,脳炎でも未報告のシナプス自己抗体の探索を統合失調症で行うことにした.統合失調症の病態に関連する自己抗体を探索する場合,いくつかの前提条件がある.すなわち,標的抗原が神経系に発現する膜分子であることや(自己抗体は通常,生体内では細胞に侵入しない),また抗原が,統合失調症,あるいは少なくとも神経・シナプス機能に関与する分子であることである.これらの条件のもとに,われわれはcell-based assayを用いて,統合失調症の病態生理に関与すると考えられる新規自己抗体を探索した.候補抗原の1つはシナプス接着分子の1つであるneural cell adhesion molecule 1(NCAM1)であり,トランスホモフィリック結合(プレシナプスとポストシナプスの両方に存在するNCAM1が向かい合ってお互いに結合する)によってシナプス結合を強固にする分子である26).またNCAM1は,グリア細胞株由来神経栄養因子(glial cell line derived neurotrophic factor:GDNF)とも結合し,シナプス形成に寄与する26).統合失調症に関連したNCAM1の研究は先行研究があり,NCAM1ノックアウトマウスやNCAM1のドミナントネガティブ型を導入したトランスジェニックマウスは,統合失調症に関連した行動変化を示す1)5)16)28).さらに,NCAM1の一塩基多型(single nucleotide polymorphism:SNP)は統合失調症と関連している2)25)29).しかし,脳炎患者も含め抗NCAM1自己抗体は報告がなかった.
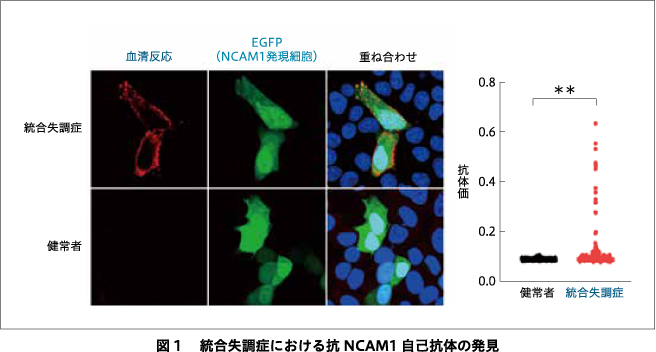
I.統合失調症における抗NCAM1自己抗体の発見
われわれは,健常者201名と統合失調症患者223名の血清を用いて,cell-based assayでNCAM1に対する自己抗体のスクリーニングを行った.その結果,12名の統合失調症患者(5.4%)が抗NCAM1自己抗体陽性であった(図1)21).抗NCAM1自己抗体陽性の統合失調症患者では,脳脊髄液(cerebrospinal fluid:CSF)中にも抗NCAM1自己抗体が存在したが,これらの患者の髄液の蛋白濃度および白血球数は正常であった.NLGN1,NLGN2,NLGN3,NLGN4,NRXN1,NRXN3,ephrin B1~B3,ERBB4,NRG1,NR1,NR2,GABAARα1に対する自己抗体も調べたが抗NCAM1自己抗体陽性の患者は,これらに対する自己抗体は陰性だった.これらの患者では,他の患者と比較して,せん妄や脳炎を含む明瞭な精神・神経症状はみられなかった.さらに,がんや自己免疫疾患などの共通の病歴はなかった.これらの患者では幻覚や妄想を含む精神症状は,2剤以上の抗精神病薬の使用にもかかわらず残存しており,治療抵抗性であった.2名の健常者も抗NCAM1自己抗体は陽性であったが,抗体価は有意に低かった.
II.抗NCAM1自己抗体による病態
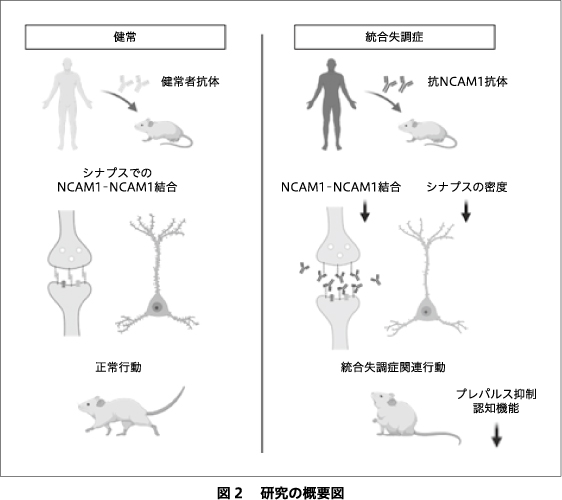
われわれは抗NCAM1自己抗体のエピトープを探索するために複数のdeletion実験を行った.その結果,NCAM1の最もN末に存在するIg1ドメインにエピトープが存在することを明らかにした.また,ヒトNCAM1同士の結合をin vitroで検証するpull down assayによって,抗NCAM1自己抗体はNCAM1同士のホモ結合を阻害し,さらにNCAM1とGDNFの結合も阻害することを明らかにした.もし,統合失調症患者に見られる抗NCAM1自己抗体がNCAM1-NCAM1およびNCAM1-GDNF結合を阻害するのであれば,これらの自己抗体を投与したマウスにおいて,分子シグナルの異常,スパインやシナプスの形成異常,統合失調症に関連した行動を引き起こすと考えられた.これを検証するために,統合失調症患者と年齢・性別をマッチさせた健常者からIgGを精製し,マウス(8週齢)の髄腔内に注入し,その1週間後に分子シグナル伝達,スパインとシナプスの形成,行動を解析した.
NCAM1-NCAM1結合とNCAM1-GDNF結合は,NCAM1の細胞質ドメインとFynの接触を誘導する.この相互作用はFynを活性化し,FynはFAKをリン酸化する.そこで,抗NCAM1自己抗体陽性患者から精製したIgGをマウスに投与することで,これらのシグナル伝達(NCAM1とFynの結合,FAK,MEK1,ERK1のリン酸化)が阻害されるかどうかを調べた.免疫沈降法による解析で,NCAM1と共沈したFynの量を解析したところ,抗NCAM1自己抗体の存在により,NCAM1とFynの結合が減少していることが明らかになった.さらに,抗NCAM1自己抗体陽性患者から精製したIgGはFAK,MEK1,ERK1のリン酸化を阻害した.これらの結果は,抗NCAM1自己抗体によるNCAM1-NCAM1およびNCAM1-GDNF結合の阻害が,NCAM1-Fynの相互作用を障害し,FAK,MEK1およびERK1のリン酸化を低下させることを示している.
これらの結果から,抗NCAM1自己抗体がスパインとシナプスに変化を引き起こすことが推定された.このことを確かめるために,患者IgGを髄腔内に投与したマウスの2光子顕微鏡による解析を行った.その結果,抗NCAM1自己抗体陽性患者から精製したIgGを投与したマウスは,前頭皮質においてスパインとシナプスの減少を示した.
最後に,抗NCAM1自己抗体が統合失調症に関連する行動変化を引き起こすかどうかを,自己抗体を投与したマウスを用いて解析した.抗NCAM1自己抗体陽性患者から精製したIgGを投与すると,Y迷路試験における認知機能が低下した.さらに,抗NCAM1自己抗体陽性患者のIgGを投与したマウスは,統合失調症の中間表現型として確立しているプレパルス抑制の障害がみられた.一方で,オープンフィールド試験,高架式十字迷路試験,3 chamber試験において,それぞれ運動活性,不安行動,社会的相互作用に異常を示さなかった.
これらの結果は,抗NCAM1自己抗体陽性患者から精製したIgGからNCAM1リコンビナント蛋白によって抗NCAM1自己抗体を除去したIgGでは引き起こされず,確かに抗NCAM1自己抗体がこれらの異常を引き起こしていることが確認された21).
III.抗NCAM1自己抗体病態に関連した論点
われわれは,抗NCAM1自己抗体はNCAM1の分子間結合に介入することで病態を発揮する可能性を指摘したが,それ以外の病態も存在し得ると考えている.例えば,NCAM1に対する自己抗体の存在は,たとえ自己抗体がミクログリアの炎症反応を引き起こさない程度の量であったとしても,ミクログリアによる過剰なシナプス刈り込みを引き起こす可能性がある.このようなシナプス刈り込みは,発達過程においても報告されている13)24).正常な発達過程では,シナプス刈り込みは通常青年期で停止するが,統合失調症では青年期以降にもシナプス刈り込みが過剰に進行するという仮説がある9).NCAM1を含むシナプス分子に対する自己抗体は,このような進行性のシナプス刈り込みに関与している可能性がある.これらのテーマは,抗NCAM1自己抗体のようなシナプス自己抗体が,抗原分子の機能障害以上の影響を及ぼすという仮説として,今後検証されるであろう.
さらに,抗NCAM1自己抗体は他の分子と交差反応するかもしれない.このような交差反応性は,抗NMDA受容体自己抗体や抗GABAAα1自己抗体などの他の自己抗体で観察される.このような他の交差反応性抗原を同定することで,抗NCAM1自己抗体のより広範な病態を説明できるかもしれない.交差反応性抗原や他の自己抗体を同定することで,抗NCAM1自己抗体陽性の患者における,自己抗体病態の全体像が明らかになると思われる.
また,一部の統合失調症患者において,なぜ,どのようにして抗NCAM1自己抗体が産生されるのかも今後の研究課題である.本研究で検討した抗NCAM1自己抗体陽性患者には,癌や自己免疫疾患などの共通の病歴はなかった.HLA遺伝子領域の解析や,より詳細な感染症既往歴の解析は,抗NCAM1自己抗体産生の機序を明らかにするためのアプローチかもしれない.
さらに,抗NCAM1自己抗体がいつから存在するかも重要な論点である.病前から存在するかどうかは発症に関与するかどうかにつながる.あるいは,発症後に存在するとしても,それは症状の進行を修飾する因子になるかもしれない.病前に存在するかどうかは健常者とされる思春期などの若年のコホートで抗NCAM1自己抗体が存在するか,さらに抗NCAM1自己抗体陽性者がその後どのような経過をたどるかの研究によって確かめられるかもしれない.この点は早期介入の観点からも重要である.
また,血液脳関門を自己抗体が通過するかどうかも重要な点である.近年の抗体製剤の研究から末梢に存在するIgGの約0.1%は脳に到達するとされ,実際に治療薬として開発されている27).中枢神経系に侵入したIgGは抗原が存在しない場合24時間以内に除去されるが12),中枢に抗原が存在した場合は濃度が上昇していくことも報告されている3).さらに血液脳関門の透過性は年齢・炎症・遺伝的背景・ストレスなどに影響されるため,状況によっては上記よりもさらに中枢神経系に自己抗体が侵入する可能性はある8).
抗NCAM1自己抗体陽性の患者に特徴的な精神症状があるかは,抗NCAM1自己抗体検査を行うかどうかの判断において重要である.従来の概念では,自己抗体陽性の患者として急性精神病を呈したり,カタトニアを呈したりする症例が予測されるが,われわれが抗NCAM1自己抗体陽性として発見した患者は比較的典型的な統合失調症の経過をたどる患者,すなわち,比較的緩徐に発症し慢性的な経過をたどる患者であった.逆にいえば,特徴的な症状がなかったとしても抗NCAM1自己抗体は陽性になることがあるととらえてよいかもしれない.一方で,まだ抗NCAM1自己抗体陽性とされた患者数は多くはないため,さらなる症例の検討によって,抗NCAM1自己抗体陽性の患者により特徴的な症状が発見されるかもしれない.また,一部の抗NCAM1自己抗体の抗体価が著しく高かった統合失調症症例では脳波の軽度徐派化(7 Hz程度)がみられたことは今後の解析で重要かもしれない.すなわち,統合失調症において脳波が軽度徐派化する例では,抗NCAM1自己抗体に限らず未知の自己抗体が陽性であることを示唆するかもしれない.
IV.統合失調症におけるその他の自己抗体の発見について
抗NCAM1自己抗体の発見以降,われわれはさらに新しいシナプス自己抗体の探索を前述のcell-based assayで行った.その結果,われわれはneurexin 1(NRXN1)に対する自己抗体も統合失調症患者〔387名中8名(2.1%)〕の血清および髄液中から発見した22).健常者362名には陽性者はいなかった.NRXN1はプレシナプスに存在するシナプス接着分子で,neuroliginsを含むさまざまなポストシナプスの分子と結合するシナプス結合の「ハブ」になっている分子である.NRXN1のみを遺伝子として含む2p16.3領域のdeletion syndromeの統合失調症のodds比は14.4で,NRXN1の遺伝子変異そのもののodds比も5.02であることから,NRXN1遺伝子変異と統合失調症の関連が指摘されてきた10)23).またNRXN1遺伝子は自閉スペクトラム症や知的障害とも関連が指摘されている遺伝子でもある.抗NRXN1自己抗体はNRXN1のLNS6ドメインを含むポリクローナルな自己抗体で,LNS6ドメインはNRXN1のスプライシングバリアントであるNRXN1α・NRXN1βに共通して含まれるドメインである.このドメインはNLGN1,2などとの結合に必要で,実際,抗NRXN1自己抗体はNRXN1とNLGN1,2との結合を阻害することが確かめられた.さらに,抗NCAM1自己抗体と同様に,抗NRXN1自己抗体陽性の患者からIgGを精製し,マウスの髄液中に投与したところ,電気生理学的変化や,シナプス・スパインの減少,認知機能低下やプレパルス抑制の障害,社交性の障害など,統合失調症に関連した行動異常がみられた.また,この精製したIgGから抗NRXN1自己抗体を除去したものは,上記の表現型は消失し,確かに抗NRXN1自己抗体が原因になっていることが確かめられた.抗NCAM1自己抗体陽性患者と抗NRXN1自己抗体陽性患者の間には重複はなく,その合計は7.5%となることから,統合失調症における自己抗体病態の有病率が比較的高いことが示唆された.また,同様のアプローチを続けることで,未知の自己抗体がさらに発見される可能性が考えられる.
V.統合失調症の自己抗体病態に対する治療戦略
統合失調症における現在の薬物治療の中心はD2受容体の阻害ないしはその調整によるものであるが,自己抗体が陽性の患者においてはどのようにアプローチするべきであろうか.脳炎に関連しうる自己抗体が陽性で,意識障害や脳波異常を伴うのであれば,より自己免疫介在性脳炎・脳症に準じた免疫学的な加療,すなわちステロイドの投与や,血漿交換,場合によってはリツキシマブのようなB細胞をターゲットにしたIgGの除去も候補になる.一方で,精神科医が日常診療で遭遇する自己抗体陽性の急性精神病に対して抗精神病薬は奏効するであろうか.例えばPollak, T. A.らはOPTiMiSE(Optimization of Treatment and Management of Schizophrenia in Europe)研究で,急性精神病において血清で抗NMDA受容体抗体が陽性であっても陰性であっても,amisulprideの奏効に差はなかったと報告している18).そのため,抗精神病薬をまずは試す価値があるという意味で,自己抗体が陽性であることだけでは,免疫学的治療介入をするのに十分な動機づけにならないと結論付けており,脳波や画像検査,髄液検査でも異常がみられるかどうかを十分に検証することが,免疫学的治療を行うかどうかにおいて重要だと述べている19).これは,実際の臨床感覚としても,まずは標準的な抗精神病薬での加療をしつつ,器質的背景を精査し,改善が不十分である場合や,器質的な背景が見つかった場合に,それらに対するアプローチを行うのと矛盾しておらず,合理的であると考えられる.では,いわゆる急性精神病状態ではない,比較的典型的な経過(治療も含めて)の統合失調症において,神経系の自己抗体が陽性になった場合はどうであろうか.われわれも,抗GABAA受容体抗体や抗NCAM1自己抗体が強陽性で脳波の徐波化を伴う慢性期の統合失調症患者を報告してきた20)21).これらの患者は,標準的な抗精神病薬加療では十分に陽性症状も改善せず,認知機能低下や陰性症状の進行もみられた.一方で,軽度の脳波の徐波化(7 Hz程度)だけで,髄液所見や画像所見も異常がみられなければ,一般的には脳炎や脳症の診断をするのは困難で,いわんや,ステロイドや血漿交換を試すような状況ではないのが一般的である.ステロイドはそもそもドパミン病態を刺激して病態を複雑化させかねず,血漿交換は自己抗体を減少させたとしても,1ヵ月程度で元に戻るため,長期的な加療として必ずしも適切ではない.この観点では,将来的には上述のリツキシマブは治療候補としては比較的可能性があるものである.1,2回の末梢投与により長期的な治療効果が得られ,神経疾患への適応も拡大されてきている.リツキシマブを自己抗体の有無を検証せずに統合失調症に投与した研究が最近報告されており,有効性が報告されている4).これは,統合失調症の患者のなかに比較的高い割合で自己抗体陽性の患者が存在することを示唆するかもしれないのとともに,自己抗体陽性の患者に限定してリツキシマブを投与すればさらに奏効する結果が得られるかもしれない.これは,比較的発症間もない若年者においても自己抗体が陽性になる場合や,現在の薬物治療に難治な患者の存在を考えると,検証していくべき研究テーマである.
おわりに
まとめると,われわれは統合失調症患者の一部から抗NCAM1自己抗体を発見した21).この自己抗体は,マウスにおいて統合失調症に関連した行動やシナプスの変化を引き起こした(図2).統合失調症におけるこの自己抗体の病態意義を確認するためには,さらなる臨床研究が必要である.本研究は東京科学大学の動物実験審査委員会,遺伝子組換え実験審査委員会,医学部倫理審査委員会で承認されている.
なお,本論文に関連して開示すべき利益相反はない.
1) Albrecht, A., Stork, O.: Are NCAM deficient mice an animal model for schizophrenia? Front Behav Neurosci, 6; 43, 2012![]()
2) Ayalew, M., Le-Niculescu, H., Levey, D. F., et al.: Convergent functional genomics of schizophrenia: from comprehensive understanding to genetic risk prediction. Mol Psychiatry, 17 (9); 887-905, 2012![]()
3) Bard, F., Fox, M., Friedrich, S., et al.: Sustained levels of antibodies against Aβ in amyloid-rich regions of the CNS following intravenous dosing in human APP transgenic mice. Exp Neurol, 238 (1); 38-43, 2012![]()
4) Bejerot, S., Sigra Stein, S., Welin, E., et al.: Rituximab as an adjunctive treatment for schizophrenia spectrum disorder or obsessive-compulsive disorder: two open-label pilot studies on treatment-resistant patients. J Psychiatr Res, 158; 319-329, 2023![]()
5) Brennaman, L. H., Kochlamazashvili, G., Stoenica, L., et al.: Transgenic mice overexpressing the extracellular domain of NCAM are impaired in working memory and cortical plasticity. Neurobiol Dis, 43 (2); 372-378, 2011![]()
6) Cullen, A. E., Holmes, S., Pollak, T. A., et al.: Associations between non-neurological autoimmune disorders and psychosis: a meta-analysis. Biol Psychiatry, 85 (1); 35-48, 2019![]()
7) Dalmau, J.: NMDA receptor encephalitis and other antibody-mediated disorders of the synapse: the 2016 Cotzias Lecture. Neurology, 87 (23); 2471-2482, 2016![]()
8) Diamond, B., Huerta, P. T., Mina-Osorio, P., et al.: Losing your nerves? Maybe it's the antibodies. Nat Rev Immunol, 9 (6); 449-456, 2009![]()
9) Forsyth, J. K., Lewis, D. A.: Mapping the consequences of impaired synaptic plasticity in schizophrenia through development: an integrative model for diverse clinical features. Trends Cogn Sci, 21 (10); 760-778, 2017![]()
10) Marshall, C. R., Howrigan, D. P., Merico, D., et al.: Contribution of copy number variants to schizophrenia from a genome-wide study of 41,321 subjects. Nat Genet, 49 (1); 27-35, 2017![]()
11) Network and Pathway Analysis Subgroup of the Psychiatric Genomics Consortium: Psychiatric genome-wide association study analyses implicate neuronal, immune and histone pathways. Nat Neurosci, 18 (2); 199-209, 2015![]()
12) Noguchi, Y., Kato, M., Ozeki, K., et al.: Pharmacokinetics of an intracerebroventricularly administered antibody in rats. MAbs, 9 (7); 1210-1215, 2017![]()
13) Paolicelli, R. C., Bolasco, G., Pagani, F., et al.: Synaptic pruning by microglia is necessary for normal brain development. Science, 333 (6048); 1456-1458, 2011![]()
14) Pape, K., Tamouza, R., Leboyer, M., et al.: Immunoneuropsychiatry - novel perspectives on brain disorders. Nat Rev Neurol, 15 (6); 317-328, 2019![]()
15) Pettingill, P., Kramer, H. B., Coebergh, J. A., et al.: Antibodies to GABAA receptor α1 and γ2 subunits: clinical and serologic characterization. Neurology, 84 (12); 1233-1241, 2015![]()
16) Pillai-Nair, N., Panicker, A. K., Rodriguiz, R. M., et al.: Neural cell adhesion molecule-secreting transgenic mice display abnormalities in GABAergic interneurons and alterations in behavior. J Neurosci, 25 (18); 4659-4671, 2005![]()
17) Pollak, T. A., Lennox, B. R., Müller, S., et al.: Autoimmune psychosis: an international consensus on an approach to the diagnosis and management of psychosis of suspected autoimmune origin. Lancet Psychiatry, 7 (1); 93-108, 2020![]()
18) Pollak, T. A., Vincent, A., Iyegbe, C., et al.: Relationship between serum NMDA receptor antibodies and response to antipsychotic treatment in first-episode psychosis. Biol Psychiatry, 90 (1); 9-15, 2021![]()
19) Prüss, H.: Autoantibodies in neurological disease. Nat Rev Immunol, 21 (12); 798-813, 2021![]()
20) Shiwaku, H., Nakano, Y., Kato, M., et al.: Detection of autoantibodies against GABAARα1 in patients with schizophrenia. Schizophr Res, 216; 543-546, 2020
21) Shiwaku, H., Katayama, S., Kondo, K., et al.: Autoantibodies against NCAM1 from patients with schizophrenia cause schizophrenia-related behavior and changes in synapses in mice. Cell Rep Med, 3 (4); 100597, 2022![]()
22) Shiwaku, H., Katayama, S., Gao, M., et al.: Analyzing schizophrenia-related phenotypes in mice caused by autoantibodies against NRXN1α in schizophrenia. Brain Behav Immun, 111; 32-45, 2023![]()
23) Singh, T., Poterba, T., Curtis, D., et al.: Rare coding variants in ten genes confer substantial risk for schizophrenia. Nature, 604 (7906); 509-516, 2022![]()
24) Stevens, B., Allen, N. J., Vazquez, L. E., et al.: The classical complement cascade mediates CNS synapse elimination. Cell, 131 (6); 1164-1178, 2007![]()
25) Sullivan, P. F., Keefe, R. S. E., Lange, L. A., et al.: NCAM1 and neurocognition in schizophrenia. Biol Psychiatry, 61 (7); 902-910, 2007![]()
26) Sytnyk, V., Leshchyns'ka, I., Schachner, M.: Neural cell adhesion molecules of the immunoglobulin superfamily regulate synapse formation, maintenance, and function. Trends Neurosci, 40 (5); 295-308, 2017![]()
27) Wang, Q., Delva, L., Weinreb, P. H., et al.: Monoclonal antibody exposure in rat and cynomolgus monkey cerebrospinal fluid following systemic administration. Fluids Barriers CNS, 15 (1); 10, 2018![]()
28) Wood, G. K., Tomasiewicz, H., Rutishauser, U., et al.: NCAM-180 knockout mice display increased lateral ventricle size and reduced prepulse inhibition of startle. Neuroreport, 9 (3); 461-466, 1998![]()
29) Zhang, W., Xiao, M. S., Ji, S., et al.: Promoter variant rs2301228 on the neural cell adhesion molecule 1 gene confers risk of schizophrenia in Han Chinese. Schizophr Res, 160 (1-3); 88-96, 2014![]()