向精神薬により便秘症の発症リスクが上昇する可能性が指摘されているが,向精神薬内服中の患者の便秘症に関する質の高い研究は不足している.今回われわれは,昭和大学横浜市北部病院の精神科救急病棟に入院した患者1,696例の診療録より,最終処方における緩下剤使用率を集計した.これらの患者を緩下剤あり群と緩下剤なし群に分け,患者背景,薬物療法の違いについて統計学的検討を行った.薬剤の投与量の指標として,各薬剤の添付文書上の上限を1とした場合の投与量の比を臨床用量比と命名し,使用した.多変量ロジスティック回帰分析の結果から,高齢,女性,入院回数が多いこと,在棟日数が長くなること,薬剤のカテゴリーでは抗パーキンソン薬,従来型抗うつ薬,新規抗うつ薬,気分安定薬,ベンゾジアゼピン系睡眠薬の投与量が緩下剤使用と関連している可能性が示された.薬剤別には,クエチアピン,レボメプロマジン,ベンラファキシン,ミルタザピンの投与量が緩下剤使用と関連している可能性が示された.
2)昭和大学医学部精神医学講座
3)医療法人高仁会戸田病院
4)昭和大学附属藤が丘病院精神神経科
5)昭和大学附属烏山病院
https://doi.org/10.57369/pnj.23-121
受理日:2023年5月18日
はじめに
便秘症は全世界で高頻度にみられる機能性腸障害である.2016(平成28)年厚生労働省の国民生活基礎調査によると,わが国の便秘の有訴者率は男性2.5%,女性4.6%と男性よりも女性に多く,若年~中年層では圧倒的に女性比率が高いが,男女とも60歳代以降で増加し,70歳以降の高齢になると特に男性の比率が急増し,性差がなくなる傾向にある19).Suares, N. C.らによると,米国においては慢性特発性便秘症の有病率は約14%であり,女性,高齢者,社会的地位が低いほど高率であった35).Oh, S. J.らは,便秘の経験者を対象にした人口ベースの大規模コホート研究を行い,対象者4,702例のうち1,128例(24.0%)が慢性特発性便秘症の基準を満たしたこと,2,246例(47.8%)が便秘の治療薬を使用していたこと,精神疾患を有することは便秘症のケアを必要とする確率を上昇させること(OR:1.25,95% CI:1.09~1.44)などを報告している27).
便秘症は普遍的にみられる疾患であるが,30,000人/年以上の機能性胃腸障害を追跡した大規模なコホート研究において,慢性便秘の症状をもつ対象者は生存率が低下するリスクがあることや2),便秘症あるいは下剤を使用している状態は全死亡,慢性腎不全および虚血性脳卒中の発症リスクの高さに独立して関連していることも示されており36),便秘症は生命予後に影響する疾患であるという認識が必要である.
日本消化器病学会関連研究会慢性便秘の診断・治療研究会編による『慢性便秘症診療ガイドライン2017』では,抗コリン作用をもつ薬剤の消化管運動の緊張や蠕動運動,腸液分泌の抑制作用により,向精神薬は慢性便秘症を生じるリスクが高く,抗うつ薬,一部の抗精神病薬,抗パーキンソン薬(抗パ薬),ベンゾジアゼピン(benzodiazepine:BZD)受容体作動薬,第1世代の抗ヒスタミン薬により慢性便秘症を生じる可能性が高くなることが指摘されている26).また抗精神病薬による便秘のメカニズムとして,下行性疼痛抑制経路が排便反射を制御している可能性があり,ドパミン受容体遮断作用が仙髄副交感神経の節前神経の興奮を抑制することにより,下行性疼痛抑制系を介したドパミンによる結腸,直腸の運動を低下させ,便秘を引き起こす可能性があることも示唆されている23).さらにヒスタミンはH1受容体を介して腸管平滑筋を収縮させるため43),抗ヒスタミン作用により腸管の収縮が抑制される可能性がある.
精神疾患の治療においては,抗コリン作用,ドパミン受容体遮断作用,抗ヒスタミン作用をもつ種々の向精神薬が処方され,時に複数のカテゴリーの向精神薬が処方されたり,抗精神病薬による錐体外路症状の治療や予防のために,抗コリン作用の強い抗パ薬が併用されたりする場合があり,このような状況にある精神科の患者の便秘症発症リスクは高いと推測される.しかし実臨床において実感する精神科患者の便秘の頻度に比し,便秘症のリスクに関して検討した質の高い研究は多くなく6),精神疾患の治療に関連した国内外のガイドラインにおいても,向精神薬の副作用である便秘についてふれているものはわずかである10)25).
わが国では佐藤らが,3施設の精神科外来に通院中の患者1,384例に対してアンケート調査を行い,Rome IVによる便秘症の基準を満たすもの20),および緩下剤を内服しているものを便秘症と定義した結果,41.8%の患者が同研究における便秘症の定義を満たしたこと,処方された薬剤のカテゴリーを説明変数として用いた多変量解析の結果,便秘症に関連していた因子は,年齢が上がること,女性であること,BMIが低いこと,ストレスがあること,抗パ薬,従来型抗うつ薬,気分安定薬を内服していることであったことを報告した31).
このような背景から,著者らは精神科入院患者における便秘症出現リスクに関連する因子を同定するため,精神科救急病棟の入院患者を対象に緩下剤使用に関する調査を行った.緩下剤使用を主要評価項目とした理由は,入院中は身体症状や副作用に対する対策がおおむね行われていると想定され,便秘症が放置されることは考えにくく,緩下剤使用が便秘症リスクの指標になると考えたからである.
なお本稿は,第118回日本精神神経学会学術総会において発表したものに解析を追加し,論文化したものである.
I.当院の背景と研究方法
昭和大学横浜市北部病院(以下,当院)は神奈川県横浜市の北部に位置し,病床数は689床の総合病院である.精神科の病床として,42床の精神科救急入院料算定病棟(スーパー救急病棟)と50床の高齢者治療病棟を有し,神奈川県精神科救急基幹病院としての役割を担っている.スーパー救急病棟の運用基準に基づき,原則的に60%以上の患者が3ヵ月以内に自宅退院することをめざした治療が行われる.入院が長期化することが確実になった場合,転棟して治療を継続するための病棟を有していないため,他院に転院してその後の治療が行われることが多い.また神奈川県の精神科救急システムにより,措置入院および行政の要請に基づいた医療保護入院患者は,原則的に急性期治療が終了した後に後方病院に転院する.したがって,長期入院患者はほとんどいないという特徴がある.
今回著者らは,2014年1月1日から2021年12月31日に,当院のスーパー救急病棟に入院した全患者の診療録を調査し,年齢,性別,ICD-10による診断(F0症状性を含む器質性精神障害,F1精神作用物質使用による精神および行動の障害,F2統合失調症,統合失調型障害および妄想性障害,F3気分[感情]障害,F4神経症性障害,ストレス関連障害および身体表現性障害,F5生理的障害および身体的要因に関連した行動症候群,F6成人のパーソナリティおよび行動の障害,F7知的障害[精神遅滞],F8心理的発達の障害,F9小児期および青年期に通常発症する行動および情緒の障害 特定不能の精神障害,G4挿間性および発作性障害),臨床診断,罹病期間(診療録からの推定),治療期間(初回治療時からの年数),『精神保健福祉法』における入院時形態,在棟期間,入院回数,入院中の隔離の有無,拘束の有無,電気けいれん療法(electroconvulsive therapy:ECT)使用の有無,ハロペリドール(haloperidol:HPD)点滴使用の有無,緩下剤を含めた入院時の初回処方内容,最終処方内容,それぞれの投与量を集計し,データベースを作成した.本研究における対象期間において,複数回入院している患者が217例おり,計600回入院していたが,本研究では複数回の入院エピソードのある患者も入院ごとに1例として計算した.
薬剤の投与量と緩下剤使用リスクの関連を検討するにあたり,クロルプロマジン換算値,イミプラミン換算値,ビペリデン換算値など,薬剤のカテゴリーによっては投与量を概算する指標があるが,このような指標がないカテゴリーの薬剤もあり,さらにすべての薬剤に共通し合算可能な投与量の指標がなく,佐藤らの研究においても投与量の影響について検討されていないことから31),今回著者らは独自に「臨床用量比」という指標を定義し,算出した.これは各薬剤の国内の添付文書上の最大用量を1とし,これに対する投与量の比を数値で示したものである.学術的な意義には欠けるものの,計算が簡便で,実臨床における投与量をイメージするには有用と考え,本研究では各薬剤の臨床用量比を算出し,合算することで,薬剤の各カテゴリーや全体での投与量の指標とすることを試みた(例:リスペリドン6 mg=6/6=1,リスペリドン3 mg=3/6=0.5,クエチアピン(速放錠)750 mg=750/750=1,クエチアピン(速放錠)500 mg=500/750=0.67,パロキセチン(速放錠)20 mg+ミルタザピン15 mg=20/40+15/45=0.5+0.33=0.83,クエチアピン(徐放錠)については300 mg=300/300=1とした).
データベースをもとに行った統計学的検討について,まず入院中の最終処方での緩下剤の使用率を算出し,次に緩下剤を処方されていた者を緩下剤あり群,処方されていなかった者を緩下剤なし群に分け,2群間の比較を行った.連続変数については中央値(四分位範囲)で示し,有意差検定に関して,大多数の名義変数についてはχ2検定を用い,例数の少ないものについてはFisherの正確確率検定を用いた.連続変数の有意差検定についてはMann-WhitneyのU検定を用いた.さらに緩下剤使用に関連する因子を検討するため,最終処方で緩下剤を使用していることを目的変数とし,多変量ロジスティック回帰分析を行った.まず年齢,性別(女性),単身生活,障害年金,生活保護,飲酒歴,喫煙歴,治療期間,入院回数,在棟日数,隔離施行,拘束施行,ECT施行,最終処方の第2世代抗精神病薬(second-generation antipsychotic:SGA)臨床用量比,第1世代抗精神病薬(first-generation antipsychotic:FGA)臨床用量比,抗パ薬臨床用量比,新規抗うつ薬臨床用量比,従来型抗うつ薬臨床用量比,BZD系抗不安薬臨床用量比,BZD系睡眠薬臨床用量比,気分安定薬臨床用量比,注意欠如・多動症(attention-deficit hyperactivity disorder:ADHD)治療薬臨床用量比,抗認知症薬臨床用量比を説明変数に用いて解析した.さらにこれらの結果を踏まえて,使用頻度が多く薬理作用に個別性の大きい抗精神病薬,新規抗うつ薬,気分安定薬については薬剤ごとの処方率,臨床用量比の比較と,説明変数に抗精神病薬,新規抗うつ薬,気分安定薬の薬剤別の臨床用量比を採用した多変量ロジスティック回帰分析を別途行った.統計解析にはMicrosoft Excel 2019およびSPSS ver 25.0を用いた.
SGA,FGAの基準については国内でリスペリドン(1996年)以降に上市された抗精神病薬をSGAとし,それ以外の抗精神病薬をFGAとした.クロザピン使用患者はいなかった.抗パ薬については,アマンタジンが緩下剤あり群で1例使用が確認されたが,それ以外は抗コリン作用の強いビペリデン,プロメタジン,トリフェキシフェニジルの3剤が使用されていた.新規抗うつ薬,従来型抗うつ薬の基準については,国内でフルボキサミン(1999年)以降に上市された抗うつ薬を新規抗うつ薬,それ以外の抗うつ薬を従来型抗うつ薬とした.BZD系薬剤には,GABA受容体作動性の非BZD系薬剤を包含した.気分安定薬には炭酸リチウム,バルプロ酸,カルバマゼピン,ラモトリギンのほか,速放錠とは薬物動態,最大用量が異なり,統合失調症の適応を有さないクエチアピン(徐放錠)を含めた.緩下剤については本研究では頓用での使用状況については明らかにすることが困難であったため,定期薬での緩下剤処方について集計し,検討を行った.緩下剤には,本研究において排便コントロール目的に用いられていたセンノシド,センナ,センナエキス,酸化マグネシウム,モサプリドクエン酸塩,パンテチン,ルビプロストン,エロビキシバット,リナクロチドのほか,診療録より排便コントロール目的で用いたことが確認できた漢方薬(大建中湯,防風通聖散,桃核承気湯,桂枝加芍薬湯)を包含した.
II.倫理的配慮
本研究は「人を対象とする医学系研究に関する倫理指針」(厚生労働省・文部科学省)に基づき,「昭和大学における人を対象とする研究等に関する倫理委員会」の承認を受けて行われた(受付番号21-160-A).
なお,本研究は診療録をもとにした観察研究であり,事前に個別の同意を得ることは困難であったため,目的を含む研究の実施について昭和大学のホームページに掲示し,研究対象者が個人情報の使用を拒否できる機会を保証した.また個人情報は匿名化番号を用い,情報管理責任者を別に任命して管理した.個人と匿名化番号の対照表はパスワード設定によるアクセス制限を設けたうえで,外部ネットワークから分離された院内サーバに保管した.
III.結果
1.対象者の概要
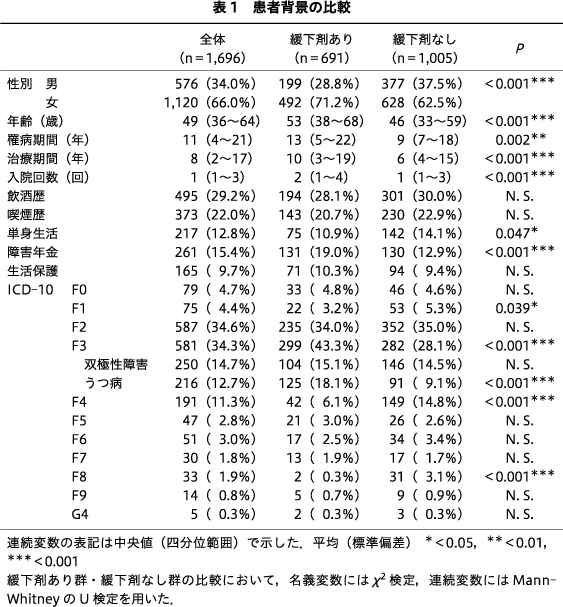
2014年1月1日から2021年12月31日に当院のスーパー救急病棟に入院した患者は,当院で複数の入院エピソードのある患者(217例,計600回入院)も入院ごとに1例として計算すると,合計1,696例であり,男性576例,女性1,120例,年齢の中央値は49(36~64)歳,罹病期間の中央値は11(4~21)年,治療期間の中央値は8(2~17)年,入院回数は1(1~3)回,飲酒歴ありは495例(29.2%),喫煙歴ありは373例(22.0%),単身生活は217例(12.8%),障害年金は261例(15.4%),生活保護は165例(9.7%),ICD-10による主診断は,F0が79例(4.7%),F1が75例(4.4%),F2が587例(34.6%),F3が581例(34.3%),F4が191例(11.3%),F5が47例(2.8%),F6が51例(3.0%),F7が30例(1.8%),F8が33例(1.9%),F9が14例(0.8%),G4が5例(0.3%)であった.
最終処方で緩下剤を処方されていた患者は691例(40.7%),処方されていなかった患者は1,005例(59.3%)であった(表1).
2.患者背景の比較
連続変数の表示については中央値(四分位範囲)で示した.最終処方で緩下剤を処方されていた患者を緩下剤あり群,処方されていなかった患者を緩下剤なし群として集計した結果,緩下剤あり群は有意に女性の比率が高かった(P<0.001).年齢の中央値は緩下剤あり群が53(38~68)歳,緩下剤なし群が46(33~59)歳であり,有意に緩下剤あり群が高齢であった(P<0.001).罹病期間,治療期間の中央値はそれぞれ緩下剤あり群13(5~22)年,10(3~19)年,緩下剤なし群9(7~18)年,6(4~15)年であり,有意に緩下剤あり群が長かった(P=0.002,P<0.001).入院回数の中央値は緩下剤あり群が2(1~4)回,緩下剤なし群が1(1~3)回であり,緩下剤あり群が有意に多かった(P<0.001).飲酒歴,喫煙歴については両群間で有意差はみられなかった.生活保護受給者の比率は両群間で有意差はなく,緩下剤あり群では単身生活者が75例(10.9%),緩下剤なし群142例(14.1%)であり,緩下剤あり群が有意に少なく(P=0.047),障害年金受給者は緩下剤あり群が131例(19.0%)であり,緩下剤なし群130例(12.9%)に比べて有意に多かった(P<0.001).ICD-10の主診断では,緩下剤あり群はF1圏22例(3.2%),F4圏42例(6.1%),F8圏2例(0.3%),緩下剤なし群はF1圏53例(5.3%),F4圏149例(14.8%),F8圏31例(3.1%)であり,いずれも緩下剤あり群が有意に少なく(P=0.039,P<0.001,P<0.001),F3圏は緩下剤あり群が299例(43.3%),緩下剤なし群が282例(28.1%)と,緩下剤あり群が有意に多かった(P<0.001).またF3圏において,うつ病,双極性障害を個別に集計したところ,うつ病は緩下剤あり群が有意に多く(P<0.001),双極性障害では有意差がみられなかった(表1).
3.入院治療の比較
任意入院の比率については両群で有意差はなく,医療保護入院の比率は緩下剤あり群が496例(71.8%),緩下剤なし群が592例(58.9%)であり,緩下剤あり群が有意に高く(P<0.001),措置入院,緊急措置入院は緩下剤あり群がそれぞれ66例(9.6%),6例(0.9%),緩下剤なし群がそれぞれ194例(19.3%),36例(3.6%)であり,いずれも緩下剤あり群が有意に低かったが(P<0.001),自発的入院,非自発的入院の合計では有意差はみられなかった.隔離施行は緩下剤あり群227例(32.9%),緩下剤なし群437例(43.5%)であり緩下剤あり群が有意に低く(P<0.001),HPD点滴施行も緩下剤あり群46例(6.7%),緩下剤なし群97例(9.7%)であり,緩下剤あり群が有意に低かった(P=0.029).自宅退院率は緩下剤あり群が519例(75.1%),緩下剤なし群が658例(65.5%)と緩下剤あり群が有意に高く(P<0.001),施設退院も緩下剤あり群が29例(4.2%),緩下剤なし群が19例(1.9%)と緩下剤あり群が有意に高く(P=0.004),精神科病院への転院率は緩下剤あり群が130例(18.8%),緩下剤なし群が298例(29.7%)と緩下剤あり群が有意に低かった(P<0.001).在棟日数は緩下剤あり群66(36~89)日,緩下剤なし群47(23~83)日であり,緩下剤あり群が有意に長かった(P<0.001)(表2).
4.最終処方―臨床用量比の比較―
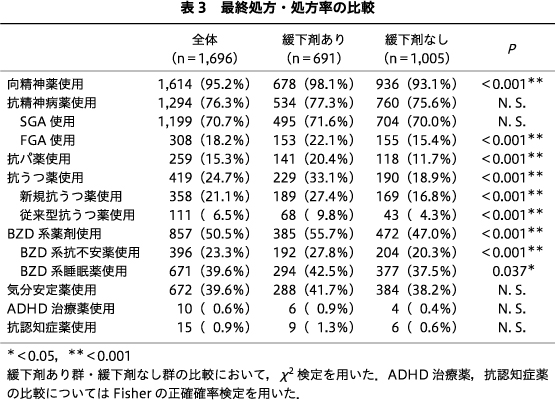
抗パ薬を含めた全体の向精神薬処方率は,緩下剤あり群678例(98.1%),緩下剤なし群936例(93.1%)であり,緩下剤あり群が有意に高かった(P<0.001).抗精神病薬については両群間で全体の処方率,SGAの処方率に有意差はみられなかったが,FGAの処方率は緩下剤あり群が153例(22.1%)であったのに対し,緩下剤なし群は155例(15.4%)であり,緩下剤あり群が有意に高かった(P<0.001).抗パ薬の処方率は緩下剤あり群が141例(20.4%)に対し緩下剤なし群118例(11.7%)であり,緩下剤あり群が有意に高かった(P<0.001).抗うつ薬の処方率は,緩下剤あり群は全体で229例(33.1%),新規抗うつ薬189例(27.4%),従来型抗うつ薬68例(9.8%)であったのに対し,緩下剤なし群はそれぞれ190例(18.9%),169例(16.8%),43例(4.3%)と,いずれも緩下剤あり群が有意に高かった(いずれもP<0.001).BZD系薬剤についても緩下剤あり群は全体385例(55.7%),抗不安薬192例(27.8%),睡眠薬294例(42.5%)であったのに対し,緩下剤なし群はそれぞれ472例(47.0%),204例(20.3%),377例(37.5%)と,いずれも緩下剤あり群が有意に高かった(P<0.001,P<0.001,P=0.037).気分安定薬,ADHD治療薬,抗認知症薬の使用率については両群間で有意差はみられなかった(表3).
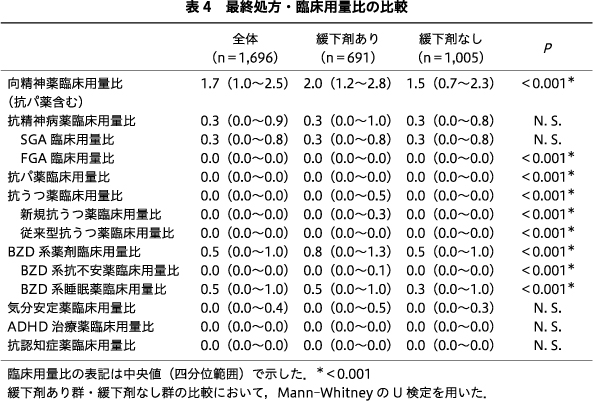
臨床用量比は中央値(四分位範囲)を示した.抗パ薬を含む向精神薬全体の臨床用量比は緩下剤あり群が2.0(1.2~2.8),緩下剤なし群が1.5(0.7~2.3)であり,緩下剤あり群が有意に高かった(P<0.001).抗精神病薬のうち全体,SGAは両群で有意差はなく,FGAについては両群とも中央値は0.0(0.0~0.0)であったが,単変量解析を行うと有意に緩下剤あり群が高かった(P<0.001).抗パ薬の臨床用量比の中央値はいずれの群も0.0(0.0~0.0)であったが,単変量解析では緩下剤あり群が有意に高かった(P<0.001).抗うつ薬は全体の中央値は緩下剤あり群が0.0(0.0~0.5),緩下剤なし群が0.0(0.0~0.0),新規抗うつ薬は緩下剤あり群が0.0(0.0~0.3),緩下剤なし群が0.0(0.0~0.0)であり,いずれも緩下剤あり群が有意に多かった(P<0.001).従来型抗うつ薬の中央値はいずれの群も0.0(0.0~0.0)であったが,単変量解析では緩下剤あり群が有意に高かった(P<0.001).BZD系薬剤の臨床用量比の中央値は,緩下剤あり群は全体が0.8(0.0~1.3),BZD系抗不安薬が0.0(0.0~0.1),BZD系睡眠薬が0.5(0.0~1.0)であったのに対し,緩下剤なし群はそれぞれ0.5(0.0~1.0),0.0(0.0~0.0),0.3(0.0~1.0)と,いずれも緩下剤あり群が有意に高かった(いずれもP<0.001).気分安定薬,ADHD治療薬,抗認知症薬には有意差がみられなかった(表4).
5.薬剤をカテゴリー別に分類した場合の緩下剤使用に関連する因子の検討
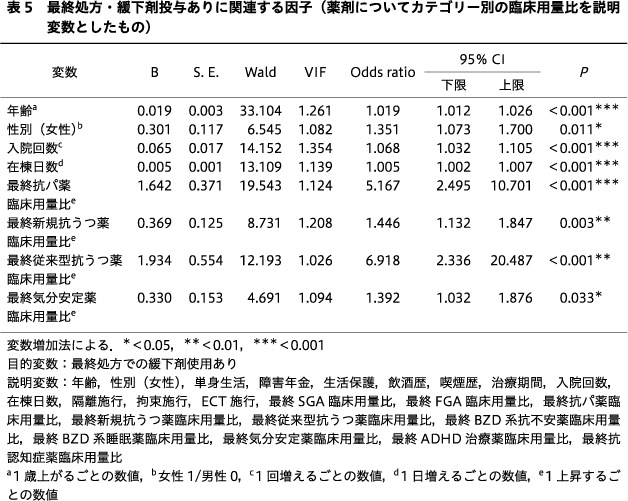
多変量ロジスティック回帰分析では,カテゴリー別に各向精神薬の臨床用量比を説明変数に用いた場合,最終処方の緩下剤使用に有意に関連する因子は,年齢(OR:1.019,95% CI:1.012~1.026,P<0.001),性別(女性)(OR:1.351,95% CI:1.073~1.700,P=0.011),入院回数(OR:1.068,95% CI:1.032~1.105,P<0.001),在棟日数(OR:1.005,95% CI:1.002~1.007,P<0.001),最終処方の抗パ薬臨床用量比(OR:5.167,95% CI:2.495~10.701,P<0.001),最終処方の新規抗うつ薬の臨床用量比(OR:1.446,95% CI:1.132~1.847,P=0.003),最終処方の従来型抗うつ薬の臨床用量比(OR:6.918,95% CI:2.336~20.487,P<0.001),最終処方の気分安定薬の臨床用量比(OR:1.392,95% CI:1.032~1.876,P=0.033)であった(表5).
6.最終処方―抗精神病薬,新規抗うつ薬,気分安定薬の各薬剤ごとの処方率の比較―
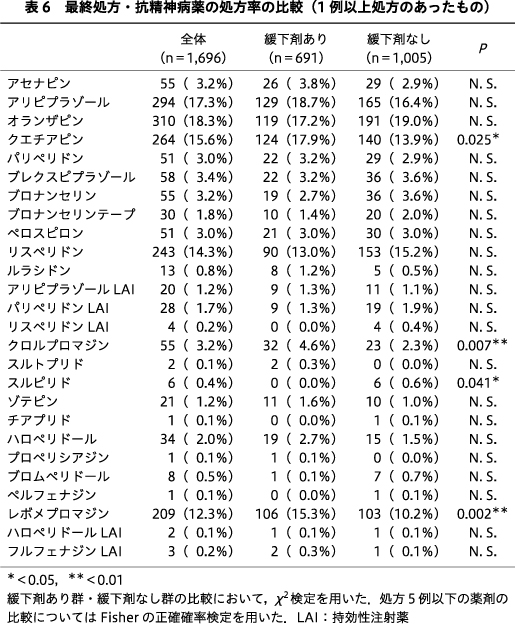
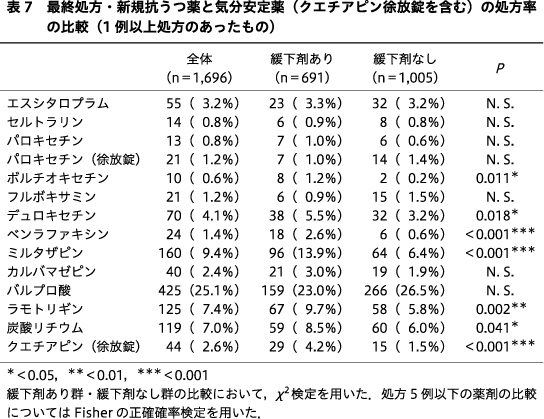
抗精神病薬,新規抗うつ薬,気分安定薬の薬剤ごとの処方率を比較すると,抗精神病薬のうちクエチアピンが緩下剤あり群124例(17.9%),緩下剤なし群140例(13.9%),クロルプロマジンが緩下剤あり群32例(4.6%),緩下剤なし群23例(2.3%),レボメプロマジンが緩下剤あり群106例(15.3%),緩下剤なし群103例(10.2%)であり,いずれも緩下剤あり群の比率が高かった(P=0.025,P=0.007,P=0.002).スルピリドは緩下剤なし群のみに6例(0.6%)に処方されており,有意に緩下剤あり群で処方率が低かった(P=0.041)(表6).新規抗うつ薬ではボルチオキセチンが緩下剤あり群8例(1.2%),緩下剤なし群2例(0.2%),デュロキセチンが緩下剤あり群38例(5.5%),緩下剤なし群32例(3.2%),ベンラファキシンが緩下剤あり群18例(2.6%),緩下剤なし群6例(0.6%),ミルタザピンが緩下剤あり群96例(13.9%),緩下剤なし群64例(6.4%)といずれも緩下剤あり群が有意に高く(P=0.011,P=0.018,P<0.001,P<0.001),気分安定薬ではラモトリギンが緩下剤あり群67例(9.7%),緩下剤なし群58例(5.8%),炭酸リチウムが緩下剤あり群59例(8.5%),緩下剤なし群60例(6.0%),クエチアピン(徐放錠)が緩下剤あり群29例(4.2%),緩下剤なし群15例(1.5%)であり,いずれも緩下剤あり群が有意に高かった(P=0.002,P=0.041,P<0.001)(表7).臨床用量比についてはいずれの薬剤についても両群とも中央値は0.0(0.0~0.0)であり,2群間で有意差はみられなかった.
7.抗精神病薬,新規抗うつ薬,気分安定薬の各薬剤の臨床用量比を説明変数に用いた場合の緩下剤使用に関連する因子の検討
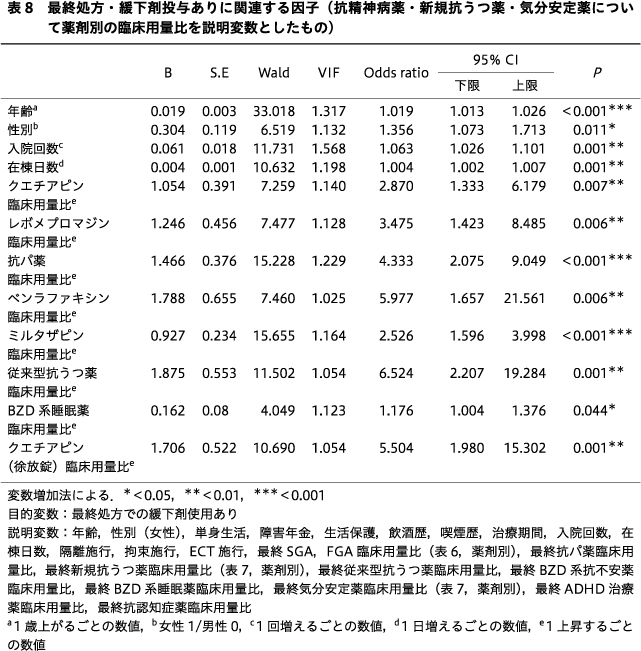
抗精神病薬,新規抗うつ薬,気分安定薬について,各薬剤の臨床用量比を説明変数に用いた多変量ロジスティック回帰分析では,最終処方の緩下剤使用に有意に関連する因子は,年齢(OR:1.019,95% CI:1.013~1.026,P<0.001),性別(女性)(OR:1.356,95% CI:1.073~1.713,P=0.011),入院回数(OR:1.063,95% CI:1.026~1.101,P=0.001),在棟日数(OR:1.004,95% CI:1.002~1.007,P=0.001),最終処方のクエチアピン臨床用量比(OR:2.870,95% CI:1.333~6.179,P=0.007),最終処方のレボメプロマジン臨床用量比(OR:3.475,95% CI:1.423~8.485,P=0.006),最終処方の抗パ薬臨床用量比(OR:4.333,95% CI:2.075~9.049,P<0.001),最終処方のベンラファキシン臨床用量比(OR:5.977,95% CI:1.657~21.561,P=0.006),最終処方のミルタザピン臨床用量比(OR:2.526,95% CI:1.596~3.998,P<0.001),最終処方の従来型抗うつ薬臨床用量比(OR:6.524,95% CI:2.207~19.284,P=0.001),最終処方のBZD系睡眠薬臨床用量比(OR:1.176,95% CI:1.004~1.376,P=0.044),最終処方のクエチアピン(徐放錠)臨床用量比(OR:5.504,95% CI:1.980~15.302,P=0.001)であった(表8).
IV.考察
本研究において,最終処方における緩下剤の使用率は40.7%であり,佐藤らの報告における便秘症の有病率41.8%に近く31),緩下剤使用が排便に問題を有していることを意味すると考えた場合,精神科救急病棟の入院患者の便秘症有病率は,一般人口に比べて高い可能性が示唆された19)27)35).
多変量ロジスティック回帰分析において,いずれの説明変数を用いても緩下剤使用リスクと関連していたのは,薬剤以外では年齢が上がること,女性であること,入院回数が多くなること,在棟日数が長くなることであった.
高齢者は,腸管の筋層内の神経細胞が変性し星状神経節の数が減少することや,直腸感覚の閾値が高くなる可能性があること9)21),女性は月経に伴い,黄体ホルモンが腸管運動を抑制することや,分娩回数,加齢による骨盤底筋協調運動障害のリスク上昇,加齢による運動量の減少,併存疾患,処方薬,食事量の変化,精神状態の変化などが便秘の出現に影響している可能性がある3)17).Horii, K. らは,下行性疼痛抑制経路を通じて供給される神経伝達物質が性別により異なることが,性別による便秘症発症率の違いに影響している可能性を指摘している12).佐藤らの報告においても女性,高齢者であることが便秘症の発症リスクを高める可能性があることが示されており31),本研究でもほぼ同様の結果が得られたことから,精神科外来通院中の患者,精神科救急病棟に入院中の患者のいずれも,一般人口と同様に女性,高齢者において便秘症の発症リスクが高く,本研究における緩下剤使用リスクに反映されたと考えられた.
入院回数と緩下剤使用に関連がみられた理由については推測の域を出ないが,統合失調症は再発することにより治療反応性が低下する可能性があるため29)39)42),統合失調症患者が再発による入院を繰り返した場合,抗精神病薬への治療反応性が低下し,さらなる抗精神病薬の増量と,それに伴う抗パ薬の追加が行われ,緩下剤投与の必要性が高くなる可能性がある.また本稿では示さなかったが,全体で緩下剤あり群,緩下剤なし群の比較において双極性障害の比率に有意差はないものの,双極性障害患者の緩下剤使用群は単変量解析において有意に入院回数が多かった.双極性障害について複数回エピソードの患者は初回エピソードの患者よりも大脳皮質の体積が減少しており,進行性の疾患であることを示唆する報告があることから1),統合失調症と同様に再発を繰り返すことにより治療反応性が低下し,より多くの向精神薬を要し,緩下剤使用リスクが高まり,全体としての入院回数との関連に影響しているのかもしれない.その他の疾患については,現時点で入院回数と向精神薬の投与量や緩下剤使用リスクについて関連性を示すエビデンスは見いだせなかったが,疾患を問わず再発再燃が多い患者は難治性で処方が多くなる可能性や,再発を防ぎたい治療者側の心理による向精神薬増量の可能性などについても,多角的な検討が必要と思われた.
在棟日数と緩下剤の関連については,入院による運動不足の影響が考えられる.運動不足と便秘症の関連については『慢性便秘症診療ガイドライン2017』でも指摘されており26),加賀野井らは,健常者の1日の平均活動エネルギー量は平均350.9キロカロリーであったのに対し,精神科病院に入院している患者は42キロカロリーであったことを報告している15).また,ストレスとの関連についても考慮する必要があるかもしれない.ストレスにより交感神経が優位な状況になると腸管の蠕動運動は低下し,腸液分泌も抑制されるため,便秘が出現しやすくなると考えられており7),佐藤らは外来通院患者において,ストレスの存在も便秘症リスクに関連していたことを報告している31).スーパー救急病棟は非自発的な入院患者が多くを占めており,著しい精神運動興奮を呈していることや,自殺企図の危険性が高い状態にあることなどにより,物理的な行動制限を要する患者も一定数存在する.強制された非自発的な入院はスティグマと関連し,QOLや自尊心に負の効果をもたらすこと,非自発的投薬,機械的拘束,その複合手段の比較において,機械的拘束,複合手段は非自発的投薬よりもさらにストレスが高いことなどが報告されており8)30),患者にとって非自発的な入院,さらに同意できないなかでの強制的治療によるストレスは大きいと考えられる.このように精神科救急病棟においては入院期間が長くなることにより,運動不足とストレスが複合して緩下剤使用リスクを上昇させている可能性を考え,今後は非自発的入院の長期化と,身体症状との関連についても検討する必要があると考えられた.また強制的治療を最も要している措置入院患者は緩下剤あり群が有意に少なかったが,措置入院患者は初発,医療中断例も多く,当院で初めて内服が開始される症例も多いため向精神薬の投与量自体が少ないことや,神奈川県の救急システムにより平均14日の短期間で後方病院に転院するため,非自発的な入院が当院で長期化することは比較的少ないことから,逆に緩下剤使用リスクが低かったと推測された.
薬剤については,各向精神薬のカテゴリー別臨床用量比を説明変数に用いた場合,最終処方の抗パ薬,新規抗うつ薬,従来型抗うつ薬,気分安定薬の臨床用量比が緩下剤ありに有意に関連していたため,これらのカテゴリーの薬剤の投与量が緩下剤使用リスクを上昇させる可能性が示唆された.
抗精神病薬に関しては佐藤らの報告と同様に,SGA,FGAをそれぞれ包括して多変量解析を行うと,抗精神病薬と緩下剤投与リスクとの関連が認められなかった31).この点については佐藤らが考察しているように,SGA,FGAをそれぞれ包括したことにより,ドパミン受容体遮断作用や抗コリン作用が強いもの,弱いものの影響が相殺され,関連が低くなっている可能性があると思われた31).加えて,佐藤らの研究は外来患者が対象であり,本研究は精神科救急病棟の入院患者が対象であったため,いずれの研究においても便秘の出現率が高いと報告されているクロザピン使用患者がいないことや13),長期入院患者が非常に少ないことなど,患者層の偏りも影響している可能性があると思われた.これまで抗精神病薬による便秘症が重篤な身体合併症や早期死亡につながる可能性があることが指摘されており4)5),Talley, N. J. らによれば抗精神病薬使用患者が便秘を発症するリスクは1.9倍であったことが報告されている40).これらのことから,先行研究と乖離している本研究の結果については,抗精神病薬間の薬理作用の差が大きいことが影響していると予想し,説明変数に各薬剤の臨床用量比を用いて再度解析を行った.その結果,クエチアピン,レボメプロマジン,気分安定薬に分類したクエチアピン(徐放錠)が臨床用量比と関連していた.クエチアピンはドパミンD2遮断作用よりも抗コリン作用が相対的に強く,抗ヒスタミン作用がさらに強いため32),これらの作用が複合して緩下剤使用リスクを上昇させる可能性があるかもしれない.Suttajit, S. らによる双極性障害の急性期の抑うつ状態に対するクエチアピンの有効性に関するメタ解析でも,有意に便秘および口喝のリスクが高かったことが報告されている37).レボメプロマジンも抗コリン作用,抗ヒスタミン作用を有しているため,同様の機序で便秘の一因となる可能性があると思われた.なお,稲垣らは抗精神病薬の臨床試験,市販後調査の副作用発現率を分析し,便秘の出現率はクロザピン23.66~33.8%,ハロペリドール14.4%,オランザピン,リスペリドン,ブロナンセリン,パリペリドン,ペロスピロン,クエチアピン,アリピプラゾール4.71~15.45%,アセナピン,ブレクスピプラゾール,ルラシドン1.8~3.2%であったことを報告した13).またLin, C. H. らは台湾において2006年から2017年の間に退院し,SGAs単剤処方の患者(n=11,861)のうち,3,336例(28.1%)が下剤を併用していたこと,高齢,抗精神病薬や抗コリン薬の高用量は下剤使用の増加と関連していたこと,SGAsのなかではクロザピンが最も下剤の使用率が高く,ゾテピン,クエチアピン,オランザピンがそれに続き,リスペリドン,アミスルプリド,アリピプラゾール,パリペリドン,ジプラシドンは同程度の下剤使用率であったことを報告している22).これらのことから,抗精神病薬は薬剤によって薬理作用の違いが大きく,副作用の種類や頻度に差があるが,単独でも便秘症リスクを上昇させる可能性があり,単変量解析で有意差のあったクロルプロマジンや,本研究で有意な関連がみられなかった抗精神病薬についても注意が必要であると考えられた.
抗パ薬に関しては,本研究で使用が確認されたものはアマンタジン1例を除き,他はすべて抗コリン作用によりパーキンソン症状を緩和する薬剤であったため,推測通り抗コリン作用が緩下剤使用リスクを上昇させていると思われた.
抗うつ薬に関しては副作用に関するインターネットでのアンケートにおいて,回答者の73.4%に副作用が認められ,出現頻度は眠気,だるさ,胃部不快,便秘,めまい,口渇,体重減少の順であったこと18),三環系,四環系といった古典的な抗うつ薬よりも副作用が少なく,比較的抗コリン作用が弱いと考えられている新規の抗うつ薬に関しても,304の研究をもとにしたメタ解析において,治療開始後12週間以内に発現した消化器系症状(悪心・嘔吐,下痢,便秘,腹痛,消化不良,食欲不振,口渇など)の出現率は,いずれの抗うつ薬に関してもプラセボと比較して高かったこと28),統合失調症治療において,抗精神病薬に抗うつ薬を上乗せすることによる精神症状の改善や,副作用,治療反応率などについて検討した研究においては,抗精神病薬に抗うつ薬を付加した場合,腹痛,便秘,めまい,口渇を訴える患者がより多かったことが報告されている11).本研究において,薬剤別では推測通り全般的に抗コリン作用,抗ヒスタミン作用の強い従来型抗うつ薬の臨床用量比と緩下剤使用リスクの間に関連を認めたが,薬理作用の差異がある新規抗うつ薬の薬剤ごとの説明変数を用いた多変量解析においては,ベンラファキシン,ミルタザピンの臨床用量比が緩下剤使用と有意に関連していた.ベンラファキシンは選択的セロトニン再取り込み阻害薬(selective serotonin reuptake inhibitor:SSRI)であるシタロプラムよりも口喝,便秘の副作用が多かったことが報告されているが33),ミルタザピンは,Watanabe, N. らの報告では便秘のリスクが相対的に低かったとされている41).CANMATのガイドラインでは,ベンラファキシンは便秘の出現率が速放錠で15%,徐放錠で8%,ミルタザピンは13%と報告されている16).また,単変量解析で有意差が認められたボルチオキセチン,デュロキセチンも,同ガイドラインでは便秘の出現率がそれぞれ4%,11%とSSRIであるフルボキサミンやパロキセチンよりも低く16),特にボルチオキセチンは治験の段階で便秘の出現頻度は高くないことが報告されている38).これらの知見を踏まえると,現時点では結果について薬理学的,統計学的に理由を明確にすることは困難であるが,新規抗うつ薬についても便秘の出現頻度に差があり,薬剤によっては便秘が出現する可能性があることに留意する必要があると思われた.ただし本研究の結果については慎重な解釈を要し,症例数の少ない薬剤については,便秘を回避するために使用された結果,関連が認められた可能性がないかなど,さらに詳細な検討を行う必要があると考えられる.
BZD系薬剤については,臨床用量比の単変量解析ではBZD系薬剤全体,抗不安薬,睡眠薬のいずれも緩下剤あり群で有意に高く,多変量解析においてはBZD系睡眠薬の臨床用量比が緩下剤使用リスクに関連していた.BZD系薬剤も抗コリン作用を有し,便秘症のリスクとなることが『慢性便秘症診療ガイドライン2017』で指摘されており26),不安障害に対するBZD系薬剤の長期投与の有用性を検討したシステマティックレビューにおいては,8件のRCT(n=1,228)より,BZD系薬剤はプラセボよりも便秘と口喝の頻度が高かったと報告されているため34),BZD系薬剤が抗コリン作用によって便秘症の出現に促進的に作用する可能性がある点について,留意しておく必要があるだろう.
気分安定薬については,単変量解析ではラモトリギン,炭酸リチウム,クエチアピン(徐放錠)の処方率が緩下剤あり群で有意に高かったが,多変量解析では,クエチアピン(徐放錠)の臨床用量比が有意に関連し,他の気分安定薬の臨床用量比には関連が認められなかった.このことから,気分安定薬として包括して解析した場合は,クエチアピン(徐放錠)の影響が相対的に大きいと考えられた.ただし単剤,併用を含む抗てんかん薬による胃腸障害に関する横断研究において,胃腸障害の出現頻度は胸やけ34.6%,吐き気33.7%,便秘26.0%,嘔吐22.1%,下痢21.2%,嚥下障害19.2%であったことが報告されていることや14),炭酸リチウム投与後に難治性の便秘を発症した症例報告もあることから24),クエチアピン(徐放錠)以外の気分安定薬に関しても,便秘の出現に一定の注意を払う必要があると思われた.
いずれにしても,実臨床データに基づく横断研究であることから向精神薬の処方頻度や処方量に差があり,処方頻度や処方量の少ない薬剤については統計学的に誤差が生じやすくなる可能性や,検出が困難になる可能性があることから,本研究における薬剤ごとの関連については,現時点では参考程度にとどめる必要があると考えられる.
また,本研究においては診断と処方薬の間に多重共線性が認められる可能性があることや,向精神薬の影響について明らかにしたいという観点から,診断については多変量解析には含めず,ICD-10に基づいたカテゴリー別の単変量解析のみを行った.本稿では示していないが,診断別に考察すると,F1圏での緩下剤なし群の患者は同カテゴリーでの緩下剤あり群の患者と比較して有意に在棟日数が短く,自宅退院率が低かったが,措置入院の比率が最も高かった.措置入院患者の多くが神奈川県の精神科救急システムにより,初期治療を行い,ある程度静穏が得られた状態で転院するため,当院での入院期間が短いことにより最終的な処方量が少なく緩下剤処方も少ないと考えられ,このような患者が多いことにより,F1圏では緩下剤なし群の比率が高いと思われた.F2圏は緩下剤あり群,緩下剤なし群の比率に有意差を認めなかったが,F2圏での緩下剤あり群は年齢が高く,罹病期間,治療期間が長く,入院回数が多かった.向精神薬については抗精神病薬の臨床用量比に有意差はなかったが,抗パ薬,抗うつ薬,BZD系薬剤の使用率および臨床用量比が有意に高かった.よって本研究のF2圏の患者の緩下剤使用リスクには,患者背景や向精神薬の量や質が反映していると思われた.F3圏は全体で緩下剤あり群の比率が有意に高かったが,双極性障害では有意差がなく,うつ病において有意差がみられているため,抗うつ薬の影響が大きいと思われた.F4圏は,緩下剤あり群は向精神薬の臨床用量比が同カテゴリーでの緩下剤なし群よりも多い傾向があったことから(P=0.08),F4圏全体としては緩下剤なし群が多いが,処方量が多い少数の患者で緩下剤の処方が必要であったと思われた.F8圏の患者は薬物療法自体の必要性が少なく,全体の処方量が少ないため,緩下剤使用の必要性が低かったと考えられた.このように診断別に検討を行っても,向精神薬の影響が大きいと推測されたが,今後は疾患自体の影響についても,内服をしていない患者で調査を行うなど,さらに検討を続ける必要があるかもしれない.
なお,今回,投与量の指標として用いた臨床用量比であるが,算出が簡便で,添付文書上の上限が定められている薬剤であればどのような薬剤でも用いることができる点,また多変量解析におけるオッズ比に関しても,おおむね1剤分,上限量まで用いた場合の関連を表すという点で投与量をイメージしやすいという利点があると思われた.また抗精神病薬におけるクロルプロマジン換算値,抗うつ薬におけるイミプラミン換算値,BZD系薬剤におけるジアゼパム換算値などの指標がない薬剤に対しても用いることができる点などについて,有用である印象であった.とはいえ,薬理作用に基づいて定められた指標ではなく,前述の換算値と乖離があることや,薬剤のさまざまな作用特徴や代謝経路,個人の体質による代謝のされ方はまったく同一ではないことなどから,臨床用量比の意義については,あくまで用量依存的な関連を検討するために本研究に限定して用いた計算方法であり,学術的には参考にとどめておくべきであると思われる.
本研究は佐藤らの報告と類似している点が多く31),本研究と併せて異なる母集団による2つの研究において共通して示された年齢,性別(女性),抗パ薬,新規抗うつ薬,従来型抗うつ薬,気分安定薬といった因子は,便秘症,緩下剤使用リスクに関連していると思われた.そして結果の解釈については検討の余地があるものの,改めて向精神薬は全般的に便秘症発症リスクを高めるおそれがあることが確認され,本研究で示された薬剤は用量依存的にリスクを高める可能性があることが示唆された.精神疾患の治療を行うにあたり,生命予後を考慮した薬物療法を検討すべきであり,その方策として便秘を起こしにくい薬物療法を心がける必要があると考えられる.
V.本研究の限界
本研究の限界として,単施設での調査であること,横断研究であるため因果関係を示せないこと,当院に複数回の入院エピソードのある患者も入院ごとに1例として計算していることによる偏りが生じる可能性があること,緩下剤を内服していることと便秘症であることは同義とはいえないこと,疾患の影響を検討できていないこと,内服している期間の影響を検討できていないこと,頓用の使用について検討できていないこと,他の併存疾患について検討していないこと,投与量の指標として用いた臨床用量比が独自の指標であること,数種類の向精神薬を包含した解析では,薬理作用がカテゴリー内で相殺されている可能性があること,薬剤ごとの解析では症例数にばらつきが大きいこと,臨床用量比が投与量の指標として妥当であるかどうか検討が必要であること,精神科救急病棟の入院患者を対象としたため,精神科の入院患者として一般化することはできないことなどが挙げられる.
おわりに
本研究の結果から,当院の精神科救急病棟の入院患者の緩下剤使用率は40%を超えており,高齢,女性,入院回数が多いこと,在棟日数が長くなることは緩下剤使用リスクを上昇させること,薬剤をカテゴリー別に包括して検討した場合は抗パ薬,従来型抗うつ薬,新規抗うつ薬,気分安定薬の投与量が緩下剤使用リスクと関連していることが示され,抗精神病薬,新規抗うつ薬,気分安定薬を薬剤ごとに説明変数に採用した多変量解析ではBZD系睡眠薬のほか,カテゴリー別では有意差のなかった抗精神病薬のうちの数種類を含め,いくつかの薬剤に有意な関連が認められた.薬剤別の検討では症例数の差も大きく,関連については慎重に解釈すべきであるが,これらの薬剤を減量,あるいは投与を控えることで,緩下剤使用リスクが低下する可能性があると考えられた.今後は症例数をさらに増やして検討する必要があると思われる.
なお,本論文に関連して開示すべき利益相反はない.
1) Achalia, R., Raju, V. B., Jacob, A., et al.: Comparison of first-episode and multiple-episode bipolar disorder: a surface-based morphometry study. Psychiatry Res Neuroimaging, 302; 111110, 2020![]()
2) Chang, J. Y., Locke, G. R. 3rd., McNally, M. A., et al.: Impact of functional gastrointestinal disorders on survival in the community. Am J Gastroenterol, 105 (4); 822-832, 2010![]()
3) Chang, L., Toner, B. B., Fukudo, S., et al.: Gender, age, society, culture, and the patient's perspective in the functional gastrointestinal disorders. Gastroenterology, 130 (5); 1435-1446, 2006![]()
4) De Hert, M., Hudyana, H., Dockx, L., et al.: Second-generation antipsychotics and constipation: a review of the literature. Eur Psychiatry, 26 (1); 34-44, 2011![]()
5) Dockx, L., De Hert, M.: Antipsychotica en constipatie: een literatuurstudie. Psychiatr Verpleging, 85 (3); 141-151, 2009
6) Every-Palmer, S., Newton-Howes, G., Clarke, M. J.: Pharmacological treatment for antipsychotic-related constipation. Cochrane Database Syst Rev, 1 (1); CD011128, 2017![]()
7) 後藤由夫, 本郷道夫編: 自律神経の基礎と臨床, 改訂3版. 医薬ジャーナル社, 大阪, 2006
8) Guzmán-Parra, J., Aguilera-Serrano, C., García-Sanchez, J. A., et al.: Experience coercion, post-traumatic stress, and satisfaction with treatment associated with different coercive measures during psychiatric hospitalization. Int J Ment Health Nurs, 28 (2); 448-456, 2019![]()
9) Hanani, M., Fellig, Y., Udassin, R., et al.: Age-related changes in the morphology of the myenteric plexus of the human colon. Auton Neurosci, 113 (1-2); 71-78, 2004![]()
10) Hasan, A., Falkai, P., Wobrock, T., et al.: World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for biological treatment of schizophrenia, part 2: update 2012 on the long-term treatment of schizophrenia and management of antipsychotic-induced side effects. World J Biol Psychiatry, 14 (1); 2-44, 2013![]()
11) Helfer, B., Samara, M. T., Huhn, M., et al.: Efficacy and safety of antidepressants added to antipsychotics for schizophrenia: a systematic review and meta-analysis. Am J Psychiatry, 173 (9); 876-886, 2016![]()
12) Horii, K., Ehara, Y., Shiina, T., et al.: Sexually dimorphic response of colorectal motility to noxious stimuli in the colorectum in rats. J Physiol, 599 (5); 1421-1437, 2021![]()
13) 稲垣 中, 佐藤英樹, 稲田健ほか: わが国で実施された臨床試験と使用成績調査の結果から見た抗精神病薬による統合失調症薬物治療の安全性. 臨床精神薬理, 24 (11); 1153-1169, 2021
14) Jahromi, S. R., Togha, M., Fesharaki, S. H., et al.: Gastrointestinal adverse effects of antiepileptic drugs in intractable epileptic patients. Seizure, 20 (4); 343-346, 2011![]()
15) 加賀野井聖二, 橋本洋平, 寺田智加ほか: 精神科入院患者の身体組成と身体活動に関する予備的横断研究. 理学療法学, 39 (suppl 2); 1455, 2012
16) Kennedy, S. H., Lam, R. W., McIntyre, R. S., et al.: Canadian Network for Mood and Anxiety Treatments (CANMAT) 2016 Clinical Guidelines for the Management of Adults with Major Depressive Disorder: Section 3. Pharmacological Treatments. Can J Psychiatry, 61 (9); 540-560, 2016![]()
17) Kepenekci, I., Keskinkilic, B., Akinsu, F., et al.: Prevalence of pelvic floor disorders in the female population and the impact of age, mode of delivery, and parity. Dis Colon Rectum, 54 (1); 85-94, 2011![]()
18) Kikuchi, T., Uchida, H., Suzuki, T., et al.: Patients' attitudes toward side effects of antidepressants: an Internet survey. Eur Arch Psychiatry Clin Neurosci, 261 (2); 103-109, 2011![]()
19) 厚生労働省: 平成28年国民生活基礎調査の概況. 2017 (http://www.mhlw.go.jp/toukei/saikin/hw/k-tyosa/k-tyosa16/dl/16.pdf) (参照2022-08-30)
20) Lacy, B. E., Mearin, F., Chang, L., et al.: Bowel disorders. Gastroenterology, 150 (6); 1393-1407, 2016![]()
21) Lagier, E., Delvaux, M., Vellas, B., et al.: Influence of age on rectal tone and sensitivity to distension in healthy subjects. Neurogastroenterol Motil, 11 (2); 101-107, 1999![]()
22) Lin, C. H., Chan, H. Y., Hsu, C. C., et al.: Factors associated with laxative use in schizophrenia patients treated with second-generation antipsychotics. Eur Neuropsychopharmacol, 43; 139-146, 2021![]()
23) Naitou, K., Nakamori, H., Shiina, T., et al.: Stimulation of dopamine D2-like receptors in the lumbosacral defaecation centre causes propulsive colorectal contractions in rats. J Physiol, 594 (15); 4339-4350, 2016![]()
24) Newell, J.: Treatment-resistant constipation and the need for chronic use of laxatives following lithium administration. Tijdschr Psychiatr, 60 (7); 481-484, 2018![]()
25) 日本神経精神薬理学会, 日本臨床精神神経薬理学会編: 統合失調症薬物治療ガイドライン2022 医学書院, 東京, 2022
26) 日本消化器病学会関連研究会慢性便秘の診断・治療研究会編: 慢性便秘症診療ガイドライン2017 南江堂, 東京, 2017
27) Oh, S. J., Fuller, G., Patel, D., et al.: Chronic constipation in the United States: results from a population-based survey assessing healthcare seeking and use of pharmacotherapy. Am J Gastroenterol, 115 (6); 895-905, 2020![]()
28) Oliva, V., Lippi, M., Paci, R., et al.: Gastrointestinal side effects associated with antidepressant treatments in patients with major depressive disorder: a systematic review and meta-analysis. Prog Neuropsychopharmacol Biol Psychiatry, 109; 110266, 2021![]()
29) Robinson, D., Woerner, M. G., Alvir, J. M., et al.: Predictors of relapse following response from a first episode of schizophrenia and schizoaffective disorder. Arch Gen Psychiatry, 56 (3); 241-247, 1999![]()
30) Rüsch, N., Müller, M., Lay, B., et al.: Emotional reactions to involuntary psychiatric hospitalization and stigma-related stress among people with mental illness. Eur Arch Psychiatry Clin Neurosci, 264 (1); 35-43, 2014![]()
31) 佐藤諒太郎, 山田浩樹, 石井弘毅ほか: 精神科外来における便秘症についての検討―多施設アンケート調査より―. 臨床精神薬理, 25 (5); 551-562, 2022
32) Shahid, M., Walker, G. B., Zorn, S. H., et al.: Asenapine: a novel psychopharmacologic agent with a unique human receptor signature. J Psychopharmacol, 23 (1); 65-73, 2009![]()
33) Sheehan, D. V., Nemeroff, C. B., Thase, M. E., et al.: Placebo-controlled inpatient comparison of venlafaxine and fluoxetine for the treatment of major depression with melancholic features. Int Clin Psychopharmacol, 24 (2); 61-86, 2009![]()
34) Shinfuku, M., Kishimoto, T., Uchida, H., et al.: Effectiveness and safety of long-term benzodiazepine use in anxiety disorders: a systematic review and meta-analysis. Int Clin Psychopharmacol, 34 (5); 211-221, 2019![]()
35) Suares, N. C., Ford, A. C.: Prevalence of, and risk factors for, chronic idiopathic constipation in the community: systematic review and meta-analysis. Am J Gastroenterol, 106 (9); 1582-1591, 2011![]()
36) Sumida, K., Molnar, M. Z., Potukuchi, P. K., et al.: Constipation and risk of death and cardiovascular events. Atherosclerosis, 281; 114-120, 2019![]()
37) Suttajit, S., Srisurapanont, M., Maneeton, N., et al.: Quetiapine for acute bipolar depression: a systematic review and meta-analysis. Drug Des Devel Ther, 8; 827-838, 2014![]()
38) 武田薬品工業株式会社: 医薬品インタビューフォーム. (https://www.takedamed.com/mcm/medicine/download.jsp?id=1230&type=INTERVIEW_FORM) (参照2022-11-13)
39) Takeuchi, H., Siu, C., Remington, G., et al.: Does relapse contribute to treatment resistance? Antipsychotic response in first-vs. second-episode schizophrenia. Neuropsychopharmacology, 44 (6); 1036-1042, 2019![]()
40) Talley, N. J., Jones, M., Nuyts, G., et al.: Risk factors of chronic constipation based on a general practical sample. Am J Gasteroenterol, 98 (5); 1107-1111, 2003![]()
41) Watanabe, N., Omori, I. M., Nakagawa, A., et al.: Safety reporting and adverse-event profile of mirtazapine described in randomized controlled trials in comparison with other classes of antidepressants in the acute-phase treatment of adults with depression: systematic review and meta-analysis. CNS Drugs, 24 (1); 35-53, 2010![]()
42) Wiersma, D., Nienhuis, F. J., Sloof, C. J., et al.: Natural course of schizophrenic disorders: a 15-year follow up of a Dutch incidence cohort. Schizophr Bull, 24 (1); 75-85, 1998![]()
43) 谷内一彦, 櫻井映子: 岡村信行ほか: 抗ヒスタミン薬の薬理学. 日本耳鼻咽喉科学会会報, 112 (3); 99-103, 2009