統合失調症患者では広汎な皮質領域における脳回過形成が報告されており,この所見は主として早期神経発達の偏倚を反映するものと考えられる.一方,統合失調症スペクトラムの一部をなすと考えられる統合失調型障害患者がどのような脳回形成の変化を示すかはわかっていない.本研究は統合失調症患者101例,統合失調型障害患者46例,および健常対照者77例において,大脳皮質の脳回形成を調べた.被験者のT1強調磁気共鳴画像を収集し,画像解析ソフトウェアFreeSurferを用いて全皮質領域の局所脳回指数(LGI)を群間で比較した.健常対照者と比較し,統合失調症患者と統合失調型障害患者は共通して両側前頭前野や左頭頂皮質においてLGI値の増大を示し,この所見は統合失調症への脆弱性を反映する可能性がある.また統合失調症患者は統合失調型障害患者と比べ,右前頭前野や左後頭皮質におけるLGI値が増加しており,この所見は精神病症状の顕在化に関連しているかもしれない.
2)筑波大学医学医療系臨床医学域精神医学
3)富山大学学術研究部医学系放射線診断・治療学講座
はじめに
統合失調型障害は症候学的および遺伝的に統合失調症スペクトラムの一部を形成していると考えられ,軽度なあるいは萌芽的な統合失調症様症状を有するも,明らかで持続的な精神病症状を呈さないことを特徴としている1)70).統合失調型障害患者は一般人口よりも統合失調症の発症率が高い12)一方で,その過半数は症状を呈しながらも長期間安定した状態を保つ43)ことから,統合失調型障害は統合失調症への脆弱性を有するが同時に顕在発症からは防御されている状態と考えられる.そのため,統合失調型障害患者における脳形態特徴は,統合失調症スペクトラムに共通して存在する脆弱性だけでなく,精神病症状の顕在化に対する防御因子をも反映している可能性がある.これまでの統合失調型障害患者を対象とした磁気共鳴画像(magnetic resonance imaging:MRI)の関心領域法による灰白質体積についての報告から,海馬,扁桃体,および上側頭回における灰白質体積減少60)63)は脆弱性を,前頭前野,帯状回,および島回の灰白質体積不変~増加60-62)は防御因子を反映すると考えられる.しかし,灰白質体積は加齢58),慢性化7),ストレス38),抗精神病薬67),大麻32)などの影響を受けるため,より固定的な生物学的指標を用いた検討が統合失調症スペクトラムの病態形成機序の解明に有用と考えられる.
脳回の形成過程は胎生第二期後半から第三期までにおおむね完了し,出生以降の脳溝脳回パターンは比較的変化が乏しいと報告される4)72).そのため,脳溝脳回パターンは早期神経発達の固定的な生物学的指標の候補と考えられる.また,脳回形成の偏倚は脳領野内や脳領野間の神経結合の変化に密接に関連することが報告されている9).慢性統合失調症患者における先行MRI研究は結果の不一致がみられるものの22)23)41)45)48)49)56)65)68),初回エピソード統合失調症患者では一般に広汎な皮質領域における脳回過形成が報告されている21)39)50)55)56).知的発達に遅れのある青年において,Structured Interview for Schizotypy28)のカットオフ値を超えた者は,カットオフ値以下の者と比べて右前頭前野の脳回指数の増加を示すことが報告されているが59),われわれが知る限り,統合失調型障害患者において脳溝脳回パターンを調べた先行報告はない.
そこで本研究では,局所脳回指数(local gyrification index:LGI)という指標を用いて,統合失調症患者,統合失調型障害患者,および健常対照者における脳回形成について比較した.LGIは全脳レベルで三次元的に脳溝脳回パターンを評価できる新たな指標であり,脳溝まで入り込んだ内側の脳表面積を,脳回の表面を覆う外側の脳表面積で割ることにより算出される.
I.研究の方法と結果
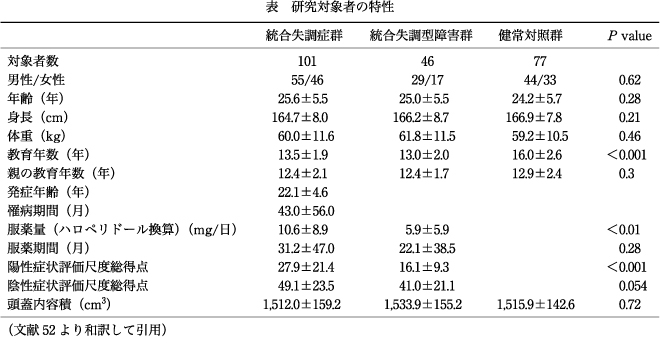
本研究の対象は,富山大学附属病院神経精神科を受診しICD-10の診断基準70)を満たす統合失調症患者101例,統合失調型障害患者46例,および健常対照者77例とした(表).統合失調症患者は,初回エピソード統合失調症患者64例および慢性統合失調症患者37例に下位分類した.初回エピソード患者は,発症から1年以内もしくは最初の精神科入院と定義した25).なお,本研究における統合失調型障害群は日常生活上の支障などにより病院を受診した群であり(clinic-based),多くは閾値下の精神病症状などに対して少量の抗精神病薬を含む薬物療法を要した.すなわち統合失調型障害患者のなかでも比較的重症な群を扱っていることには注意が必要である.一方,統合失調型障害群で2年間の臨床的観察中に統合失調症を顕在発症した患者はいなかった.臨床症状の評価には陽性症状評価尺度3)および陰性症状評価尺度2)を用いた.本研究はヘルシンキ宣言に基づき,富山大学倫理審査委員会の承認を得たうえで,すべての対象者に目的と方法を説明し,文書での同意を得て行われた.
1.5 TのT1強調磁気共鳴画像およびFreeSurfer software(ver. 5.3)14)を用い,Schaer, M.らの方法53)に基づき,全皮質領域のLGI値を計測した.LGI値の群間比較には,年齢,性別,服薬量,および服薬期間を共変量とした一般線型モデルを用いた.患者群におけるLGI値と臨床症状,抗精神病薬の使用との関連を調べるため,各群間比較で有意差を示した関心領域における平均のLGI値と各臨床指標を用いた偏相関解析を行った.
健常対照群と比較して,統合失調症群は両半球の内側前頭領域に顕著かつ広汎な皮質領域において有意なLGI値の増加を認め,統合失調型障害群は両側前頭の一部および左頭頂皮質において有意なLGI値の増加を認めた(図1).また,統合失調症群は統合失調型障害群と比べ,右前頭および左後頭領域において有意なLGI値の増加を認めた(図1).
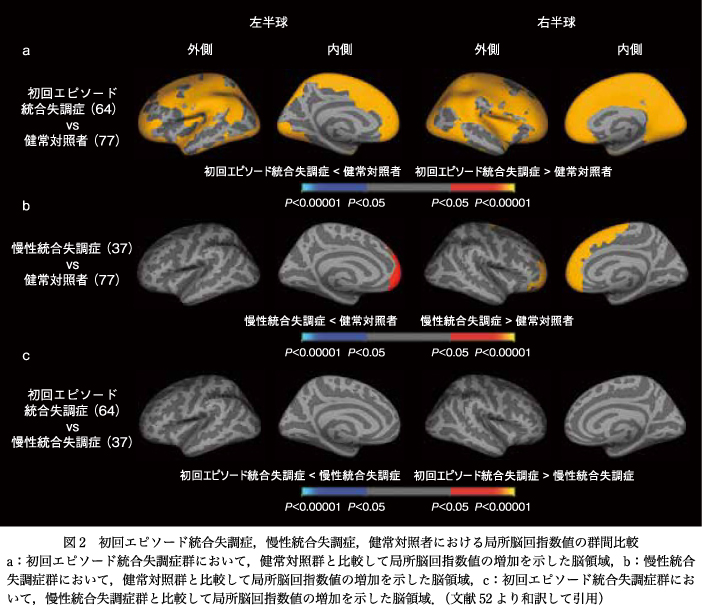
初回エピソード統合失調症群と慢性統合失調症群の直接比較では有意差を認めなかったものの,健常対照群と比較した場合,初回エピソード統合失調症群は両半球の前頭―側頭―頭頂―後頭領域を含む広汎な皮質領域でLGI値の増加を認めた一方で,慢性統合失調症群は両側前頭領域においてのみLGI値の増加を認めた(図2).
統合失調症群と統合失調型障害群において,LGI値と各臨床指標(発症年齢,罹病期間,陽性および陰性症状評価尺度,服薬量,および服薬期間)との間には,有意な相関は認めなかった.
II.考察
われわれはLGIという指標を用い,初めて統合失調型障害患者において全脳の脳回形成を調べ,健常対照者および統合失調症患者と比較した.両患者群は両側前頭前野と左頭頂皮質を含む皮質領域におけるLGI値の増加を示し,これらの領域における出生前から周産期の神経発達障害が統合失調症スペクトラムに共通した脆弱性を形成することを示唆している.他方,統合失調型障害群と比べた際の,統合失調症群における右前頭前野および左後頭領域におけるLGI値の増加は,精神病症状の顕在化と関連しているかもしれない.
本研究では統合失調症群において広汎な皮質領域における脳回過形成が示唆され,特に初回エピソード群で顕著であった.この結果は病初期の統合失調症群における先行研究21)39)50)55)56)65)66)68)の結果と同様であった.脳回形成と機能的45)もしくは白質11)54)57)の神経結合との関連を示したマルチモーダルな脳画像研究および胎生期に前頭葉切除を行ったサルを用いた動物実験18)の結果などから,本研究で示唆された統合失調症群における広汎な皮質領域における脳回過形成によって広範囲の神経結合の低下13)15)が生じているかもしれない.また病期が所見に影響したことから,LGIは慢性化や抗精神病薬の影響を受けうることが示唆される.
今回,統合失調型障害患者においては両側前頭および左頭頂領域の脳回過形成が示唆された.この所見は統合失調症群と一部共通の変化であった.過去の研究では,schizotypyの特徴を有する知的発達に遅れのある青年における前頭領域の脳回過形成59)や,統合失調型障害患者における眼窩前頭皮質の脳溝脳回パターンの変化42)64)および前頭―頭頂領域の灰白質体積減少5)60)71)が報告されている.また,統合失調型障害患者の前頭葉の神経結合の低下は認知機能障害などの臨床特性に関与することも示唆されている24)29)37)69).統合失調型障害患者は内側・外側側頭領域における灰白質体積減少を示す10)23)27)60)63)一方で,本研究では同領域のLGI値に有意な変化はなく,脳回形成と灰白質体積の変化は異なった空間分布を示すのかもしれない44).今後は両者の関連や脳形態変化の機能的意義についてさらに検討する必要がある.
統合失調症と統合失調型障害を比較した際の右前頭および左後頭領域における脳回形成の程度の差異は,精神病症状の顕在化に関連するとともに,顕在発症を防御する脳機能についての手がかりとなるかもしれない.統合失調症では前頭領域の灰白質体積減少を示す23)27)60)ことが繰り返し報告されている.精神病性障害の高リスク群においては,右前頭20)および左後頭51)領域の脳回過形成がのちの精神病性障害への移行と関連することが示唆されている.統合失調症において前頭前野の機能不全が線条体の過剰なドパミン伝達を誘発するとの報告6)34)を踏まえると,前頭前野による他の脳領域への抑制的調節の減退17)33)は精神病症状を顕在化させるかもしれない.統合失調症における後頭皮質の役割は十分に知られていないが,この脳領域は幻覚16)や社会認知26)36)47)などの統合失調症の主要な臨床特徴に関与しているようである.
本研究は,統合失調症および統合失調型障害群の一部が抗精神病薬を内服していたこと,横断研究であるためにLGI値の縦断変化を考慮できていないことなどが限界点である.そのため,今後は統合失調症スペクトラム群のさまざまな病期および健常群において縦断的な解析を行い,脳溝や脳回の形態学的特徴の経時的安定性について検証することが必要である.
おわりに
脳回形成の評価は統合失調症における広汎な神経結合の障害を捉えるうえで有用であり,精神疾患研究ではLGIの測定が一般的となりつつあるが,この指標は局所変化の評価にとどまる.脳領野間の関係性の障害を調べることで神経回路のより詳細な知見が得られるため46),グラフ理論を応用した脳回形成のコネクトーム解析なども行われている8).また双極性障害40),大うつ病性障害19),および自閉スペクトラム障害30)などの他の精神疾患においても脳回形成の偏倚が報告されているが,疾患共通性や疾患特異性についてはほとんどわかっていない.そのため疾患横断的アプローチを用い35),脳回形成の偏倚と臨床表現型との関連について包括的知見の蓄積が求められる.
本論文はPCN誌に掲載された最新の研究論文52)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 4th ed, Text Revision (DSM-IV-TR). American Psychiatric Association, Washington, D. C., 2000 (髙橋三郎, 大野 裕, 染矢俊幸訳: DSM-IV-TR精神疾患の診断・統計マニュアル. 医学書院, 東京, 2002)
2) Andreasen, N. C.: The Scale for the Assessment of Negative Symptoms (SANS). University of Iowa Press, Iowa, 1983
3) Andreasen, N. C.: The Scale for the Assessment of Positive Symptoms (SAPS). University of Iowa, Iowa, 1984
4) Armstrong, E., Schleicher, A., Omran, H., et al.: The ontogeny of human gyrification. Cereb Cortex, 5 (1); 56-63, 1995![]()
5) Asami, T., Whitford, T. J., Bouix, S., et al.: Globally and locally reduced MRI gray matter volumes in neuroleptic-naive men with schizotypal personality disorder: association with negative symptoms. JAMA Psychiatry, 70 (4); 361-372, 2013![]()
6) Bertolino, A., Breier, A., Callicott, J. H., et al.: The relationship between dorsolateral prefrontal neuronal N-acetylaspartate and evoked release of striatal dopamine in schizophrenia. Neuropsychopharmacology, 22 (2); 125-132, 2000![]()
7) Cannon, T. D., Chung, Y., He, G., et al.: Progressive reduction in cortical thickness as psychosis develops: a multisite longitudinal neuroimaging study of youth at elevated clinical risk. Biol Psychiatry, 77 (2); 147-157, 2015![]()
8) Das, T., Borgwardt, S., Hauke, D. J., et al.: Disorganized gyrification network properties during the transition to psychosis. JAMA Psychiatry, 75 (6); 613-622, 2018![]()
9) Dauvermann, M. R., Mukherjee, P., Moorhead, W. T., et al.: Relationship between gyrification and functional connectivity of the prefrontal cortex in subjects at high genetic risk of schizophrenia. Curr Pharm Des, 18 (4); 434-442, 2012![]()
10) Downhill, J. E. Jr., Buchsbaum, M. S., Hazlett, E. A., et al.: Temporal lobe volume determined by magnetic resonance imaging in schizotypal personality disorder and schizophrenia. Schizophr Res, 48 (2-3); 187-199, 2001![]()
11) Ecker, C., Andrews, D., Dell'Acqua, F., et al.: Relationship between cortical gyrification, white matter connectivity, and autism spectrum disorder. Cereb Cortex, 26 (7); 3297-3309, 2016![]()
12) Fenton, W. S., McGlashan, T. H.: Risk of schizophrenia in character disordered patients. Am J Psychiatry, 146 (10); 1280-1284, 1989![]()
13) Fitzsimmons, J., Kubicki, M., Shenton, M. E.: Review of functional and anatomical brain connectivity findings in schizophrenia. Curr Opin Psychiatry, 26 (2); 172-187, 2013![]()
14) FreeSurfer. (https://surfer.nmr.mgh.harvard.edu) (参照2019-09-24)
15) Friston, K. J.: Schizophrenia and the disconnection hypothesis. Acta Psychiatr Scand Suppl, 395; 68-79, 1999![]()
16) Fujimoto, T., Okumura, E., Takeuchi, K., et al.: Dysfunctional cortical connectivity during the auditory oddball task in patients with schizophrenia. Open Neuroimag J, 7; 15-26, 2013![]()
17) Fuster, J. M.: The Prefrontal Cortex:Anatomy, Physiology, and Neuropsychology of the Frontal Lobe, 3rd ed. Lippincott-Raven, Philadelphia, 1997
18) Goldman-Rakic, P. S.: Morphological consequences of prenatal injury to the primate brain. Prog Brain Res, 53; 1-19, 1980![]()
19) Han, K. M., Won, E., Kang, J., et al.: Local gyrification index in patients with major depressive disorder and its association with tryptophan hydroxylase-2 (TPH2) polymorphism. Hum Brain Mapp, 38 (3); 1299-1310, 2017![]()
20) Harris, J. M., Whalley, H., Yates, S., et al.: Abnormal cortical folding in high-risk individuals: a predictor of the development of schizophrenia? Biol Psychiatry, 56 (3); 182-189, 2004![]()
21) Harris, J. M., Yates, S., Miller, P., et al.: Gyrification in first-episode schizophrenia: a morphometric study. Biol Psychiatry, 55 (2); 141-147, 2004![]()
22) Haukvik, U. K., Schaer, M., Nesvåg, R., et al.: Cortical folding in Broca's area relates to obstetric complications in schizophrenia patients and healthy controls. Psychol Med, 42 (6); 1329-1337, 2012![]()
23) Hazlett, E. A., Buchsbaum, M. S., Haznedar, M. M., et al.: Cortical gray and white matter volume in unmedicated schizotypal and schizophrenia patients. Schizophr Res, 101 (1-3); 111-123, 2008![]()
24) Hazlett, E. A., Collazo, T., Zelmanova, Y., et al.: Anterior limb of the internal capsule in schizotypal personality disorder: fiber-tract counting, volume, and anisotropy. Schizophr Res, 141 (2-3); 119-127, 2012![]()
25) Hirayasu, Y., McCarley, R. W., Salisbury, D. F., et al.: Planum temporale and Heschl gyrus volume reduction in schizophrenia: a magnetic resonance imaging study of first-episode patients. Arch Gen Psychiatry, 57 (7); 692-699, 2000![]()
26) Javitt, D. C.: When doors of perception close: bottom-up models of disrupted cognition in schizophrenia. Annu Rev Clin Psychol, 5; 249-275, 2009![]()
27) Kawasaki, Y., Suzuki, M., Nohara, S., et al.: Structural brain differences in patients with schizophrenia and schizotypal disorder demonstrated by voxel-based morphometry. Eur Arch Psychiatry Clin Neurosci, 254 (6); 406-414, 2004![]()
28) Kendler, K. S., Lieberman, J. A., Walsh, D.: The Structured Interview for Schizotypy(SIS): a preliminary report. Schizophr Bull, 15 (4); 559-571, 1989![]()
29) Koenigsberg, H. W., Buchsbaum, M. S., Buchsbaum, B. R., et al.: Functional MRI of visuospatial working memory in schizotypal personality disorder: a region-of-interest analysis. Psychol Med, 35 (7); 1019-1030, 2005![]()
30) Kohli, J. S., Kinnear, M. K., Fong, C. H., et al.: Local cortical gyrification is increased in children with autism spectrum disorders, but decreases rapidly in adolescents. Cereb Cortex, 29 (6); 2412-2423, 2019![]()
31) Kulynych, J. J., Luevano, L. F., Jones, D. W., et al.: Cortical abnormality in schizophrenia: an in vivo application of the gyrification index. Biol Psychiatry, 41 (10); 995-999, 1997![]()
32) Lorenzetti, V., Solowij, N., Yücel, M.: The role of cannabinoids in neuroanatomic alterations in cannabis users. Biol Psychiatry, 79 (7); e17-31, 2016![]()
33) Mesulam, M. M.: Behavioral neuroanatomy: large-scale networks, association cortex, frontal syndromes, the limbic system, and hemispheric specializations. Principles of Behavioral and Cognitive Neurology, 2nd ed (ed by Mesulam, M. M.). Oxford University Press, New York, p.1-120, 2000
34) Meyer-Lindenberg, A., Miletich, R. S., Kohn, P. D., et al.: Reduced prefrontal activity predicts exaggerated striatal dopaminergic function in schizophrenia. Nat Neuro-sci, 5 (3); 267-271, 2002![]()
35) Mitelman, S. A.: Transdiagnostic neuroimaging in psychiatry: a review. Psychiatry Res, 277 (7); 23-38, 2019![]()
36) Miyata, J., Yamada, M., Namiki, C., et al.: Reduced white matter integrity as a neural correlate of social cognition deficits in schizophrenia. Schizophr Res, 119 (1-3); 232-239, 2010![]()
37) Nakamura, M., McCarley, R. W., Kubicki, M., et al.: Fronto-temporal disconnectivity in schizotypal personality disorder: a diffusion tensor imaging study. Biol Psychiatry, 58 (6); 468-478, 2005![]()
38) Narita, K., Fujihara, K., Takei, Y., et al.: Associations among parenting experiences during childhood and adolescence, hypothalamus-pituitary-adrenal axis hypoactivity, and hippocampal gray matter volume reduction in young adults. Hum Brain Mapp, 33 (9); 2211-2223, 2012![]()
39) Narr, K. L., Bilder, R. M., Kim, S., et al.: Abnormal gyral complexity in first-episode schizophrenia. Biol Psychiatry, 55 (8); 859-867, 2004![]()
40) Nenadic, I., Maitra, R., Dietzek, M., et al.: Prefrontal gyrification in psychotic bipolar I disorder vs. schizophrenia. J Affect Disord, 185; 104-107, 2015![]()
41) Nesvåg, R., Schaer, M., Haukvik, U. K., et al.: Reduced brain cortical folding in schizophrenia revealed in two independent samples. Schizophr Res, 152 (2-3); 333-338, 2014![]()
42) Nishikawa, Y., Takahashi, T., Takayanagi, Y., et al.: Orbitofrontal sulcogyral pattern and olfactory sulcus depth in the schizophrenia spectrum. Eur Arch Psychiatry Clin Neurosci, 266 (1); 15-23, 2016![]()
43) Nordentoft, M., Thorup, A., Petersen, L., et al.: Transition rates from schizotypal disorder to psychotic disorder for first-contact patients included in the OPUS trial. A randomized clinical trial of integrated treatment and standard treatment. Schizophr Res, 83 (1); 29-40, 2006![]()
44) Palaniyappan, L., Liddle, P. F.: Differential effects of surface area, gyrification and cortical thickness on voxel based morphometric deficits in schizophrenia. Neuroimage, 60 (1); 693-699, 2012![]()
45) Palaniyappan, L., Liddle, P. F.: Diagnostic discontinuity in psychosis: a combined study of cortical gyrification and functional connectivity. Schizophr Bull, 40 (3); 675-684, 2014![]()
46) Palaniyappan, L., Marques, T. R., Taylor, H., et al.: Globally efficient brain organization and treatment response in psychosis: a connectomic study of gyrification. Schizophr Bull, 42 (6); 1446-1456, 2016![]()
47) Rassovsky, Y., Horan, W. P., Lee, J., et al.: Pathways between early visual processing and functional outcome in schizophrenia. Psychol Med, 41 (3); 487-497, 2011![]()
48) Ronan, L., Voets, N. L., Hough, M., et al.: Consistency and interpretation of changes in millimeter-scale cortical intrinsic curvature across three independent datasets in schizophrenia. Neuroimage, 63 (1); 611-621, 2012![]()
49) Sallet, P. C., Elkis, H., Alves, T. M., et al.: Reduced cortical folding in schizophrenia: an MRI morphometric study. Am J Psychiatry, 160 (9); 1606-1613, 2003![]()
50) Sasabayashi, D., Takayanagi, Y., Nishiyama, S., et al.: Increased frontal gyrification negatively correlates with executive function in patients with first-episode schizophrenia. Cereb Cortex, 27 (4); 2686-2694, 2017![]()
51) Sasabayashi, D., Takayanagi, Y., Takahashi, T., et al.: Increased occipital gyrification and development of psychotic disorders in individuals with an at-risk mental state: a multicenter study. Biol Psychiatry, 82 (10); 737-745, 2017![]()
52) Sasabayashi, D., Takayanagi, Y., Takahashi, T., et al.: Increased brain gyrification in the schizophrenia spectrum. Psychiatry Clin Neurosci, 74 (1); 70-76, 2020![]()
53) Schaer, M., Cuadra, M. B., Tamarit, L., et al.: A surface-based approach to quantify local cortical gyrification. IEEE Trans Med Imaging, 27 (2); 161-170, 2008![]()
54) Schaer, M., Ottet, M. C., Scariati, E., et al.: Decreased frontal gyrification correlates with altered connectivity in children with autism. Front Hum Neurosci, 7; 750, 2013![]()
55) Schultz, C. C., Koch, K., Wagner, G., et al.: Increased parahippocampal and lingual gyrification in first-episode schizophrenia. Schizophr Res, 123 (2-3); 137-144, 2010![]()
56) Schultz, C. C., Wagner, G., Koch, K., et al.: The visual cortex in schizophrenia:alterations of gyrification rather than cortical thickness: a combined cortical shape analysis. Brain Struct Funct, 218 (1); 51-58, 2013![]()
57) Schultz, C. C., Wagner, G., Schachtzabel, C., et al.: Increased white matter radial diffusivity is associated with prefrontal cortical folding deficits in schizophrenia. Psychiatry Res Neuroimaging, 261; 91-95, 2017![]()
58) Sowell, E. R., Peterson, B. S., Thompson, P. M., et al.: Mapping cortical change across the human life span. Nat Neurosci, 6 (3); 309-315, 2003![]()
59) Stanfield, A. C., Moorhead, T. W. J., Harris, J. M., et al.: Increased right prefrontal cortical folding in adolescents at risk of schizophrenia for cognitive reasons. Biol Psychiatry, 63 (1); 80-85, 2008![]()
60) Suzuki, M., Zhou, S. Y., Takahashi, T., et al.: Differential contributions of prefrontal and temporolimbic pathology to mechanisms of psychosis. Brain, 128 (Pt 9); 2109-2122, 2005![]()
61) Takahashi, T., Suzuki, M., Zhou, S. Y., et al.: Lack of normal gender differences of the perigenual cingulate gyrus in schizophrenia spectrum disorders. A magnetic resonance imaging study. Eur Arch Psychiatry Clin Neuro-sci, 254 (5); 273-280, 2004![]()
62) Takahashi, T., Suzuki, M., Zhou, S. Y., et al.: Volumetric MRI study of the short and long insular cortices in schizophrenia spectrum disorders. Psychiatry Res, 138 (3); 209-220, 2005![]()
63) Takahashi, T., Suzuki, M., Zhou, S. Y., et al.: Morphologic alterations of the parcellated superior temporal gyrus in schizophrenia spectrum. Schizophr Res, 83 (2-3); 131-143, 2006![]()
64) Takahashi, T., Nakamura, M., Nishikawa, Y., et al.: Decreased number of orbital sulci in schizophrenia spectrum disorders. Psychiatry Res Neuroimaging, 250; 29-32, 2016![]()
65) Takayanagi, Y., Sasabayashi, D., Takahashi, T., et al.: Altered brain gyrification in deficit and non-deficit schizophrenia. Psychol Med, 49 (4); 573-580, 2019![]()
66) Tepest, R., Schwarzbach, C. J., Krug, B., et al.: Morphometry of structural disconnectivity indicators in subjects at risk and in age-matched patients with schizophrenia. Eur Arch Psychiatry Clin Neurosci, 263 (1); 15-24, 2013![]()
67) Vita, A., De Peri, L., Deste, G., et al.: The effect of antipsychotic treatment on cortical gray matter changes in schizophrenia: does the class matter? A meta-analysis and meta-regression of longitudinal magnetic resonance imaging studies. Biol Psychiatry, 78 (6); 403-412, 2015![]()
68) Vogeley, K., Schneider-Axmann, T., Pfeiffer, U., et al.: Disturbed gyrification of the prefrontal region in male schizophrenic patients: a morphometric postmortem study. Am J Psychiatry, 157 (1); 34-39, 2000![]()
69) Vu, M. A. T., Thermenos, H. W., Terry, D. P., et al.: Working memory in schizotypal personality disorder: fMRI activation and deactivation differences. Schizophr Res, 151 (1-3); 113-123, 2013![]()
70) World Health Organization: The ICD-10 Classification of Mental and Behavioural Disorders: Diagnostic Criteria for Research. World Health Organization, Geneva, 1993 (中根允文, 岡崎祐士, 藤原妙子ほか訳: ICD-10精神および行動の障害: DCR研究用診断基準. 医学書院, 東京, 2008)
71) Zhou, S. Y., Suzuki, M., Takahashi, T., et al.: Parietal lobe volume deficits in schizophrenia spectrum disorders. Schizophr Res, 89 (1-3); 35-48, 2007![]()
72) Zilles, K., Palomero-Gallagher, N., Amunts, K.: Development of cortical folding during evolution and ontogeny. Trends Neurosci, 36 (5); 275-284, 2013![]()