アルツハイマー病(AD)の根治療法のターゲットは,軽度認知障害(MCI)からさらにその前の前臨床ADにシフトしつつある.前臨床ADでは,特にその早期段階では,通常の臨床場面で用いられる頭部MRIや脳血流SPECTあるいは神経心理学的検査など通常の検査では異常が認められないものの,アミロイドPETでは陽性となる.また,臨床症状が顕在化するまでには15~20年を要することが知られている.現在,世界的に前臨床ADにおける認知症発症予防の臨床試験が行われているが,根治療法がいまだ開発されていないなかで,研究に参加した前臨床ADの人に対して発症前診断の告知を行うべきかどうかについての議論には決着がついていない.それにもかかわらず,研究のみならず臨床の場でも前臨床ADの人に対してアミロイドPETの結果をすでに告知している施設が国内外にあると考えられ,その倫理的な是非についてスタンダードを確立することに一刻の猶予も許されない.生命倫理の観点に立つならば,これまでは患者に苦痛や苦悩を与えないとする「無害の原則」に傾いていたが,最近は真実を語り自己決定を尊重する「自律の原則」とのバランスを考慮し,告知による利益を含めて判断することが重視される流れにある.われわれの研究では,もの忘れを訴えてメモリー外来を受診したものの,客観的な認知機能検査では記憶障害を認めない「主観的認知障害」の人を対象にアミロイドPETを実施し,希望に応じて結果を告知した.告知後24週まで不安や抑うつに明らかな継時的変化はみられず,少なくとも中期的には無害の原則が明らかに損なわれるとは言い難かった.自らのAD発症リスクの告知を望む声は強く,実際に告知を受けて今後の人生への備えができたという利益を挙げる報告もある.たしかに,告知にあたる医療者は,診断技術の不確かさという限界は忘れてはならない.しかし,リスクコミュニケーションのスキルを向上させ,告知内容をできるかぎり理解してもらえる方法を開発することも重要である.
2)慶應義塾大学医学部精神・神経科学教室
はじめに
“The problem, as I see it, is that you've been told and not told. You've been told, but none of you really understand, and I dare say, some people are quite happy to leave it that way. But I'm not. If you're going to have decent lives, then you've got to know and know properly.”
―Kazuo Ishiguro10)
アルツハイマー病(Alzheimer's disease:AD)の診断は大きな転換期を迎えている.ADの2つの主要な神経病理学的特徴の1つである老人斑はアミロイドβ(amyloid β:Aβ)蛋白質で構成されるが,このAβと特異的に結合する優れたリガンドであるピッツバーグ化合物B(Pittsburg compound B:PiB)などの登場により,剖検を待たずしてAβの画像所見が得られるようになってきている.
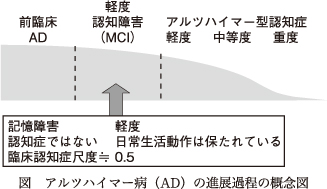
臨床的な認知症症状がまったくみられないもののアミロイドPETで陽性となる者(Aβ+健常者)は,陰性となる者(Aβ-健常者)と比較して,記憶などの認知機能においてより低下が認められることが長期的な追跡により明らかとなってきている14).Aβの蓄積は認知症へと至る最上流に位置づけられ,神経原線維変化,炎症,シナプス障害へと進んでいくと考えられている.こうした段階的な連なり,すなわちカスケードは十数年かけて生じ,臨床症状が顕在化するまでには15~20年の時間を要することが知られている29).PET検査ではアミロイドが陽性であるがもの忘れすらない「健常」段階は「前臨床AD」と呼ばれている27)(図).
ADの治療ターゲットは軽度認知障害(mild cognitive impairment:MCI)よりさらに前に位置するこの前臨床期にシフトしつつある1).現在,前臨床ADの認知症発症予防の臨床治験が世界的に行われているが,根本的な治療法の開発がいまだ確立していないなかで,研究に参加した前臨床ADの人あるいは健常者に対して発症前診断の告知を行うべきかどうかについての議論には決着がついていない.それにもかかわらず,研究のみならず臨床の場でも前臨床ADの人に対してアミロイドPETの結果を告知している施設が国内外にあると考えられるため,その倫理的な是非についてスタンダードを確立することは一刻の猶予も許されない状況である.以下では,アミロイドPETという最新の医学技術に関して生ずる,新しくも古典的な倫理的ジレンマについて検討する.
I.臨床研究における“no return policy”の転換
研究被験者へのアミロイドPETの結果告知に関する議論を整理するためには,倫理原則に立ち返ることが有用である.一般に生命倫理では,自律(respect for autonomy),無害(non―maleficence),善行(beneficence),正義(justice)の4原則が謳われる.本稿にあてはめるならば,自律(真実を語り自己決定を尊重する)はアミロイドPETの結果を告知すること,無害(苦痛や苦悩を与えない)は告知により心理的な悪影響を与えないことを意味する(表).
そもそも一般に,臨床研究に参加した被験者に対して研究で明らかになった被験者の情報を伝えるかどうかは,各々の研究に一任されている.遺伝性疾患に関する研究においては,最近まで,研究で得られた被験者のバイオマーカー情報を告知しない“no return policy”がとられていた.これは生命倫理の「無害の原則」に基づき,被験者を保護することが目的であった.
アミロイドPETに関しても,診断技術としての正確さは検証の最中にあったため,その使用が研究においてのみ限定されていた長い間は,被験者への結果告知は原則的に行われてこなかった.これは被験者の認知機能に異常が認められても認められなくても同様であった.この原則は2004年から米国で開始されたAlzheimer's Disease Neuro-imaging Initiative(ADNI)でも踏襲されて,臨床的妥当性や有用性といった厳格な基準に基づいて研究と治療とを区別したガイドラインを反映するものであった4).
ところが2012年,米国食品医薬品局(Food and Drug Administration:FDA)がアミロイド蓄積の画像化に用いられる放射性標識化合物florbetapirを承認したことにより,アミロイドPETという研究用の技術が臨床へも応用されるようになり,被験者への結果告知に関する議論が活発化する契機となった.時を同じくして,前述の大規模臨床研究ADNIにおいて,76%以上の被験者から結果開示の希望を受けたスタッフが23~25%にものぼったため,告知をしない原則の見直しにもつながった.ADNI研究スタッフ(そのうち精神科または神経内科の医師の割合は62%)を対象とした調査では,回答のあった159名において,FDAによりflorbetapirが承認された場合という条件のもと,過半数以上の53%が健常者への告知を支持したとの報告がなされた26).研究で判明した被験者に関する情報の開示を求める声が一般に強くなりつつある25)ことも背景に,この報告が紹介したコメントの1つでは,これまでの“no return policy”は告知による悪影響から被験者を保護することだけに焦点をあてすぎており,被験者が告知による利益,悪影響,許容可能な範囲のリスクなどを,どのような優先順や配分で受け入れるかを考慮に入れていなかったと指摘した24).
こうした流れも受け,2012年から始まった前臨床AD高齢者に対する抗Aβ薬の効果を検証する大規模治験Anti―Amyloid Treatment in Asymptomatic Alzheimer's Disease(A4研究)では,アミロイドPETで陽性であることが組み入れ基準の1つであることも加わり,PETの結果を被験者にインフォームド・コンセントの一環として告知することとなった.この頃行われた認知症を専門とする神経内科医に対する調査でも,24%の医師が,健常高齢者のスクリーニングとしてアミロイドPETを臨床で用いることを検討すると肯定的に回答した13).
II.前臨床ADの臨床診断としてアミロイドPET使用は推奨されない
たしかに,アミロイドPETで陽性であることは,臨床上重要な認知機能の低下が生じ,健常からMCIおよびADへとコンバートする将来的なリスクが高まることと関連する17).だが,これを検証した前向き研究の数はいまだ少なく,Aβ+が認知症を発症する相対リスクを正確に推定することは難しい.このような限界があるため,Amyloid Imaging Task Force(AIT)は,症状のない健常者に対するアミロイドPETの「臨床的」使用にそもそも反対している.なぜなら「アミロイドPETの結果を基にして,本人や家族が,リスクや転帰に関する不正確な前提を作り上げる可能性が十分に予想される.現在,最低限の利益を潜在的な危険性が上回っている」12)からである.日本核医学会・日本認知症学会・日本神経学会で構成するワーキンググループもこれに沿ったガイドラインを作成し同様の見解を示している19).
III.結果告知による危険,すなわち告知は心理的な害を与えるか
では「研究に参加する前臨床ADの人」に対する告知をめぐる議論はどうであろうか.臨床研究への参加に関心をもつ健常者を対象とした調査では,アミロイドPETの結果を知りたくないと答えた人の40%が挙げた理由が,抑うつ的になるからということだった20).
とはいえ,アミロイドPETの結果告知による心理的影響を実際に調べた研究は,世界でもわずか数本の報告しか存在しない3)15)30).このうち11名の健常者を対象としたケースシリーズ研究では,アミロイドPETの陽性あるいは陰性の結果を告知されても,気分や主観的な記憶の変化,将来ADを発症する主観的な予測に大きな影響はなく,陽性の人は陰性の人よりもライフスタイルにポジティブな変化(より多くの運動や健康的な食事など)が生じたと報告された15).また認知機能に異常が認められない人97名(Aβ+=27名)を対象とした研究でも,Aβ+とAβ-の両群とも告知後6ヵ月までに不安や抑うつに変化はなかったと報告された3).わが国でも,主観的な認知機能の低下11)を訴えるが,客観的には健常な「主観的認知機能低下」の人42名(Aβ+=10名)を対象とした研究が実施された.この群は不安傾向が高いとの報告があるが,結果告知による明らかな心理的な影響が短期的にはみられないことが世界で初めて実証的に示唆されている30).同様の結果は告知後24週までの追跡調査においても得られている31).こうした一連の結果は,ADの危険因子であるアポリポ蛋白質E(APOE)遺伝子に関するRisk Evaluation and Education for Alzheimer's Disease(REVEAL)研究と呼ばれるランダム化比較試験(RCT)において,ε4陽性結果も含めたAD発症リスク情報を伝えても抑うつや不安が高まることは稀で,生じたとしても告知後の一時的なものであるという報告に一致している6).
以上の結果を踏まえると,被験者に害を与えないという無害の原則が明らかに損なわれるとは言い難い状況であり,アミロイドPETの結果を知らせずにおくことは,とりわけそのデータが臨床研究の文脈で得られた場合は不当なパターナリズム(父権主義)につながるという主張も一定の説得力をもつことになる24).
IV.結果告知による利益とは何か
では反対に,告知によりどのような利益が考えられるのだろうか? まず被験者の「自己決定を尊重する」原則を強調する立場からは,自分の認知機能の健康度に関する情報を知ることは個人の権利7)であり,結果の告知によってtruth―telling(真実を語ること)の価値を支持することになると考えられる.
実際,将来のADリスクを知りたいと望む声は多い.例えば臨床研究への参加に関心をもつ米国の健常者を対象とした調査(n=164)では,81%がアミロイドPETの結果告知を希望している20).また,臨床試験に参加するにあたってアミロイドPET結果の告知が前提であると言われた健常者と,告知はされないと言われた健常者との間で参加への希望の差を調べたランダム化比較試験(n=132)においても,両群に有意な差はみられず,前臨床ADに関する試験への組み入れにとって告知は妨げの要因とはならないという報告もある8).
アミロイドPETを含むバイオマーカーの結果を知ることを希望する他の理由として多く挙げられるのは,前もって今後の人生の準備を行えるというものである.これに関して,APOEの検査により発症リスクを知らされた健常者を対象とした研究では,今後の治療などについて患者や介護者と医療従事者があらかじめ話し合うプロセス(アドバンス・ケア・プランニング)のためになったとの回答があり,ADの治療法や研究をよく調べるようになったり,あるいは遺伝子検査で陰性であった場合は心理的な安心を得たりする様子が報告されている21).臨床試験に参加してアミロイドPETの結果告知を希望することのできたMCI患者(n=38,Aβ+=8名)を対象とした質的研究では,告知の利益として現実的な環境調整を始められることを挙げ,例えば今より小さな住まいに引っ越したり,今後の経済的な調整を行ったり,高齢者ケア施設を探すことなどが含まれていた28).
また現在,ADの危険因子と防御因子の解明のため,多くの研究が盛んに実施されており,それには薬物療法のみならず健康的な生活を送るといった予防的選択肢も含まれている2).このため,アミロイドPETの結果を知ることは自らの将来の健康に対して意思決定を行う際の重要な情報となりうるとも考えられる.しかしながら,これらの点については,それぞれの国の国民性や考え方などが影響すると考えられ,わが国でも研究参加者へのアミロイドPETの結果告知に関する指針をさらに模索していく必要があろう.
V.いかにして伝えるか
以上のようなアミロイドPETの結果告知に伴う危険性と利益のほかに,忘れてはならない重要な論点が3つある.それは,①アミロイドPETが診断技術として確立されてはいないこと,②PETの結果を告知するスキルが十分に用いられていないこと,そして③告知された側はどれくらい理解しているか,という点である.
第一に,いかにして伝えるかを左右するのは,PETの診断技術としての正確さである.FDAは,アミロイドPETの結果を読影するにあたって必ず陽性か陰性かの二分法にしなくてはならないと定めている.しかし,PIB-PETであっても,陽性と陰性の中間の曖昧な結果は全体の20%にものぼることが明らかになっている16).そのため,PETの結果を白か黒かという形に押し込むことは正確さにおいて十分でないかもしれない.
また,アミロイドPETの結果を前臨床ADの人に告知する際には,AD発症リスクの予測を量的な情報として提供することができるのが最大の利点である.しかし,すでに述べたように,健常者を追跡した長期的な前向きPET研究の数は非常に限られている.最も大きい研究の1つでは,アミロイドPETで陽性であった健常者は,ハザード比4.85で臨床的に有意な認知機能の低下が認められたと報告された17).だが,これはあくまで150名中23名の長期的な傾向に基づいた予測であり,わずか9名しかADと診断されていない.信頼できる量的な予測を提供するためには,より多くのデータが必要である.
第二に,たとえ量的な予測が可能であったとしても,リスクコミュニケーションのスキルを十分にもたない医療者にとって,その情報を効果的に伝えるのは難しいかもしれない.このスキルに含まれるのは,相対リスクの概念を用いたり,聴覚的情報だけでなく視覚的情報(イラストなど)で補助したり,持ち帰って読むための資料を提供したりすることである23).米国の神経内科医や神経心理士など神経学の専門家に対して行った調査では,普段の臨床でMCIの診断を告知する際,上記のスキルはルーティンとして用いられていないということが明らかになっている22).
そして第三に,上記のような限界を踏まえた十分な説明を医療者が行ったとしても,必ずしも相手は専門家が望むように正確に理解したり,あるいは情報を覚えていてくれたりするわけではない.たしかに,50名のAβ+前臨床ADの人に対して行った調査で明らかになったように,62%の人は,「Aβの異常な蓄積は認めるもののADの発症リスクについては不確かである」ということを理解した18).しかし,この研究の被験者の学歴をみると60%が大学院修了レベルであり,最終学歴が高校卒業であった人は1名のみであった.
さらに,ADに関する研究に参加している健常高齢者に対してアミロイドPETの技術的な限界などを心理教育した群では,プラセボの心理教育をした群と比べ,心理教育の前後で有意に告知への関心が低下したという報告もある5).こうしたことから,わが国でもアミロイドPETの結果告知に際して,事前の心理教育を適切に行うためのプロセスの開発9)が早急に求められる.
おわりに
前臨床ADを含めて認知症発症リスクを有する人が自らの健康や病気について十分な説明を受け,理解し,将来を自己決定するために不可欠なshared decision making(患者と医療者による共同意思決定)を行う流れはもはや止めることはできない.「患者のためを思って伝えない」という考え方が成り立たなくなってきた経緯はわが国でもがん告知の歴史を考えてみればよくわかる.しかし,認知症の告知はがんより難しく,さらにMCIや前臨床ADではさらに複雑な要素を内包している.日本と欧米との相違も考えておく必要がある.前臨床ADの人に対して,わかっている所見をいかに,あるいはどこまで告げて自己決定のための情報としていくかという自律の原則と,傷つけることは避ける無害の原則との間に生じるジレンマを考えることは,今後の超高齢社会の1つの試金石であるといえる.
なお,本論文に関連して開示すべき利益相反はない.
1) Aisen, P. S., Vellas, B., Hampel, H.: Moving towards early clinical trials for amyloid-targeted therapy in Alzheimer's disease. Nat Rev Drug Discov, 12 (4); 324, 2013![]()
2) Barnes, D. E., Yaffe, K.: The projected effect of risk factor reduction on Alzheimer's disease prevalence. Lancet Neurol, 10 (9); 819-828, 2011![]()
3) Burns, J. M., Johnson, D. K., Liebmann, E. P., et al.: Safety of disclosing amyloid status in cognitively normal older adults. Alzheimers Dement, 13 (9); 1024-1030, 2017![]()
4) Fabsitz, R. R., McGuire, A., Sharp, R. R., et al., National Heart, Lung, and Blood Institute Working Group: Ethical and practical guidelines for reporting genetic research results to study participants: updated guidelines from a National Heart, Lung, and Blood Institute Working Group. Circ Cardiovasc Genet, 3 (6); 574-580, 2010![]()
5) Gooblar, J., Roe, C. M., Selsor, N. J., et al.: Attitudes of research participants and the general public regarding disclosure of Alzheimer disease research results. JAMA Neurol, 72 (12); 1484-1490, 2015![]()
6) Green, R. C., Roberts, J. S., Cupples, L. A., et al.: Disclosure of APOE genotype for risk of Alzheimer's disease. N Engl J Med, 361 (3); 245-254, 2009![]()
7) Grill, J. D., Johnson, D. K., Burns, J. M.: Should we disclose amyloid imaging results to cognitively normal individuals? Neurodegener Dis Manag, 3 (1); 43-51, 2013![]()
8) Grill, J. D., Zhou, Y., Elashoff, D., et al.: Disclosure of amyloid status is not a barrier to recruitment in preclinical Alzheimer's disease clinical trials. Neurobiol Aging, 39; 147-153, 2016![]()
9) Harkins, K., Sankar, P., Sperling, R., et al.: Development of a process to disclose amyloid imaging results to cognitively normal older adult research participants. Alzheimers Res Ther, 7 (1); 26, 2015![]()
10) Ishiguro, K.: Never Let Me Go. Vintage International, New York, p.81, 2005
11) Jessen, F., Amariglio, R. E., van Boxtel, M., et al.: A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer's disease. Alzheimers Dement, 10 (6); 844-852, 2014![]()
12) Johnson, K. A., Minoshima, S., Bohnen, N. I., et al.: Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer's Association. J Nucl Med, 54 (3); 476-490, 2013![]()
13) Klein, E. P., Kaye, J.: Dementia specialists and early adoption of amyloid imaging. J Alzheimers Dis, 33 (2); 445-450, 2013![]()
14) Landau, S. M., Mintun, M. A., Joshi, A. D., et al.: Amyloid deposition, hypometabolism, and longitudinal cognitive decline. Ann Neurol, 72 (4); 578-586, 2012![]()
15) Lim, Y. Y., Maruff, P., Getter, C., et al.: Disclosure of positron emission tomography amyloid imaging results: a preliminary study of safety and tolerability. Alzheimers Dement, 12 (4); 454-458, 2016![]()
16) Mormino, E. C., Brandel, M. G., Madison, C. M., et al.: Not quite PIB-positive, not quite PIB-negative: slight PIB elevations in elderly normal control subjects are biologically relevant. Neuroimage, 59 (2); 1152-1160, 2012![]()
17) Morris, J. C., Roe, C. M., Grant, E. A., et al.: Pittsburgh compound B imaging and prediction of progression from cognitive normality to symptomatic Alzheimer disease. Arch Neurol, 66 (12); 1469-1475, 2009![]()
18) Mozersky, J., Sankar, P., Harkins, K., et al.: Comprehension of an elevated amyloid positron emission tomography biomarker result by cognitively normal older adults. JAMA Neurol, 75 (1); 44-50, 2018![]()
19) 日本核医学会, 日本認知症学会, 日本神経学会編: アミロイドPETイメージング剤の適正使用ガイドライン改訂第2版. 2017 (http://jsnm.sakura.ne.jp/wp_jsnm/wp-content/themes/theme_jsnm/doc/amyloid_pet_imaging_gl_2.pdf)(参照2018-08-20)
20) Ott, B. R., Pelosi, M. A., Tremont, G., et al.: A survey of knowledge and views concerning genetic and amyloid PET status disclosure. Alzheimers Dement, 2 (1); 23-29, 2016![]()
21) Roberts, J. S., Cupples, L. A., Relkin, N. R., et al.: Genetic risk assessment for adult children of people with Alzheimer's disease: the Risk Evaluation and Education for Alzheimer's Disease (REVEAL) study. J Geriatr Psychiatry Neurol, 18 (4); 250-255, 2005![]()
22) Roberts, J. S., Karlawish, J. H., Uhlmann, W. R., et al.: Mild cognitive impairment in clinical care: a survey of American Academy of Neurology members. Neurology, 75 (5); 425-431, 2010![]()
23) Roberts, J. S., Dunn, L. B., Rabinovici, G. D.: Amyloid imaging, risk disclosure and Alzheimer's disease: ethical and practical issues. Neurodegener Dis Manag, 3 (3); 219-229, 2013![]()
24) Shalowitz, D. I., Miller, F. G.: Disclosing individual results of clinical research: implications of respect for participants. JAMA, 294; 737-740, 2005![]()
25) Shalowitz, D. I., Miller, F. G.: Communicating the results of clinical research to participants: attitudes, practices, and future directions. PLoS Med, 5; e91, 2008![]()
26) Shulman, M. B., Harkins, K., Green, R. C., et al.: Using AD biomarker research results for clinical care: a survey of ADNI investigators. Neurology, 81; 1114-1121, 2013![]()
27) Sperling, R. A., Aisen, P. S., Beckett, L. A., et al.: Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement, 7 (3); 280-292, 2011![]()
28) Vanderschaeghe, G., Schaeverbeke, J., Bruffaerts, R., et al.: Amnestic MCI patients' experiences after disclosure of their amyloid PET result in a research context. Alzheimers Res Ther, 9; 92, 2017![]()
29) Villemagne, V. L., Burnham, S., Bourgeat, P., et al.: Amyloid β deposition, neurodegeneration, and cognitive decline in sporadic Alzheimer's disease: a prospective cohort study. Lancet Neurol, 12 (4); 357-367, 2013![]()
30) Wake, T., Tabuchi, H., Funaki, K., et al.: The psychological impact of disclosing amyloid status to Japanese elderly: a preliminary study on asymptomatic patients with subjective cognitive decline. Int Psychogeriatr, 30 (5); 635-639, 2018![]()
31) Wake, T., Tabuchi, H., Funaki, K., et al.: The psychological impact of disclosing amyloid status to Japanese elderly with subjective cognitive decline. Taiwan-Japan Young Researcher Exchange Program Award. The 13th Annual Meeting of Taiwanese Society of Geriatric Psychiatry. March 11, 2018