統合失調症の診断は,医師による精神症状の主観的評価によって行われており,客観的補助診断法の開発が求められている.本研究では,統合失調症に特徴的な異常がみられ,健常者との判別に有用であると考えられる眼球運動検査と,認知機能検査から得られた指標を組み合わせることで,診断精度の向上がみられるか検討を行った.【方法】1,254名の健常者と336名の統合失調症患者を対象とし,眼球運動検査から得られた16指標と認知機能検査から得られた25指標(ウェクスラー成人知能検査の13検査項目の評価点,ウェクスラー記憶検査の12検査項目の粗点)のそれぞれについて,統合失調症患者と健常者の判別における各指標の判別性能をROC解析により調べた.また,眼球運動検査および認知機能検査の両方を行った被験者のうち,健常者252名,統合失調症患者73名をトレーニングセットとし,残りの健常者238名,統合失調症患者39名をテストセットとして用い,ロジスティック回帰を用いた多変量解析により眼球運動検査と認知機能検査の組み合わせの判別性能および汎化性能を評価した.さらに,眼球運動と認知機能のそれぞれから1指標ずつペアにした2指標を用いた場合の判別性能および汎化性能を評価した.【結果】ROC解析の結果から,眼球運動検査および認知機能検査の各指標が比較的高い判別能(AUC≥0.7)をもつ指標を含むことが示された.また,多変量解析の結果から,眼球運動と認知機能は統合失調症患者と健常者の鑑別に有効であることが確認された.さらに眼球運動と認知機能の指標のペアの判別分析から,単一指標を用いる場合よりも診断精度が向上することが示された.また,ウェクスラー成人知能検査の符号検査または記号探索のスコアと眼球運動のペアが高い識別能力をもつことが示された.【考察】本研究の結果から,眼球運動および認知機能の異常を示す指標を適切に選択することによって,健常者と統合失調症患者を高い精度で判別できることが示された.また,本結果は,これらの比較的簡便に行うことができる検査で,しかも短時間で実施できる少数の検査の結果からでも診断補助に有効な客観的マーカーを作成できる可能性を示唆している.
2)奈良県立医科大学精神医学講座
3)国立精神・神経医療研究センター・精神保健研究所精神疾患病態研究部
4)大阪大学大学院医学系研究科精神医学教室
5)地域医療機能推進機構大阪病院
6)医療法人フォスター
https://doi.org/10.57369/pnj.24-061
はじめに
統合失調症は,人口の約1%が罹患する精神疾患であり,陽性症状,陰性症状,そして認知機能障害を特徴とする1)29).思春期後半から若年成人にかけて好発し,生活の質や社会機能の低下など,長期間にわたり多大な影響を及ぼすことが知られている9)30).実臨床において,統合失調症の診断は医師による問診を主体としており,主観的な評価方法であるがゆえに診断の精度にばらつきが生じることがある8).このため,より客観的な診断基準や,医師の診断をサポートするデジタルヘルスツールの開発が求められている.
これまでに,統合失調症患者における眼球運動や認知機能の異常が数多く報告されている26)28).眼球運動に関しては,サッケードや追跡眼球運動,認知課題中の探索眼球運動,フリービューイング課題の際に健常者と異なる目の動き方がみられることが多い4)12)15)17)19)22)25)26)31).統合失調症にみられるこれらの眼球運動の異常を定量化することによって,統合失調症患者と健常者をおおむね80%以上の精度で判別できることが報告されている2)3)7)21)22).また,統合失調症における臨床所見の1つであるPraecox-Gefühlと眼球運動の関係が示唆されていることから,眼球運動検査は統合失調症の臨床診断の補助となりうると考えられる16).
一方,統合失調症の中核症状の1つである認知機能障害については,Brief Assessment of Cognition in Schizophrenia(BACS)やWechsler Adult Intelligence Scale 3rd ed(WAIS-III),Wechsler Memory Scale-Revised(WMS-R),Trail Making Test,Wisconsin Card Sorting Testなど,さまざまな検査において認知機能の異常が指摘されており,処理速度や遂行機能に関連した異常が報告されている5)6)10)11)21).さらに,これらの認知機能検査のいくつかの下位検査指標は,統合失調症患者と健常者間で大きい効果量を有することが報告されている14)21)23).
このように,眼球運動および認知機能においてみられる統合失調症の特徴を用いることで,統合失調症患者と健常者を比較的高い精度で判別できる可能性がある一方で,1つのモダリティによる診断は,そのモダリティによる特徴を有していない患者の診断を見逃す可能性も有している.したがって,本研究では,統合失調症に特徴的な異常がみられ,健常者との判別に有用であると考えられる眼球運動検査と認知機能検査から得られた指標を組み合わせることで,診断精度の向上がみられるか検討を行った.
I.研究の方法および結果
1.方 法
1)被験者
本研究は,大阪大学にて取得された健常者1,254名,統合失調症患者336名のデータを使用した.被験者に対しPositive and Negative Syndrome Scale(PANSS)18),Global Assessment of Functioning(GAF)尺度13),現在の知能指数(WAIS-III),病前推定知能指数(Japanese Adult Reading Test)20)を実施した.本データを,健常者と統合失調症の判別に有用な指標およびそれらを組み合わせた分類器の作成に用いたデータセット1〔健常者1,016名(平均年齢33.5±14.1歳,男性:女性511:505),統合失調症患者297名(平均年齢35.6歳±12.4歳,男性:女性151:146)〕および,データセット1で得られた分類器をテストするために用いるデータセット2〔健常者238名(平均年齢35.2歳±16.4歳,男性:女性125:113),統合失調症患者39名(平均年齢34.5歳±12.9歳,男性:女性19:20)〕に分けた.なお,データセット1に含まれる被験者は,7つの課題からなる眼球運動検査とWAIS-III・WMS-Rによる認知機能検査のいずれか,もしくは両検査が実施された.また,データセット2に含まれる被験者は,3つの課題からなる眼球運動検査とWAIS-III・WMS-Rによる認知機能検査のいずれか,もしくは両検査が実施された.
2)眼球運動検査
被験者はアゴ台に頭部を置き,視距離70 cmに置いた19 inch LCDモニターに向かって座り,眼球運動課題を行った.課題遂行中の被験者の左眼の眼球位置を1 kHzのサンプリングレートで測定した.データセット1に含まれた被験者はEyeLink1000(SR Research, Ontario, Canada),データセット2に含まれた被験者はEyeLink1000Plus(SR Research, Ontario, Canada)にて計測された.計測された眼球運動から抽出された指標のうちMorita, K.らの研究22)で統合失調症と健常者の間に有意な違いがみられた16指標(フリービューイング課題時のスキャンパス長,サッケード数,注視回数,注視密度,注視時間,サッケード振幅,平均サッケード速度,追跡眼球運動課題時の水平方向位置ゲイン,水平方向速度ゲイン,垂直方向位置ゲイン,垂直方向速度ゲイン,サッケード数,注視回数,注視時間,サッケードのピーク速度,注視課題時の注視時間)を後の解析に用いた.検査課題の制御および眼球運動指標の算出はMATLAB(The MathWorks, MA)を用いて行われた.
3)認知機能検査
認知機能の評価はWAIS-III24)ならびにWMS-R32)にて行われた.WAIS-IIIの下位検査から得られた13の評価点(知識,理解,算数,類似,単語,数唱,語音整列,絵画完成,符号,積木模様,行列推理,絵画配列,記号探し),WMS-Rの下位検査から得られる12の粗点(精神統制,図形の記憶,論理的記憶I,視覚性対連合I,言語性対連合I,視覚性再生I,数唱,視覚性記憶範囲,論理的記憶II,視覚性対連合II,言語性対連合II,視覚性再生II)を用いた.
4)データ解析
健常者と統合失調症患者の判別における眼球運動および認知機能の各指標の判別能を調べるためにROC(receiver operating characteristic)分析を行い,AUC(area under the curve)値を各指標について算出した.ROC解析にはIBM SPSS Statistics 28を使用した.また,眼球運動指標16指標,認知機能指標25指標を用いた判別分析にはL1およびL2正則化を用いた多変量ロジスティック回帰を用いた.眼球運動指標および認知機能指標を1指標ずつ用いた際の判別分析にはL2正則化を用いたロジスティック回帰を用いた.これらの判別分析にはPython3(scikit-learnライブラリ)が用いられた.
2.結 果
1)眼球運動指標,認知機能指標の性質
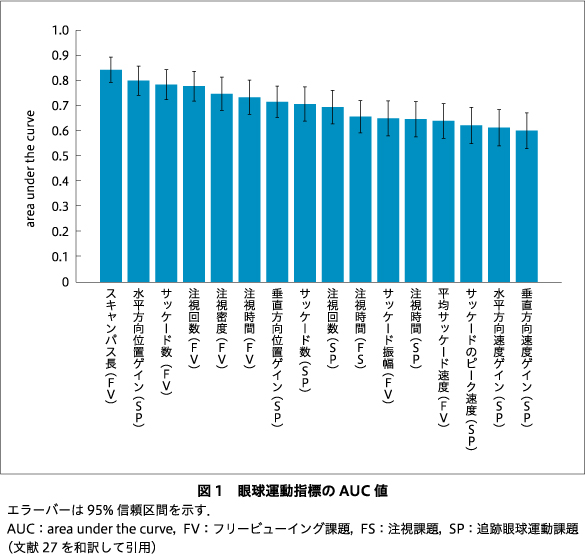
眼球運動検査と認知機能検査から得られる個々の指標の判別能の評価をROC解析により行った.データセット1のなかで眼球運動検査が実施された健常者255名(平均年齢28.7歳±11.5歳,男性:女性145:110),統合失調症患者82名(平均年齢35.1歳±12.4歳,男性:女性42:40)のデータを用い眼球運動検査から得られた16指標の判別能を調べた.眼球運動16指標のうちの8指標(フリービューイング時の注視時間,注視密度,注視回数,サッケード数,スキャンパス長,追跡眼球運動課題時の水平方向位置ゲイン,垂直方向位置ゲイン,サッケード数)のAUC値が特に高く,中程度の判別能とされる0.7以上であった(図1).
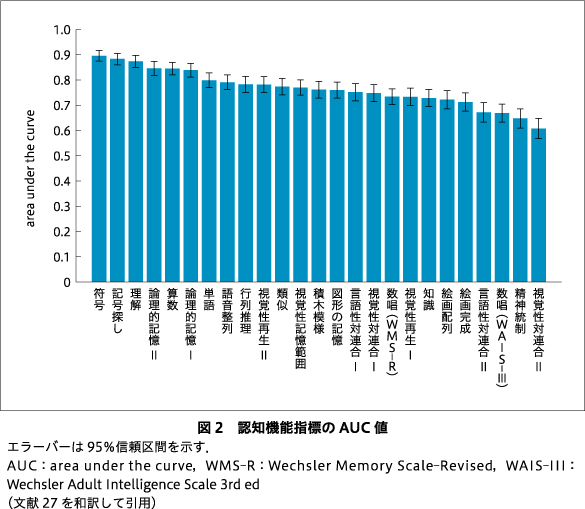
同様に,データセット1のなかでWAIS-IIIとWMS-Rが実施された健常者1,013名(平均年齢33.5歳±14.1歳,男性:女性510:503),統合失調症患者288名(平均年齢35.6歳±12.3歳,男性:女性149:139)のデータを用いて認知機能指標の判別能を調べた.認知機能25指標のうち21指標(WAIS-IIIの算数,積木模様,理解,符号,知識,語音整列,行列推理,絵画配列,絵画完成,類似,記号探し,単語,WMS-Rの数唱,図形の記憶,論理的記憶I,論理的記憶II,言語性対連合I,視覚性対連合I,視覚性記憶範囲,視覚性再生I,視覚性再生II)においてAUCが0.7以上であった(図2).これらの結果は眼球運動および認知機能検査が比較的高い判別能をもつ指標を含むことを示している.
2)眼球運動指標と認知機能指標を用いた判別
眼球運動と認知機能を組み合わせた際の判別の評価を行った.データセット1のなかで眼球運動検査およびWAIS-III,WMS-Rのすべてが実施された健常者252名(平均年齢28.8歳±11.5歳,男性:女性144:108),統合失調症患者73名(平均年齢34.8歳±11.7歳,男性:女性40:33)をトレーニングセット,データセット2をテストセットとし,眼球運動指標16指標と認知機能指標25指標の計41指標を用いたロジスティック回帰により,統合失調症患者と健常者を判別する分類器を作成した.L2正則化によって作成された分類器は,トレーニングセットで92.0%,テストセットで75.8%の精度を示した.また,L1正則化によって作成された分類器は93.2%,テストセットで81.6%を示した.なお,後者の分類器ではフリービューイング課題のスキャンパス長,WAIS-IIIの符号,算数,記号探し,理解の5つの指標が非ゼロの回帰係数をもつ変数であった.
3)眼球運動指標と認知機能指標を1指標ずつ組み合わせた判別
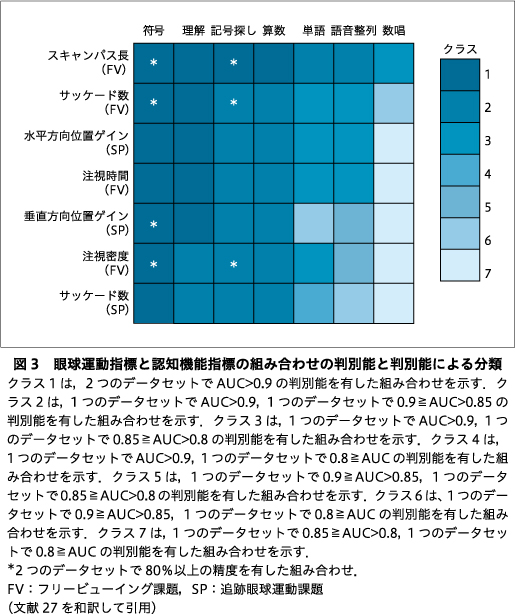
眼球運動と認知機能のそれぞれから1指標ずつ組み合わせた,2指標を用いた判別の評価を行った.AUCの値が0.7以上だった眼球運動8指標と認知機能21指標のうち,相関が高い組み合わせの一方(AUC値が小さいほう)を除外することで得られた眼球運動7指標および認知機能19指標を用いた.まず,トレーニングセットのデータを用いて眼球運動と認知機能からそれぞれ1指標ずつ組み合わせた133ペアの判別能をロジスティック回帰により評価した.133ペアすべてにおいて,眼球運動指標のみのときと比較してAUCは平均0.10±0.05向上し,認知機能指標のみのときと比較し平均で0.05±0.03向上した.また,正診率では,114ペアにおいて,眼球運動指標のみと比較して平均で9.58±5.07%向上し,認知機能指標のみと比較して平均で4.27±4.13%向上した.さらに,133ペアのうち32ペアはAUCが0.9よりも大きく,これらのペアでは眼球運動7指標(フリービューイング課題時のスキャンパス長,サッケード数,注視時間,注視密度,追跡眼球運動課題時の水平方向位置ゲイン,垂直方向位置ゲイン,サッケード数)のいずれかと,認知機能7指標(WAIS-IIIの符号,理解,記号探し,算数,単語,語音整列,WMS-Rの数唱)のいずれかの組み合わせであった.
次に,AUCが0.9よりも大きいペアに使われていた眼球運動7指標と認知機能7指標を,それぞれ1指標ずつ組み合わせた49ペアについてテストセットにおける汎化性能を調べた.トレーニングセットによる判別性能とテストセットによる汎化性能から49のペアを7つのクラスに分類した.49ペアのうち14ペアは,2つのデータセットで0.9よりも大きいAUCを示し,そのうちの7ペア(フリービューイング課題時のスキャンパス長と符号/記号探し,フリービューイング課題時のサッケード数と符号/記号探し,フリービューイング課題時の注視密度と符号/記号探し,追跡眼球運動課題時の垂直方向位置ゲインと符号)はトレーニングセット,テストセットともに80%より高い精度を示した(図3).この7ペアのロジスティック回帰から得られた判別スコアと年齢やクロルプロマジン換算との間に有意な相関はみられなかった.年齢を調整することで新たに作成したトレーニングセットにおいても,7ペアのうちフリービューイング課題時のサッケード数と記号探しのペアを除く6ペアは高い精度を有していた.
II.考察
本研究では,眼球運動検査と認知機能検査から得られた指標を用いて,健常者と統合失調症患者の判別について検討を行った.眼球運動と認知機能の計41指標を用いたロジスティック回帰の結果から,これらの情報が統合失調症の判別に有用であることが示唆された.また本研究では,より短時間で簡潔に行うことのできる検査の開発に資するために,健常者と統合失調症患者の判別に有用な2指標のペアの探索を行った.各モダリティの1指標よりも,2つのモダリティから得られた1指標ずつを組み合わせることが精度の向上につながることが示された.
さらに,2群の判別において,WAIS-IIIの符号,記号探し,理解,算数は眼球運動検査指標と組合せることによって高い判別能を示すことが示された.特に,符号および記号探しと眼球運動検査を組み合わせた7つのペアは,トレーニングセットならびにテストセットの両方のデータセットにおいて,80%以上の精度で判別することができたことから,汎化性能の高いペアであることが示唆された.また,これらの7ペアの判別能は,より多くの指標を用いた分類器に比べて遜色ない判別精度を示していた.これらの結果は,臨床においてより短時間で実施することができる精度の高い分類器の構成に,眼球運動と認知機能のペアによる判別が有用であることを示唆している.
臨床場面では,さまざまな年齢や治療経過の患者が訪れることから,年齢や抗精神病薬の影響を受けにくいペアの探索も必要である.本研究では,判別に有用と考えられたペアについて,判別能と年齢および抗精神病薬の投与量との関係について解析したが,年齢および抗精神病薬との関係は弱く,得られた7ペアは患者の背景を問わず頑健なペアであることが示唆された.認知機能に影響しうる併存症や検査による疲労の影響の検討,統合失調症と他の精神疾患との鑑別に関する検討などが今後の課題として挙げられる.
おわりに
本研究の結果から,眼球運動および認知機能の異常を示す指標を適切に選択することによって,健常者と統合失調症患者を高い精度で判別できることが示された.また,本結果は,これらの比較的簡便に行うことができる検査で,しかも短時間で実施できる少数の検査の結果からでも診断補助に有効な客観的マーカーを作成できる可能性を示唆している.眼球運動や認知機能の検査はデジタルデバイス上の実装も比較的容易である.統合失調症の治療において,客観的指標によるshared decision makingをもとにした適切な治療介入を実施することは良好な予後につながると考えられ,それを実現するための医療デジタルデバイスの開発は社会的意義が大きいと考えられる.
本論文はPCN誌に掲載された最新の研究論文27)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 5th ed (DSM-5). American Psychiatric Publishing, Arlington, 2013 (日本精神神経学会 日本語版用語監修, 髙橋三郎, 大野 裕監訳: DSM-5精神疾患の診断・統計マニュアル. 医学書院, 東京, 2014)
2) Arolt, V., Teichert, H. M., Steege, D., et al.: Distinguishing schizophrenic patients from healthy controls by quantitative measurement of eye movement parameters. Biol Psychiatry, 44 (6); 448-458, 1998![]()
3) Benson, P. J., Beedie, S. A., Shephard, E., et al.: Simple viewing tests can detect eye movement abnormalities that distinguish schizophrenia cases from controls with exceptional accuracy. Biol Psychiatry, 72 (9); 716-724, 2012![]()
4) Bestelmeyer, P. E. G., Tatler, B. W., Phillips, L. H., et al.: Global visual scanning abnormalities in schizophrenia and bipolar disorder. Schizophr Res, 87 (1-3); 212-222, 2006![]()
5) Boeker, H., Kleiser, M., Lehman, D., et al.: Executive dysfunction, self, and ego pathology in schizophrenia: an exploratory study of neuropsychology and personality. Compr Psychiatry, 47 (1); 7-19, 2006![]()
6) Bozikas, V. P., Kosmidis, M. H., Peltekis, A., et al.: Sex differences in neuropsychological functioning among schizophrenia patients. Aust N Z J Psychiatry, 44 (4); 333-341, 2010![]()
7) Campana, A., Duci, A., Gambini, O., et al.: An artificial neural network that uses eye-tracking performance to identify patients with schizophrenia. Schizophr Bull, 25 (4); 789-799, 1999![]()
8) Chmielewski, M., Clark, L. A., Bagby, R. M., et al.: Method matters: understanding diagnostic reliability in DSM-IV and DSM-5. J Abnorm Psychol, 124 (3); 764-769, 2015![]()
9) Chong, H. Y., Teoh, S. L., Wu, D. B., et al.: Global economic burden of schizophrenia: a systematic review. Neuropsychiatr Dis Treat, 12; 357-373, 2016![]()
10) Chung, S., Chung, H. Y., Jung, J., et al.: Association among aggressiveness, neurocognitive function, and the Val66Met polymorphism of brain-derived neurotrophic factor gene in male schizophrenic patients. Compr Psychiatry, 51 (4); 367-372, 2010![]()
11) Dickinson, D., Ramsey, M. E., Gold, J. M.: Overlooking the obvious: a meta-analytic comparison of digit symbol coding tasks and other cognitive measures in schizophrenia. Arch Gen Psychiatry, 64 (5); 532-542, 2007![]()
12) Diefendorf, A. R., Dodge, R.: An experimental study of the ocular reactions of the insane from photographic records. Brain, 31 (3); 451-489, 1908
13) Endicott, J., Spitzer, R. L., Fleiss, J. L., et al.: The global assessment scale. A procedure for measuring overall severity of psychiatric disturbance. Arch Gen Psychiatry, 33 (6); 766-771, 1976![]()
14) Fujino, H., Sumiyoshi, C., Yasuda, Y., et al.: Estimated cognitive decline in patients with schizophrenia: a multicenter study. Psychiatry Clin Neurosci, 71 (5); 294-300, 2017![]()
15) Fukushima, J., Fukushima, K., Chiba, T., et al.: Disturbances of voluntary control of saccadic eye movements in schizophrenic patients. Biol Psychiatry, 23 (7); 670-677, 1988![]()
16) Hashimoto, R.: Do eye movement abnormalities in schizophrenia cause Praecox Gefühl? Psychiatry Clin Neurosci, 75 (3); 79-80, 2021![]()
17) Holzman, P. S., Proctor, L. R., Hughes, D. W.: Eye-tracking patterns in schizophrenia. Science, 181 (4095); 179-181, 1973![]()
18) Kay, S. R., Fiszbein, A., Opler, L. A.: The Positive and Negative Syndrome Scale (PANSS) for schizophrenia. Schizophr Bull, 13 (2); 261-276, 1987![]()
19) Kojima, T., Matsushima, E., Nakajima, K., et al.: Eye movements in acute, chronic, and remitted schizophrenics. Biol Psychiatry, 27 (9); 975-989, 1990![]()
20) Matsuoka, K., Uno, M., Kasai, K., et al.: Estimation of premorbid IQ in individuals with Alzheimer's disease using Japanese ideographic script (Kanji) compound words: Japanese version of National Adult Reading Test. Psychiatry Clin Neurosci, 60 (3); 332-339, 2006![]()
21) Miura, K., Hashimoto, R., Fujimoto, M., et al.: An integrated eye movement score as a neurophysiological marker of schizophrenia. Schizophr Res, 160 (1-3); 228-229, 2014![]()
22) Morita, K., Miura, K., Fujimoto, M., et al.: Eye movement as a biomarker of schizophrenia: using an integrated eye movement score. Psychiatry Clin Neurosci, 71 (2); 104-114, 2017![]()
23) Morita, K., Miura, K., Fujimoto, M., et al.: Eye movement abnormalities and their association with cognitive impairments in schizophrenia. Schizophr Res, 209; 255-262, 2019![]()
24) 日本版WISC-III刊行委員会日本版作成: WISC-III知能検査. 日本文化科学社, 東京, 2006
25) O'Driscoll, G. A., Callahan, B. L.: Smooth pursuit in schizophrenia: a meta-analytic review of research since 1993. Brain Cogn, 68 (3); 359-370, 2008![]()
26) Okada, K., Miura, K., Fujimoto, M., et al.: Impaired inhibition of return during free-viewing behaviour in patients with schizophrenia. Sci Rep, 11 (1); 3237, 2021![]()
27) Okazaki, K., Miura, K., Matsumoto, J., et al.: Discrimination in the clinical diagnosis between patients with schizophrenia and healthy controls using eye movement and cognitive functions. Psychiatry Clin Neurosci, 77 (7); 393-400, 2023![]()
28) Onitsuka, T., Hirano, Y., Nemoto, K., et al.: Trends in big data analyses by multicenter collaborative translational research in psychiatry. Psychiatry Clin Neurosci, 76 (1); 1-14, 2022![]()
29) Onitsuka, T., Hirano, Y., Nakazawa, T., et al.: Toward recovery in schizophrenia: current concepts, findings, and future research directions. Psychiatry Clin Neurosci, 76 (7); 282-291, 2022![]()
30) Rössler, W., Salize, H. J., van Os, J., et al.: Size of burden of schizophrenia and psychotic disorders. Eur Neuropsychopharmacol, 15 (4); 399-409, 2005![]()
31) Schaefer, J., Giangrande, E., Weinberger, D. R., et al.: The global cognitive impairment in schizophrenia: consistent over decades and around the world. Schizophr Res, 150 (1); 42-50, 2013![]()