【目的】松果体実質体積(PPV)の減少は,アルツハイマー型認知症(AD)で認められている.それゆえ,PPVは臨床場面において,軽度認知障害(MCI)からADへの進行の予測因子として用いることができるかもしれない.本研究では,MCI患者においてPPVがADへの移行に関係しているのかを調べた.【方法】MRIを受けていた237名のMCI患者を対象とした.MCIからADに移行した患者(MCI-C)群と移行しなかった患者(MCI-NC)群のベースライン時のPPVの比較にtwo-sample t-testを用いた.MCIからADへの移行の予測因子を調べるためにロジスティック回帰分析(強制投入法)を用い,ベースライン時のPPV,年齢,性別,教育年数,APOE-ε4 alleles,MMSE得点,頭蓋内体積を変数として用いた.MCI-C群とMCI-NC群のベースライン時と最終測定時のPPVを比較するためにtwo-way repeated-measures ANOVAを行った.【結果】MCI-C群のベースライン時のPPVは,MCI-NC群と比較して有意に減少していた.ロジスティック回帰分析では,MCIからADへの移行の予測因子として,ベースライン時のMMSEとPPVが同定された.Two-way repeated-measures ANOVAでは,有意な群間の効果は認めたが,時間の効果は認めなかった.【結論】松果体体積はMCIからADへの移行の予測因子であり,ADにおける松果体体積減少はMCIの時点ですでに始まっている.したがって,松果体体積減少は臨床場面において,MCIからADへの移行の予測因子として有用であるかもしれない.
はじめに
アルツハイマー型認知症(Alzheimer's disease:AD)研究の多くは,アミロイド仮説に基づいて行われてきた.ADの神経病理学的変化は,臨床症状が出現する前から生じていることはよく知られている4).具体的に言うと,ADにおいて,脳脊髄液(cerebrospinal fluid:CSF)中のアミロイドβ(Aβ)1-42の減少が最初に起こり,次いで脳のAβ蓄積,CSF中のタウ蛋白の増加,脳萎縮,脳糖代謝低下,認知機能障害が生じる4).そのため,プレクリニカルAD26)やMCI due to AD2)といった概念が提唱されている.プレクリニカルADでは,AD病理を認めているが,軽度認知障害(mild cognitive impairment:MCI)や認知症の臨床診断基準を満たさない26).MCIはさまざまな病理的背景をもつため22),AD病理によるMCIであるMCI due to ADがADの前駆段階として提唱された2).プレクリニカルAD,MCI due to AD,ADは連続性があると考えられている5).
Aβの早期測定は,CSF検査,アミロイドPET,血漿Aβバイオマーカー測定により可能であるが16)23)31),これらの検査は臨床ではまだ日常的に用いられてはいない.そのため,臨床において認知機能低下を予測することができる要因を見つけることは重要である.神経画像研究ではMCIからADへの移行に関連する脳領域を示してきた.頭部MRIでは,側頭葉3)31),側頭葉内側8)21)31),海馬7)19)28)31)33),海馬傍回15)が,機能画像では,楔前部3)19),前頭葉3),側頭頭頂葉33)が移行の予測因子として同定されている.
近年,メラトニンがAD病理に関係していることが示唆されている.メラトニンは,タウ蛋白のリン酸化の減弱作用,抗アミロイド作用,抗アポトーシス作用,抗酸化作用,抗炎症作用を認める27)29)30).また,メラトニンは概日リズムや睡眠の調整作用も認めており27),メラトニンの減少は睡眠障害を引き起こす.グリンパティックパスウェイは脳内のAβの排泄に重要な役割を果たしているが,睡眠障害によりグリンパティックパスウェイの障害が生じ,その結果脳内にAβが蓄積する12)32).そのため,メラトニンの減少による睡眠障害によって,AD病理が進行する12)32).実際,CSFのメラトニン濃度はプレクニリカル段階ですでに減少しており,CSFのメラトニン濃度低下は,ADの初期徴候の1つかもしれない27).このようにメラトニンはADの進行に関与している可能性があり,ADの進行予防にも重要な役割を果たすかもしれない.
メラトニンは松果体から分泌され,松果体体積はADにおいて減少していることが知られている11).メラトニンは夜間に分泌され,日中は分泌量が少ないため,メラトニン測定を臨床的に用いるのは困難であるが,MRI画像を用いた松果体体積の測定は臨床においてADへの進行を予測する因子として用いることができるかもしれない.そこで,本研究では,MCI患者の松果体体積を横断的かつ縦断的に測定し,松果体体積がADへの移行の予測因子として用いることができるかを調べることを目的とした.
I.研究の方法および結果
1.方 法
1)対象
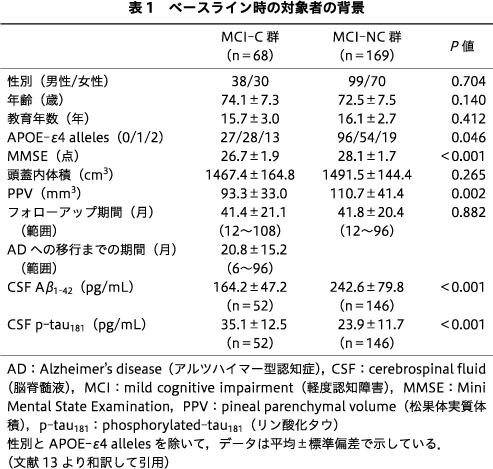
本研究では,Alzheimer's Disease Neuroimaging Initiative(ADNI)database1)のデータを用い,頭部MRI画像(3テスラ,T1強調画像,MP-RAGE)を施行し,少なくとも12ヵ月経過観察しており,MCIの診断基準を満たし,精神疾患や神経疾患の既往がなく,Mini Mental State Examination(MMSE)を施行していた237名を対象とした.ADNI研究では,MMSEが24~30点であり,記憶障害の訴えがあり,Wechsler Memory Scale Logical Memory IIの教育年数で補正した得点による客観的な記憶障害を認め,Clinical Dementia Rating(CDR)が0.5であり,記憶以外の認知ドメインの明らかな障害がなく,認知症を認めない場合にMCIと診断した.ADの定義は,MMSEが20~26点であり,CDRが0.5~1であり,National Institute of Neurological and Communicative Disorders and Stroke/Alzheimer's Disease and Related Disorders Associationのprobable ADの診断基準14)を満たす場合とした.対象者は6~12ヵ月ごとに評価された.ADに移行したMCI患者をMCI-C群,最終評価時にADに移行していなかったMCI患者をMCI-NC群とした.ADNI研究は,すべての参加施設において倫理審査の承認を受けており,開始時にすべての対象者から署名による同意を得ている.
2)評価
頭部MRIのデータはADNI-1,ADNI-GO,ADNI-2のデータを用いた.頭部MRIは,Siemens社,Philips社,もしくはGE Medical Systems社の機械を用いて撮像されていた.また98%の対象者において,ベースライン時と最終時の撮像は同じ機械を用いて行われた.松果体実質体積(pineal parenchymal volume:PPV)は,われわれの先行研究と同様の方法で測定した11).つまり,松果体を水平断,矢状断,冠状断の多断面で同定し,松果体体積と松果体囊胞体積をMRIcroを用いて,用手的に測定した13).PPVは松果体体積から松果体囊胞体積を引いた体積と定義した.頭蓋内体積(灰白質+白質+CSF)はSPM12を用いて測定した.CSF中のバイオマーカーとしては,ベースライン時のAβ1-42,リン酸化タウ(p-tau181)を用いた.
3)統計解析
ベースライン時の2群間の比較には,t検定とχ2検定を用いた.2群間のPPVの比較時に頭蓋内体積の影響を補正するために,頭蓋内体積を共変量として,共分散分析を行った.
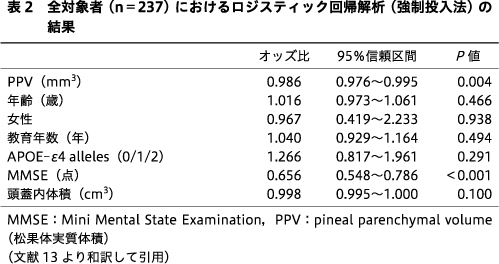
MCIからADへの移行の予測因子を同定するために,ベースライン時のPPV,年齢,性別,教育年数,APOE-ε4 alleles,MMSE得点,頭蓋内体積を変数として,ロジスティック回帰分析(強制投入法)を行った.CSFデータのある患者を対象にして,変数にベースライン時のCSF Aβ1-42,CSF p-tau181を加えて,同様のロジスティック回帰分析(強制投入法)を行った.
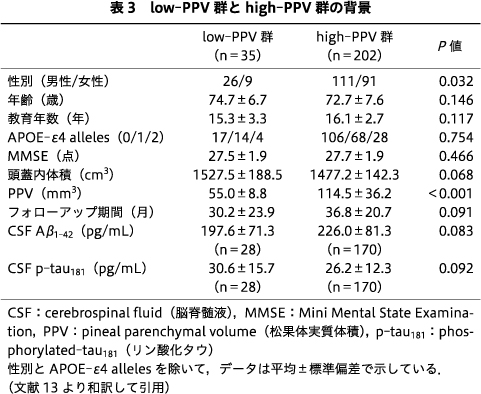
先行研究11)にてAD患者と健常者との鑑別において,Youden index(感度+特異度-1)が最も高かったPPVのカットオフ値66.56 mm3を用いて,MCI-C群とMCI-NC群との鑑別能を調べた.ベースライン時のPPVに,このカットオフ値を適用し,対象者をhigh-PPV群とlow-PPV群に分けた.
対象者によって観察期間が異なるため,カプラン-マイヤー生存分析(log-rank検定)を用いてhigh-PPV群とlow-PPV群のAD発症までの時間を比較した.AD発症のハザード比を推定するために,ベースライン時のPPV(high- or low-PPV群),年齢,性別,教育年数,APOE-ε4 alleles,MMSE得点,頭蓋内体積を変数として,Cox比例ハザード分析(強制投入法)を行った.PPVのハザード比はhigh-PPV群と比較した場合のlow-PPV群のハザード比を調べた.CSFデータのある患者を対象にして,変数にベースライン時のCSF Aβ1-42,CSF p-tau181を加えて,同様のCox比例ハザード分析(強制投入法)を行った.
MCI-C群とMCI-NC群のPPVの経時的変化の違いを調べるために,two-way repeated-measures analysis of variance(ANOVA)を行った.ベースライン時と最終測定時のPPVをMCI-C群とMCI-NC群で比較する(Group×Time)ためにtwo-way repeated ANOVAを行った.
2.結 果
1)ベースライン時のMCI-C群とMCI-NC群の比較
237名のMCI患者のうち,68名がADに移行した.ADへの移行までの平均期間は20.8±15.2ヵ月であった.2群間で有意差があったのは,APOE-ε4 alleles,MMSE得点,PPV,CSF Aβ1-42,CSF p-tau181であった(表1).共分散分析でも2群間でPPVに有意差があった.
2)ロジスティック回帰分析
237名のMCI患者を対象に行った場合,MMSE得点とPPVがADへの移行の予測因子として同定された(表2).CSFデータのある195名のMCI患者を対象に行った場合は,MMSE得点(オッズ比:0.718,95%信頼区間:0.574~0.898,P=0.004),CSF Aβ1-42(オッズ比:0.984,95%信頼区間:0.975~0.992,P<0.001),PPV(オッズ比:0.985,95%信頼区間:0.974~0.997,P=0.014)がADへの移行の予測因子として同定された.
3)MCI-C群とMCI-NC群の鑑別における松果体体積の診断能
PPVのカットオフ値を66.56 mm3としたときの感度は24%,特異度は89%,陽性的中率は46%,陰性的中率は74%,正確度は70%であった.Low-PPV群とhigh-PPV群とでは,性別だけが有意差があった(表3).Low-PPV群ではCSF Aβ1-42は低く,CSF p-tau181は高い傾向があった(表3).
4)カプラン-マイヤー生存分析,Cox比例ハザード分析
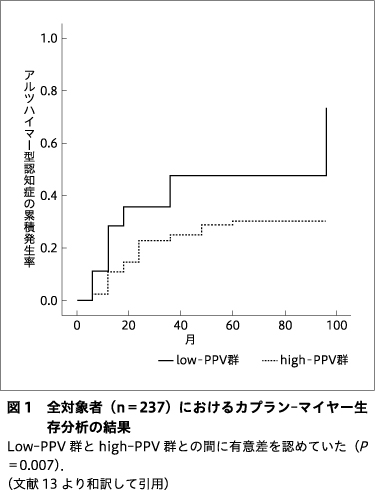
237名のMCI患者を対象にカプラン-マイヤー生存分析を行った場合,low-PPV群とhigh-PPV群との間に有意差があった(図1).Cox比例ハザード分析では,high-PPV群と比較してlow-PPV群ではAD発症のハザード比が2.258(95%信頼区間:1.258~4.055,P=0.006)であり,MMSE得点のハザード比は0.719(95%信頼区間:0.630~0.820,P<0.001)であった.
CSFデータのある195名のMCI患者を対象にカプラン-マイヤー生存分析を行った場合も同様の結果であった.Cox比例ハザード分析では,high-PPV群と比較してlow-PPV群ではAD発症のハザード比が2.046(95%信頼区間:1.033~4.053,P=0.040)であり,MMSE得点のハザード比は0.746(95%信頼区間:0.638~0.873,P<0.001),CSF Aβ1-42のハザード比は0.989(95%信頼区間:0.983~0.995,P<0.001)であった.
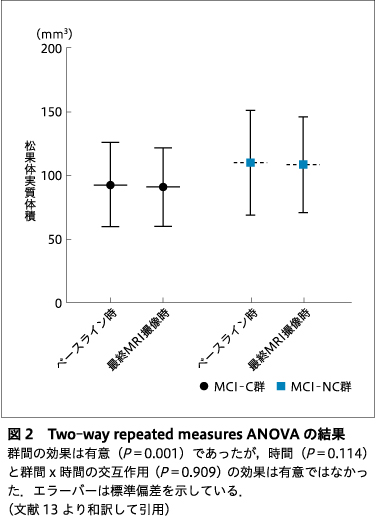
5)two-way repeated-measures ANOVA
ベースライン時のMRI撮像時から最終MRI撮像時までの平均期間は30.4±14.8ヵ月であった.Two-way repeated-measures ANOVAでは,有意な群間(MCI-C群とMCI-NC群)の効果は認めていたが,時間(ベースライン撮像時と最終撮像時)の効果や群間と時間の交互作用は有意ではなかった(図2).
II.考察
MCI-C群では,MCI-NC群よりもベースライン時のPPVが有意に減少しており,松果体体積はMCIからADへの移行の予測因子であるかもしれない.さらに,松果体体積は観察期間中に変化を認めなかった.これらの結果から,ADで認められる松果体体積の減少は,MCIの段階ですでに始まっていることが示唆された.
本研究では,平均41ヵ月の観察期間の間に29%のMCI患者がADに移行した.松果体体積に加えて,認知機能,CSF Aβ1-42がMCIからADへの移行の予測因子であった.先行研究では,13~60ヵ月の観察期間で23~68%のMCI患者がADに移行していた3)7)15)19)28)31)33).しかし,MCIの原因としてはさまざまな病理があり22),すべてのMCI患者が認知症に移行するわけではない.MCIの背景病理はさまざまであるが,松果体体積の減少はADに移行するMCI患者に認められる現象であるかもしれない.
MCIからADへの移行の予測因子としては,PPV,MMSE得点,CSF Aβ1-42が同定されたが,ADの危険因子であるAPOE-ε4 allelesとADのバイオマーカーであるCSF p-tau181は予測因子ではなかった.PPVのオッズ比は,ADのバイオマーカーであるCSF Aβ1-422)5)23)26)と同等であった.これらの結果から,臨床においてPPVはAD発症の予測因子として用いることができるかもしれない.
松果体体積の減少を認める患者では,認めない患者と比較して,CSF Aβ1-42が低下し,CSF p-tau181が上昇する傾向があった.松果体から分泌されるメラトニンには,抗アミロイド作用,タウのリン酸化の減弱作用がある27)29)30).そのため,メラトニン分泌の低下がAD病理の進行に影響を与えているのかもしれない.メラトニンは,松果体以外にも皮膚,水晶体,毛様体,腸,グリア細胞などでも合成されるが,松果体由来のメラトニンにのみ概日リズム調整作用がある29).そのため松果体由来のメラトニンの減少は睡眠障害を生じ,アミロイドの排泄に関係しているグリンパティックパスウェイの障害を引き起こすことによってAD病理を生じているのかもしれない12)32).
CSF中のメラトニンの減少は,ADのプレクリニカル段階で認められている27).高齢者において,メラトニン分泌量が多いほど認知機能障害の頻度が低く18),メラトニン分泌能はPPVと正比例しているといわれている6)10)17).そのため,松果体体積の減少によってメラトニン分泌の減少が生じ,それによりAD病理が進行するのかもしれない.アミロイドやタウの蓄積の共通の原因があるかもしれないというJack, C. R.の提言5)で考えると,松果体機能障害がその原因になっている可能性がある.
松果体とADとの関係については,まだまだ不明な点が多い.本研究では,平均約2~3年間の観察であるが,その期間では松果体体積の有意な変化は認められなかった.また,ADで認められている松果体体積の減少が,MCIの時点ですでに生じていることも示しており,松果体体積の減少はMCIからADへ進行する以前から認められる可能性を示した点は意義があると思われる.また,ADNIデータを用いて比較的多くのMCI患者を対象にできたことや,CSFやAPOE-ε4 allelesのデータも用いて解析できたことも意義がある.
おわりに
今後の課題としては,AD以外の認知症においてPPVの減少が生じているのか,臨床場面においてADのバイオマーカーとしてPPVを用いることができるのかを検証する必要がある.
また,本研究ではMCI段階からしか評価できておらず,ADのプレクリニカル段階におけるPPVについては評価できていないため,松果体体積の減少が,いつ生じているのかは不明である.松果体体積減少の原因についてはまだ不明ではあるが,本研究や先行研究の結果からAD病理により減少しているわけではなさそうである.例えば,神経原線維変化のような典型的なAD病理は松果体細胞では認められていない20)24).ADにおける松果体の石灰化の程度は,他の認知症,うつ病,健常コントロール群よりも有意に重度であると報告されている9).非石灰化松果体組織面積はメラトニン分泌量と正の相関を認めているため10),松果体の石灰化がメラトニン分泌の減少の原因の1つかもしれない25).松果体石灰化の機序についても十分わかっていないが,慢性血管性炎症,脳組織低酸素,頭蓋内圧,日光曝露が原因として示唆されている25)29).認知機能が正常な高齢者やADのプレクリニカル段階である対象者を経時的に観察して,どの段階で松果体体積の減少が生じているのかを調べ,ADにおける松果体体積減少の機序の解明をする必要がある.ADにおける松果体体積減少の機序を解明することが,ADの新しい治療の発展につながるかもしれない.
本論文はPCN誌に掲載された最新の研究論文13)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) ADNI: Alzheimer's Disease Neuroimaging Initiative. (http://adni.loni.nsc.edu) (参照2018-07-31)
2) Albert, M. S., DeKosky, S. T., Dickson, D., et al.: The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement, 7 (3); 270-279, 2011![]()
3) Hojjati, S. H., Ebrahimzadeh, A., Khazaee, A., et al.: Predicting conversion from MCI to AD by integrating rs-fMRI and structural MRI. Comput Biol Med, 102; 30-39, 2018![]()
4) Jack, C. R. Jr., Knopman, D. S., Jagust, W. J., et al.: Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. Lancet Neurol, 9 (1); 119-128, 2010![]()
5) Jack, C. R. Jr., Bennett, D. A., Blennow, K., et al.: NIA-AA Research Framework: toward a biological definition of Alzheimer's disease. Alzheimers Dement, 14 (4); 535-562, 2018![]()
6) Kunz, D., Schmitz, S., Mahlberg, R., et al.: A new concept for melatonin deficit: on pineal calcification and melatonin excretion. Neuropsychopharmacology, 21 (6); 765-772, 1999![]()
7) Luk, C. C., Ishaque, A., Khan, M., et al.: Alzheimer's disease: 3-Dimensional MRI texture for prediction of conversion from mild cognitive impairment. Alzheimers Dement (Amst), 10; 755-763, 2018![]()
8) Ma, X., Li, Z., Jing, B., et al.: Identify the atrophy of Alzheimer's disease, mild cognitive impairment and normal aging using morphometric MRI analysis. Front Aging Neurosci, 8; 243, 2016![]()
9) Mahlberg, R., Walther, S., Kalus, P., et al.: Pineal calcification in Alzheimer's disease: an in vivo study using computed tomography. Neurobiol Aging, 29 (2); 203-209, 2008![]()
10) Mahlberg, R., Kienast, T., Hädel, S., et al.: Degree of pineal calcification(DOC)is associated with polysomnographic sleep measures in primary insomnia patients. Sleep Med, 10 (4); 439-445, 2009![]()
11) Matsuoka, T., Imai, A., Fujimoto, H., et al.: Reduced pineal volume in Alzheimer disease: a retrospective cross-sectional MR imaging study. Radiology, 286 (1); 239-248, 2018![]()
12) Matsuoka, T., Imai, A., Fujimoto, H., et al.: Neural correlates of sleep disturbance in Alzheimer's disease: role of the precuneus in sleep disturbance. J Alzheimers Dis, 63 (3); 957-964, 2018![]()
13) Matsuoka, T., Oya, N., Yokota, H., et al.: Pineal volume reduction in patients with mild cognitive impairment who converted to Alzheimer's disease. Psychiatry Clin Neurosci, 74 (11); 587-593, 2020![]()
14) McKhann, G., Drachman, D., Folstein, M., et al.: Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology, 34 (7); 939-944, 1984![]()
15) Mitolo, M., Stanzani-Maserati, M., Capellari, S., et al.: Predicting conversion from mild cognitive impairment to Alzheimer's disease using brain 1H-MRS and volumetric changes: a two-year retrospective follow-up study. Neuroimage Clin, 23; 101843, 2019![]()
16) Nakamura, A., Kaneko, N., Villemagne, V. L., et al.: High performance plasma amyloid-β biomarkers for Alzheimer's disease. Nature, 554 (7691); 249-254, 2018![]()
17) Nölte, I., Lütkhoff, A-T, Stuck, B. A., et al.: Pineal volume and circadian melatonin profile in healthy volunteers: an interdisciplinary approach. J Magn Reson Imaging, 30 (3); 499-505, 2009![]()
18) Obayashi, K., Saeki, K., Iwamoto, J., et al.: Physiological levels of melatonin relate to cognitive function and depressive symptoms: the HEIJO-KYO Cohort. J Clin Endocrinol Metab, 100 (8); 3090-3096, 2015![]()
19) Ottoy, J., Niemantsverdriet, E., Verhaeghe, J., et al.: Association of short-term cognitive decline and MCI-to-AD dementia conversion with CSF, MRI, amyloid- and 18F-FDG-PET imaging. Neuroimage Clin, 22; 101771, 2019![]()
20) Pardo, C. A., Martin, L. J., Troncoso, J. C., et al.: The human pineal gland in aging and Alzheimer's disease: patterns of cytoskeletal antigen immunoreactivity. Acta Neuropathol, 80 (5); 535-540, 1990![]()
21) Reas, E. T., Hagler, D. J. Jr., White, N. S., et al.: Microstructural brain changes track cognitive decline in mild cognitive impairment. Neuroimage Clin, 20; 883-891, 2018![]()
22) Saito, Y., Murayama, S.: Neuropathology of mild cognitive impairment. Neuropathology, 27 (6); 578-584, 2007![]()
23) Shaw, L. M., Vanderstichele, H., Knapik-Czajka, M., et al.: Cerebrospinal fluid biomarker signature in Alzheimer's disease neuroimaging initiative subjects. Ann Neurol, 65 (4); 403-413, 2009![]()
24) Skene, D. J., Swaab, D. F.: Melatonin rhythmicity: effect of age and Alzheimer's disease. Exp Gerontol, 38 (1-2); 199-206, 2003![]()
25) Song, J.: Pineal gland dysfunction in Alzheimer's disease: relationship with the immune-pineal axis, sleep disturbance, and neurogenesis. Mol Neurodegener, 14 (1); 28, 2019![]()
26) Sperling, R. A., Aisen, P. S., Beckett, L. A., et al.: Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement, 7 (3); 280-292, 2011![]()
27) Srinivasan, V., Kaur, C., Pandi-Perumal, S., et al.: Melatonin and its agonist ramelteon in Alzheimer's disease: possible therapeutic value. Int J Alzheimers Dis, 2011; 741974, 2010![]()
28) Tabatabaei-Jafari, H., Walsh, E., Shaw, M. E., et al.: A simple and clinically relevant combination of neuroimaging and functional indexes for the identification of those at highest risk of Alzheimer's disease. Neurobiol Aging, 69; 102-110, 2018![]()
29) Tan, D. X., Xu, B., Zhou, X., et al.: Pineal calcification, melatonin production, aging, associated health consequences and rejuvenation of the pineal gland. Molecules, 23 (2); 301, 2018![]()
30) Tobore, T. O.: On the central role of mitochondria dysfunction and oxidative stress in Alzheimer's disease. Neurol Sci, 40 (8); 1527-1540, 2019![]()
31) Trzepacz, P. T., Yu, P., Sun, J., et al.: Comparison of neuroimaging modalities for the prediction of conversion from mild cognitive impairment to Alzheimer's dementia. Neurobiol Aging, 35 (1); 143-151, 2014![]()
32) Yulug, B., Hanoglu, L., Kilic, E.: Does sleep disturbance affect the amyloid clearance mechanisms in Alzheimer's disease? Psychiatry Clin Neurosci, 71 (10); 673-677, 2017![]()
33) Zhou, H., Jiang, J., Lu, J., et al.: Dual-model radiomic biomarkers predict development of mild cognitive impairment progression to Alzheimer's disease. Front Neurosci, 12; 1045, 2019![]()