認知症疾患にしばしば併発する睡眠障害は,介護負担の増大の背景要因の1つと考えられ,適切な対処や効果的な治療の確立は,重要な医学的課題である.最近,認知症診療における疾患別・病期別の睡眠障害の頻度や臨床的特徴が報告され,脳病態に応じた治療対応が期待されている.しかし,2017年に公表されたわが国の認知症診療ガイドラインでは,睡眠障害分類別や疾患別の治療対応ではなく,認知症全般における睡眠障害に対する総括的内容にとどまっているのが現状である.臨床病理学的検討では,臨床診断と病理診断の乖離が明らかとなっており,アルツハイマー病(AD)の臨床診断の特異度の向上は,今後の認知症の睡眠障害に関する臨床研究の遂行のうえで重要な課題である.2017年のレビー小体型認知症(DLB)の臨床診断基準の改訂では,レム睡眠行動障害(RBD)が中核症状に格上げされ,日中の眠気が支持症状に追加された.RBDに関する臨床病理学的研究結果を踏まえると,RBDの症状を確認することで,DLBの診断率の向上ばかりでなく,結果的にAD診断の特異度の改善が期待される.また,認知症の鑑別診断において睡眠障害の病歴に配慮することにつながり,認知症の不眠診療の向上に寄与すると考えられる.認知症疾患における標準的な不眠診療は確立されておらず,さらなる知見の蓄積が必要である.
はじめに
睡眠・覚醒は,脳活動によってもたらされ,脳機能の加齢による変化は睡眠・覚醒に影響を与え,高齢者では,睡眠構造の変化や睡眠リズムの変化を生じやすい.認知症疾患では,高度な大脳皮質および視交叉上核の神経細胞脱落や睡眠に関連する広範な神経伝達系の障害を認め,病的な脳機能低下を生じるため,睡眠構造や睡眠覚醒リズムの変化が一層顕著となる.認知症に伴う精神症状・行動異常(behavioral and psychological symptoms of dementia:BPSD)によって,介護負担が増大することで在宅生活の継続が困難になることをしばしば経験する.Rose, K. M.ら32)は,在宅認知症高齢者59症例〔平均79.1歳,Mini-Metal State Examination(MMSE)20.1点〕を対象として,原発性睡眠障害と夜間の問題行動(nocturnal agitation behaviors)の関係について報告している.すなわち,閉塞性睡眠時無呼吸症候群(obstructive sleep apnea syndrome:OSAS),むずむず脚症候群(restless legs syndrome:RLS),周期性四肢運動障害と夜間の問題行動の関係を調査し,高度の認知機能障害と無呼吸低呼吸指数(apnea hypopnea index:AHI)低値,RLSの罹患が関連していた.施設入所したアルツハイマー病(Alzheimer's disease:AD)患者(平均MMSE 6.5点)を対象とした先行研究15)では,AHIの高値は日中の焦燥と関連していた.このように,認知症疾患における睡眠障害とBPSDの関係が示唆され,睡眠障害に対する適切な対処や効果的な治療は,重要な医学的課題である.
神経変性性認知症疾患は,疾患に特徴的な蛋白の異常病態に基づく分類がなされ,疾患によって変性部位が異なることから,生じる睡眠障害の特徴も異なる可能性がある.これまでの臨床研究は,ADのみを対象としたものがほとんどであったが,認知症診療における疾患別の睡眠障害の知見が報告されつつある.本稿では,ADとレビー小体型認知症(dementia with Lewy bodies:DLB)を中心に各認知症疾患の睡眠障害の特徴について述べ,不眠治療の現状と課題について考察した.
I.認知症の不眠診療の現状
認知症疾患の診療では,記憶障害をはじめとする認知機能低下によって,病歴聴取や睡眠ポリグラフ検査(polysomnography:PSG)の施行が困難となり,介護者の報告に基づき治療計画を立案せざるを得ないことも少なくない.しかし,介護者の報告とアクチグラフを用いた睡眠評価の結果には差異があることが指摘されており,評価方法の改良が望まれる5)24).2016年に報告された認知症疾患における睡眠障害に対する薬物療法のシステマティックレヴューでは,最終的に6つのランダム化比較試験に絞られたが,有効性が確認された薬物治療はほとんどなかった23).このなかでトラゾドン50 mg/日の2週間投与によって,中途覚醒時間・回数は不変であったが,夜間睡眠時間,睡眠効率が改善されたことが報告されている.また,2017年に公表されたわが国の認知症診療ガイドラインでは28),「まず睡眠障害の正確な把握と鑑別診断を行う.また影響しうる身体症状(疼痛,頻尿,掻痒),心理・社会的ストレス,嗜好品,薬剤があれば改善する.その上で,日中の日光浴や身体活動を促し,睡眠環境の改善をはかる.また可能であれば高照度光療法も検討する.薬物療法としては,トラゾドン,リスペリドンの使用を検討してもよい.しかしベンゾジアゼピン系睡眠薬は鎮静や転倒などの有害事象が起こりやすいので推奨されない」と記載されている.すなわち,いずれの報告も,睡眠障害分類や原因疾患に応じた治療ではなく,認知症の睡眠障害全般に対する総括的内容となっているのが現状である.
最も頻度の高いADにおいて,髄液中アミロイドβ(Aβ)・リン酸化タウの測定やアミロイドイメージング,疾患修飾薬による治療がすでに実施されているように,各認知症疾患の主要異常蓄積蛋白によって疾患分類が行われ,脳病理に基づいた臨床診断がますます重要になってきている.しかし,臨床病理学的検討では,臨床診断と病理診断の乖離が報告されている.米国31ヵ所のADセンターにおいて,ADの臨床診断を受けた1,924症例のうち,剖検によりADの病理診断に至ったのは64%であった27).また,大脳皮質にレビー病理を有する410症例のうち,DLBと臨床診断されたのは30%であり,59%がADと臨床診断されていた.病理診断の結果を踏まえると障害された脳部位がより不均一な集団(約3分の1が病理学的にADの基準を満たさず)を対象として,認知症の睡眠障害に対する臨床研究を実施していた可能性がある.そのため,ADの臨床診断の特異度の向上は,臨床研究の遂行のうえで重要な課題であると考えられる.2017年に改訂されたDLBの臨床診断基準25)では,レム睡眠行動障害(REM sleep behavior disorder:RBD)が示唆症状から中核症状に格上げされた.RBDのDLBに対する疾患特異性の高さから,DLBの診断率の向上につながると考えられ,結果的にADの臨床診断の特異度の改善が期待される.AD臨床診断の特異度の向上は,今後の臨床研究の遂行のうえで重要な課題である.
II.認知症疾患別の睡眠障害の頻度
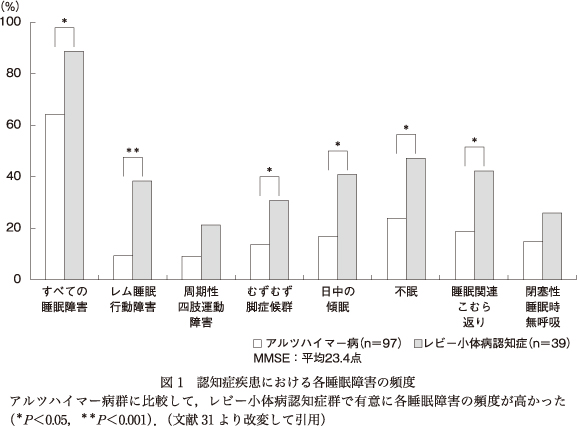
イタリア10ヵ所の神経センターの連続431症例を対象として,疾患別の睡眠障害の頻度が報告された16).性別,年齢,MMSEとベック抑うつ評価尺度の得点を調整し,ADと各認知症疾患の睡眠障害の頻度が比較検討された.1つ以上の睡眠障害の頻度は,前頭側頭型認知症(frontotemporal dementia:FTD)はADと同程度であり,脳血管性認知症(vascular dementia:VaD)が2.1倍,DLB/パーキンソン病認知症(Parkinson's disease dementia:PDD)が2.6倍の頻度であった.睡眠呼吸障害(sleep-disordered breathing:SDB)は,VaDでADの2.5倍であった.RBDは,DLB/PDDでADの2.6倍であった.RLSの頻度は,0~8%と低く,疾患別の相違は認められなかった.Rongve, A. ら31)は,AD(97症例)とDLB/PDD(39症例)を対象として,質問紙票を用いて睡眠障害の頻度を調査した(いずれも平均MMSEは23点台).1つ以上の睡眠障害の頻度は,AD群(64.0%)に比較して,DLB/PDD群で88.6%と有意に高い割合であった(図1).各睡眠障害の頻度においても,DLB/PDD群でRBD(38.5%),RLS(30.8%),日中の眠気(40.6%),不眠(47.2%),睡眠関連こむら返り(42.4%)と有意に出現頻度が高く,睡眠障害は多岐に及んでいた.米国のADセンターによる多施設調査においてもDLB群がAD群に比較して高頻度に睡眠障害を示すことが報告されている4).この研究では,AD群では病期の進行とともに睡眠障害が生じている一方で,DLB群では病期の進行と睡眠障害の頻度に相関を認めなかった.DLB群でRBDが認知症の発症にしばしば先行することや,日中の眠気が認知機能の比較的保持されている病初期から出現することも対照的である.わが国のKabeshita, Y.ら18)もAD 684症例を対象とした多施設調査を実施し,Clinical Dementia Rating(CDR)ステージと睡眠障害の頻度について報告している.その結果,CDR 0.5(10.9%),CDR 1(20.8%),CDR 2(35.7%),CDR 3(50%)とステージの進行とともに睡眠障害の頻度が増加していた.Ferman, T. J.ら12)は,DLB(61症例)とAD(26症例)の睡眠検査結果を比較した.両群とも平均年齢70歳で,平均MMSEは23点台であった.PSGでは,DLB群の71%にRBDの臨床診断に必須であるREM sleep without atonia(RWA)を認めたのに対して,AD群では8%にのみ認められた.反復睡眠潜時検査(Multiple Sleep Latency Test:MSLT)では,DLB群の平均睡眠潜時が6.4±5分であり,AD群の11±5分に比較して有意に短かった.AD群の睡眠潜時は,認知機能障害の程度と関連していたが,DLB群では認知機能障害の程度や前日の睡眠効率,RBDの有無とは相関していなかった.つまり,DLBの日中の眠気は,ADよりも生じやすく,睡眠の断片化に付随したものではなく,DLBに特有の症状であり,改訂されたDLBの臨床診断基準25)の支持症状として記載されている.
III.脳病態と睡眠障害について
Boeve, B. F. 6)は認知症診療における睡眠障害について,脳病態による神経化学的変化を考慮する必要性を指摘している.RBDは,シヌクレイノパチーに高い疾患特異性を有することが臨床病理学的検討より明らかになっている7).そのため,RBD症状の出現にレビー病理による脳病態が深く関与していることが考えられている.ADの脳病態による神経化学的変化として,オレキシンに関するものが報告されている.視床下部のオレキシン産生神経細胞は,上行性脳幹網様体賦活系を構成するモノアミンおよびコリン作動性神経細胞を含有する脳幹の諸核に投射しており,睡眠・覚醒の制御において重要な役割を担っている.Liguori, C.ら22)は,ADを背景とした軽度認知障害〔mild cognitive impairment(MCI)due to AD〕の段階(平均MMSE 25.8点)において,脳脊髄液中のオレキシン濃度の高値が,ピッツバーグ睡眠質問紙票による主観的評価(5点以上)とPSG上の入眠潜時の延長,睡眠効率の低下,レム睡眠の減少と関係していることを明らかにした.また,AD症例の脳脊髄液では,オレキシン濃度と総タウ蛋白濃度が有意に相関し,アミロイドβ濃度とは相関しないことが報告されている21).ADの剖検脳を用いた神経病理学的検討では,健常コントロールに比較して,抗オレキシン抗体陽性神経細胞数が40%減少し,病期の進行とともに神経細胞脱落が生じていた14).Kasanuki, K. ら19)は,ADとDLBの剖検脳を対象とした免疫組織化学的検討によって,視床下部外側における抗オレキシン抗体陽性神経細胞数と病理所見の関係を報告している.残存する抗オレキシン抗体陽性神経細胞数は,神経原線維変化ステージと有意な逆相関を認めた一方で,レビー病理の程度とは相関を認めなかった.これらの結果から,オレキシンの異常は,ADの病期の進行とともに増加する睡眠障害の一要因かもしれない.
IV.原発性睡眠障害の治療
OSASは,高血圧,冠動脈疾患,心不全,脳卒中,糖尿病の罹患率および死亡率の増加と強く関連し,特にVaDでは,脳卒中の再発により認知機能低下を生じることから注意が必要である.保存的治療法として減量,持続陽圧呼吸療法(continuous positive airway pressure:CPAP),口腔内装置が挙げられる.OSASを併発したAD患者を対象とした検討では,CPAP治療により,睡眠の質・日中の眠気・気分が改善された2)9)10).認知機能低下のため,CPAPの治療導入と継続率の低さが危惧されるが,Ayalon, L.ら3)は,OSAS(平均AHI 25.6)を併発するADを対象とした6ヵ月間のCPAP治療について報告している.この研究では,軽症ADあるいは中等症ADを対象としているものの平均MMSE 25.3(範囲18~30)点とMCIの患者を含んでいると考えられ,結果の解釈に注意が必要である.結果として,ベースラインのコーネル抑うつ尺度の得点が継続率に関係していた.Troussière, A. C.ら34)は,重度OSASを併発するADを対象として,CPAP治療の有無で認知機能低下の進行について比較検討した.CPAP治療群は,平均MMSE 23.5(範囲20~27)点であり,MCI症例が含まれていると考えられる.この研究では,CPAP治療群で,PSG施行3.3年(中央値)後のMMSE得点において,年次低下率が有意に低かった.Osorio, R. S.ら29)は,大規模縦断研究であるAlzheimer's Disease Neuroimaging Initiative(ADNI)のデータを分析し,SDB・CPAP治療の有無と,MCI・認知症発症年齢の関係を調査した.その結果,SDBの存在は,MCIの低い発症年齢と相関し,CPAP治療によりMCIの発症年齢を遅延できる可能性を報告した.しかし,CPAP治療と認知症の発症年齢の間には関係を認めなかった.彼らは,無治療のSDBがMCIの状態を惹起する可能性について言及している8).Moraes, W.ら26)は,OSASを伴うAD(平均MMSE 19点)を対象とした二重盲検試験において,プラセボ12症例と比較して,ドネペジルによってOSASの程度と認知機能がいずれも改善したことを報告している.
Richards, K.ら30)は,RLSを伴う認知症患者における頻度の高い危険因子として,PSG上のPeriodic Leg Movement Sleep Index>15(54.5%),選択的セロトニン再取り込み阻害薬の使用(34.7%)を報告している.認められた行動としては,反復運動(56.5%),落ち着きのなさ(34.7%)であった.中等度から重度の認知機能障害を認める場合,RLSの感覚異常を表現することができず,臨床診断に至らないことが指摘されており33),認知症高齢者に対応した診断基準が作成されている1).RLSの薬物療法として頻用されるドパミン受容体作動薬は,DLB/PDDでは幻覚・妄想の悪化に注意が必要である.
Fernández-Arcos, A.ら13)は,特発性RBD患者の連続203症例の臨床的特徴について調査し,その70%が自らの睡眠について良眠だと自覚していることが報告されている.そのため,DLB/PDD患者における不眠の原因疾患としてのRBDは,少ない可能性がある.RBD症状に対する治療は,RLSと同様に非薬物療法が基本である6)7).最近,RBD症状の激しい動きを感知して介護者の落ち着くよう促す声を自動再生させるベッドアラームが睡眠関連の怪我を減少させることが報告されている17).海外では,メラトニンがRBD治療に推奨されているが,わが国では使用できないため,ラメルテオンの効果が期待される11)20).しかし,RBDを伴うDLB/PDDに関する報告はない.第二選択薬とされるクロナゼパムについては,OSASの悪化や転倒のリスクを考慮して,慎重に使用すべきである.
おわりに
睡眠障害の頻度や臨床的特徴が,認知症の疾患や病期によって異なることが明らかとなっている.脳病態に応じた認知症の疾患別・病期別による不眠診療の実践には,正確な認知症の鑑別診断が必要である.2017年のDLBの臨床診断基準の改訂により,DLB診断の向上とともにAD診断の特異度の改善が期待されている.また,鑑別診断のためにRBDや日中の眠気を考慮することは,認知症診療のなかで睡眠障害に注意を促すこととなり,認知症の不眠診療の向上につながると考えられる.しかし,認知症疾患における標準的な不眠診療は確立されておらず,さらなる知見の蓄積が必要である.
なお,本論文に関連して開示すべき利益相反はない.
1) Allen, R. P., Picchietti, D., Hening, W. A., et al., Restless Legs Syndrome Diagnosis and Epidemiology Workshop at the National Institutes of Health; International Restless Legs Syndrome Study Group: Restless legs syndrome: diagnostic criteria, special considerations, and epidemiology. A report from the Restless Legs Syndrome Diagnosis and Epidemiology Workshop at the National Institutes of Health. Sleep Med, 4 (2); 101-119, 2003![]()
2) Ancoli-Israel, S., Palmer, B. W., Cooke, J. R., et al.: Cognitive effects of treating obstructive sleep apnea in Alzheimer's disease: a randomized controlled study. J Am Geriatr Soc, 56 (11); 2076-2081, 2008![]()
3) Ayalon, L., Ancoli-Israel, S., Stepnowsky, C., et al.: Adherence to continuous positive airway pressure treatment in patients with Alzheimer's disease and obstructive sleep apnea. Am J Geriatr Psychiatry, 14 (2); 176-180, 2006![]()
4) Bliwise, D. L., Mercaldo, N. D., Avidan, A. Y., et al.: Sleep disturbance in dementia with Lewy bodies and Alzheimer's disease:a multicenter analysis. Dement Geriatr Cogn Disord, 31; 239-246, 2011![]()
5) Bloom, H. G., Ahmed, I., Alessi, C. A., et al.: Evidence-based recommendations for the assessment and management of sleep disorders in older persons. J Am Geriatr Soc, 57 (5); 761-789, 2009![]()
6) Boeve, B. F.: Update on the diagnosis and management of sleep disturbances in dementia. Sleep Med Clin, 3; 347-360, 2008![]()
7) Boeve, B. F.: REM sleep behavior disorder:updated review of the core features, the REM sleep behavior disorder-neurodegenerative disease association, evolving concepts, controversies, and future directions. Ann N Y Acad Sci, 1184; 15-54, 2010![]()
8) Bombois, S., Derambure, P., Pasquier, F., et al.: Sleep disorders in aging and dementia. J Nutr Health Aging, 14 (3); 212-217, 2010![]()
9) Cooke, J. R., Ayalon, L., Palmer, B. W., et al.: Sustained use of CPAP slows deterioration of cognition, sleep, and mood in patients with Alzheimer's disease and obstructive sleep apnea: a preliminary study. J Clin Sleep Med, 5 (4); 305-309, 2009![]()
10) Cooke, J. R., Ancoli-Israel, S., Liu, L., et al.: Continuous positive airway pressure deepens sleep in patients with Alzheimer's disease and obstructive sleep apnea. Sleep Med, 10 (10); 1101-1106, 2009![]()
11) Esaki, Y., Kitajima, T., Koike, S., et al.: An open-labeled trial of ramelteon in idiopathic rapid eye movement sleep behavior disorder. J Clin Sleep Med, 12 (5); 689-693, 2016![]()
12) Ferman, T. J., Smith, G. E., Dickson, D. W., et al.: Abnormal daytime sleepiness in dementia with Lewy bodies compared to Alzheimer's disease using the Multiple Sleep Latency Test. Alzheimers Res Ther, 6 (9); 76, 2014![]()
13) Fernández-Arcos, A., Iranzo, A., Serradell, M., et al.: The clinical phenotype of idiopathic rapid eye movement sleep behavior disorder at presentation:a study in 203 consecutive patients. Sleep, 39 (1); 121-132, 2016![]()
14) Fronczek, R., van Geest, S., Frölich, M., et al.: Hypocretin (orexin) loss in Alzheimer's disease. Neurobiol Aging, 33; 1642-1650, 2012![]()
15) Gehrman, P. R., Martin, J. L., Shochat, T., et al.: Sleep-disordered breathing and agitation in institutionalized adults with Alzheimer disease. Am J Geriatr Psychiatry, 11; 426-433, 2003![]()
16) Guarnieri, B., Adorni, F., Musicco, M., et al.: Prevalence of sleep disturbances in mild cognitive impairment and dementing disorders:a multicenter Italian clinical cross-sectional study on 431 patients. Dement Geriatr Cogn Disord, 33 (1); 50-58, 2012![]()
17) Howell, M. J., Arneson, P. A., Schenck, C. H.: A novel therapy for REM sleep behavior disorder (RBD). J Clin Sleep Med, 7 (6); 639-644A, 2011![]()
18) Kabeshita, Y., Adachi, H., Matsushita, M., et al.: Sleep disturbances are key symptoms of very early stage Alzheimer disease with behavioral and psychological symptoms: a Japan multi-center cross-sectional study (J-BIRD). Int J Geriatr Psychiatry, 32; 222-230, 2017![]()
19) Kasanuki, K., Iseki, E., Kondo, D., et al.: Neuropathological investigation of hypocretin expression in brains of dementia with Lewy bodies. Neurosci Lett, 569; 68-73, 2014![]()
20) Kashihara, K., Nomura, T., Maeda, T., et al.: Beneficial effects of ramelteon on rapid eye movement sleep behavior disorder associated with Parkinson's disease:results of a multicenter open trial. Intern Med, 55 (3); 231-236, 2016![]()
21) Liguori, C., Romigi, A., Nuccetelli, M., et al.: Orexinergic system dysregulation, sleep impairment, and cognitive decline in Alzheimer disease. JAMA Neurol, 71; 1498-1505, 2014![]()
22) Liguori, C., Nuccetelli, M., Izzi, F., et al.: Rapid eye movement sleep disruption and sleep fragmentation are associated with increased orexin-A cerebral-fluid levels in mild cognitive impairment due to Alzheimer's disease. Neurobiol Aging, 40; 120-126, 2016![]()
23) McCleery, J., Cohen, D. A., Sharpley, A. L.: Pharmacotherapies for sleep disturbances in dementia. Cochrane Database Syst Rev, 11; CD009178, 2016![]()
24) McCurry, S. M., Vitiello, M. V., Gibbons, L. E., et al.: Factors associated with caregiver reports of sleep disturbances in persons with dementia. Am J Geriatr Psychiatry, 14 (2); 112-120, 2006![]()
25) McKeith, I. G., Boeve, B. F., Dickson, D. W., et al.: Diagnosis and management of dementia with Lewy bodies:fourth consensus report of the DLB consortium. Neurology, 89 (1); 88-100, 2017![]()
26) Moraes, W., Poyares, D., Sukys-Claudino, L., et al.: Donepezil improves obstructive sleep apnea in Alzheimer disease: a double-blind, placebo-controlled study. Chest, 133 (3); 677-683, 2008![]()
27) Nelson, P. T., Jicha, G. A., Kryscio, R. J., et al.: Low sensitivity in clinical diagnoses of dementia with Lewy bodies. J Neurol, 257; 359-366, 2010![]()
28) 日本神経学会監修, 「認知症疾患診療ガイドライン」作成委員会編: 認知症疾患診療ガイドライン2017. 医学書院, 東京, 2017
29) Osorio, R. S., Gumb, T., Pirraglia, E., et al.: Sleep-disordered breathing advances cognitive decline in the elderly. Neurology, 84 (19); 1964-1971, 2015![]()
30) Richards, K., Shue, V. M., Beck, C. K., et al.: Restless legs syndrome risk factors, behaviors, and diagnoses in persons with early to moderate dementia and sleep disturbance. Behav Sleep Med, 8 (1); 48-61, 2010![]()
31) Rongve, A., Boeve, B. F., Aarsland, D.: Frequency and correlates of caregiver-reported sleep disturbances in a sample of persons with early dementia. J Am Geriatr Soc, 58; 480-486, 2010![]()
32) Rose, K. M., Beck, C., Tsai, P. F., et al.: Sleep disturbances and nocturnal agitation behaviors in older adults with dementia. Sleep, 34; 779-786, 2011![]()
33) Rothdach, A. J., Trenkwalder, C., Haberstock, J., et al.: Prevalence and risk factors of RLS in an elderly population: the MEMO study. Memory and morbidity in Augsburg elderly. Neurology, 54 (5); 1064-1068, 2000![]()
34) Troussière, A. C., Charley, C. M., Salleron, J., et al.: Treatment of sleep apnoea syndrome decreases cognitive decline in patients with Alzheimer's disease. J Neurol Neurosurg Psychiatry, 85 (12); 1405-1408, 2014![]()