精神疾患は社会的に影響が大きな疾患である.精神医学は100年前から,困難ななかでも,病理学に根差した医学であろうとし続けてきたし,実際,アルツハイマー病,進行麻痺,ナルコレプシーなど,次々と精神疾患の病理学的基盤が明らかにされてきた.現在の精神医学においては,精神疾患の操作的定義に基づく臨床試験などのpragmaticな科学と,神経科学などの手法に基づく原因解明に関するmechanisticな科学の2つが乖離している.この状況を克服し,精神疾患の克服をめざして,精神疾患の原因解明を進めるには,動物モデル,iPS細胞,死後脳などを対象とした研究や,データ駆動型研究などを駆使し,基礎と臨床の相互的連携を進める必要がある.精神疾患の原因解明研究が進むことにより,脳画像やゲノム解析などに基づく生物学的診断が可能になると期待される.
はじめに
精神・神経疾患は大きな生活の障害をもたらしており,精神疾患と神経疾患を合わせると,日本における障害により失われた年数(Years Lost due to Disability:YLDs)のうち,29.4%を占めている16).これは,日本国民の病気によるQOL損失の最大要因が精神・神経疾患であることを示している.
世界的には,がん,循環器疾患,精神疾患が3大疾患と位置づけられているが,日本でも,2011年に厚生労働省が精神疾患を5大疾病の1つに位置づけた.現在,国民の40人に1人が精神疾患で治療中であり,全科の入院患者数のなかで,最多は統合失調症である〔15万人,すべての入院患者(131万人)の11.6%〕6).そして,長期休職の最大の原因は,おそらくうつ病と考えられる.毎年約2万人が自殺しているが,その半数以上がうつ病・うつ状態と考えられている.
精神疾患患者は3つの苦しみを抱えているといわれる.すなわち,病気の苦しみ,副作用の苦しみ,病気を理解されない苦しみである.この状況を何とかして改善していかなければならない.
I.精神疾患研究の歴史
精神医学は,ジェットコースターのような歴史をたどってきた.古代ギリシャにおいては,うつ病はメランコリーと呼ばれ,その語源は黒胆汁である.まがりなりにも,古代ギリシャから,うつ病は心の悩みではなく,身体の病気と考えられていたことになる.中世には,魔術的な考えが隆盛となり,魔女狩りが行われたが,19世紀末に精神疾患は再発見され,一時は脳一辺倒の時代もあった.当時,Griesinger, W.(1817~1868)は,「精神疾患は脳病」と述べた.20世紀初頭の東京大学の「精神病学教室」の研究論文をみると,『精神病者私宅監置ノ実況及ビ其統計的観察』で知られる呉秀三教授が,「神経膠ト血管トノ関係ニツイテ」とか「麻痺狂患者ノ脳髄ナル希有ナル病變」などを執筆しており,呉秀三教授が決して私宅監置の研究だけをしていたわけではなく,当時がいかに脳研究全盛であったかをうかがい知ることができる15).しかし,当時の研究では特異的な所見を得ることができず,精神疾患は神経病理学者の墓場であるといわれた.
その後,精神病理学が進歩し,説明と了解といった方法論が整備された.一方では,十分な安全対策や倫理的配慮なしに精神外科が行われたり,優生学の考えに基づいて,患者の人権が侵害される事態が起きた.
戦後,ニュルンベルク綱領を嚆矢として,ヘルシンキ宣言に至り,研究倫理が確立した.そして,1950年前後の向精神薬の発見が,神経精神薬理学を勃興させた.そんななかで,世界的な反精神医学的な動きがあり,それと連動して日本でも1968~1969年頃の大学紛争においては,東京大学の精神医学講座が反体制運動の拠点となった.その後,国際診断基準の確立,治療アルゴリズムの確立といったエビデンス精神医学や,神経科学の進歩に伴う精神疾患解明の進展などにより,何とか科学的な精神医学へと再び舵を切っているのが現状である.
前述の通り,科学としての精神医学は,元来,病理学を基盤とした医学をめざしてきた.実際,歴史のなかではアルツハイマー病,進行麻痺,ナルコレプシーなど,次々と精神疾患の病理学的基盤が明らかにされてきたというべきであろう.
一方,脳病変が見つからない疾患に対しては,言語的アプローチ(説明と了解)により進展してきたが,こうしたアプローチから発展した精神疾患の操作的定義に基づくpragmaticな科学(臨床試験など)と,原因解明に関するmechanisticな科学(神経科学)の2つが,乖離しているのが現状である.
II.精神疾患研究の最近の進歩
精神・神経疾患の研究方法としては,臨床研究は,血液のDNAを調べるゲノム研究と,MRIなどで脳を調べる脳画像研究に二極分化している.
病気の現場である細胞については,動物モデル,iPS細胞,死後脳研究などを用いた基礎研究が中心となるが,こうした研究を行っている精神医学教室は少ない.
そんななかで,精神疾患研究は最近,長足の進歩を遂げている.
1.大規模ゲノム研究
ポリジェニックリスクスコア(polygenic risk score:PRS)を用いた臨床診断・症状との関連研究が盛んに進められ,PRSと治療反応性の研究から,これまでの臨床研究で示唆されてきたことが確認されている.また,他疾患との遺伝的相関なども盛んに研究されている.
日本では,2000年代は精神疾患のゲノム研究が世界から大きく取り残されていたが,自閉スペクトラム症(autism spectrum disorder:ASD)の国内262トリオ家系(海外と合わせ4,244家系)のエクソーム解析で,病因パスウェイ(神経発生,転写制御など)を同定した研究14),統合失調症2,458名,ASD 1,108名のコピー数多型(copy number variation:CNV)解析で病態パスウェイの重なりを同定した研究7),国内の双極性障害患者2,964名のゲノムワイド関連解析(genome-wide association study:GWAS)で関連遺伝子(FADS1/2)を同定した研究1),双極性障害の79家系でde novo変異の役割を発見した研究4)など,インパクトのある研究が報告されるようになった.
2.大規模MRIデータ解析
世界的には,国際コンソーシアム(Evidence-based Network for the Interpretation of Germline Mutant Alleles:ENIGMA)による大規模(数千人)研究によるイメージングジェネティクス解析などが行われている.また,fMRIのニューロフィードバック療法など,脳画像法の治療への応用も始まっている.
日本でも,ASDおよび定型発達者181名のrs-fcMRI(resting-state functional connectivity MRI)データで判別法を作成し,米国の88名の独立群で確認した研究17),統合失調症884名,対照群1,680名のMRIデータで淡蒼球左右差を発見した研究11),双極性障害・うつ病計1,531名のMRIデータでうつ病と双極性障害の脳形態差異を同定した研究8)などが報告されている.
3.新規治療法の開発
うつ病に対して,即効性はあるが副作用もあるS-ケタミンをFDAが承認したことや,産後うつ病に対してニューロステロイドbrexanoloneをFDAが承認したことなど,画期的な新薬が生まれ,向精神薬業界は再び活気づいている感がある.ただし,後者は60時間の点滴で367万円かかるなど,がんや希少疾患の領域で問題となっている高額な医療が精神医学でも今後課題となっていく可能性がある.
日本発の研究では,うつ病に対するR-ケタミンの有効性を示した研究が注目され,すでに米国で臨床試験(千葉大,特開2018-145207)が開始されている.また,ASDに対するオキシトシン点鼻剤の医師主導臨床試験18)も行われている.
4.モデル動物を用いた神経回路解析
マウスを用いた神経回路操作法やin vivo 2光子イメージングなどが格段に進歩し,精神疾患研究への応用が進んでいる.例えば,ケタミンによるスパイン増加がうつ症状に関連10)するといったインパクトの高い研究成果も報告されている.
また,ASDモデルマウスでスパイン動態の変化を報告した研究2)や,うつ状態を反復するモデルマウスから双極性障害の原因神経回路を同定した研究などが報告されている3).
5.新規診断法
ASDにおいて,表情の定量解析12)が臨床試験バイオマーカーとして有用であるとの研究や,AMPA受容体を標的とした新規陽電子放射断層撮像(positron emission tomography:PET)プローブの開発と疾患横断的な応用が進められている9).
その他,モバイルデバイスによるライフログのAI解析による診断や,マルチオミックスによるバイオマーカーの網羅的探索などに期待がかかっている.
6.データ駆動型研究
多くのゲノムデータが蓄積するにつれて,データ駆動型研究も盛んになり,臨床研究のデータをもとに,細胞レベルの事象が研究できるようになってきた.
一例を挙げれば14),ASDのトリオ家系におけるde novo変異の研究で,原因細胞種や候補薬物を同定した研究がある.ASD患者で機能障害de novo変異が見いだされた遺伝子のリストを,さまざまなデータベースと照らし合わせることで,多くのことがわかってきた.まず,ヒトの脳部位ごとの遺伝子発現データベースと対照することで,前部帯状回に発現している遺伝子に変異が多いことがわかった.次に,発達期における脳の遺伝子発現変化のデータベースと照らし合わせることで,胎生中期に大脳皮質で発現する遺伝子に変異が多いことがわかった.また,細胞ごとの遺伝子発現データベースとの比較では,D1受容体発現medium spiny neuronに発現する遺伝子に変異が多いことがわかった.さらに,数千種類の薬剤による遺伝子発現変化のデータベースとつきあわせることで,変異がみられた遺伝子の発現を低下させる薬を探索した結果,バルプロ酸が見いだされた.これは妊娠中のバルプロ酸服用が児のASDリスクを増加させるという疫学的事実と一致する.逆に,変異がみられた遺伝子群を増加させる薬を探索した結果,ジゴキシンが見いだされ,ドラッグ・リポジショニング研究の可能性が示唆された.
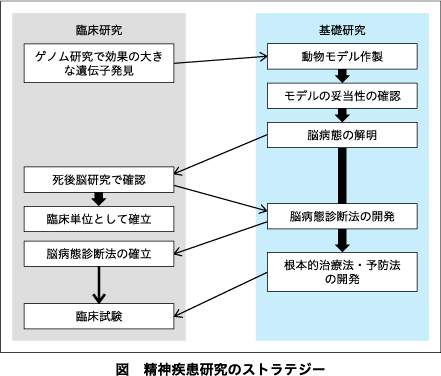
III.精神疾患研究のストラテジー―双極性障害研究を例として―
著者は,20年間理化学研究所で研究を行うなかで,次第に精神疾患研究のストラテジーを意識するようになった.
図に示す通り,まずはゲノム研究で効果の大きな遺伝子を発見し,その動物モデルを作製し,モデルの妥当性を検証する.次に,モデルを用いて脳病態を解明し,これを死後脳で確認する.脳の病理所見で疾患を定義できるようになれば,新たな臨床単位となる.これをもとに,脳病態を診断する方法を開発するとともに,新規治療法を開発し,将来の臨床試験は,脳病態をもとに選択した患者を対象とすることになる.
このように,臨床研究と基礎研究の相互的な連携が,精神疾患の解明には重要である.
われわれは,20世紀に,双極性障害患者の磁気共鳴スペクトロスコピーにより脳エネルギー代謝障害を見いだし,患者死後脳でミトコンドリアDNA(mtDNA)欠失の蓄積を見いだした.その後,ミトコンドリア病患者の構造化面接で双極性障害と診断される患者が多いことが報告され,双極性障害患者のなかに,ミトコンドリア病の原因変異(POLG,ANT1)が多いことを見いだした.
そこで,POLGの変異体を脳特異的に発現するモデルマウスを作製したところ,自発性,反復性の,DSM-5の抑うつエピソードの基準を満たす状態を呈し,三環系抗うつ薬により躁転様行動を示すことがわかった.このマウスで,mtDNA欠失が蓄積している脳部位を探索した結果,視床室傍核に最も多く蓄積していることがわかった.マウスにおいて,視床室傍核の神経回路操作で同様のエピソードが出現したことから,この部位が双極性障害の原因脳部位として浮かび上がった.視床室傍核は,セロトニン神経からの強い投射があり,最近,セロトニンが高濃度に存在する部位であることがわかった13).視床室傍核からは,双極性障害で体積減少が指摘されてきた前部帯状回,島皮質への投射に加え,恐怖にかかわる扁桃体,報酬にかかわる側坐核の両方に,同一の神経突起が枝分かれして投射していることが報告されている5).
先述のモデルマウスでは,視床室傍核が過剰興奮性を示している可能性があり,だとすれば,ネガティブな情動,ポジティブな情動の両方の部位を刺激する作用をもつ視床室傍核が過剰興奮性を示していることによって,情動と認知のバランスが情動に傾きすぎた状態が双極性障害ととらえることができるかもしれない.
今後は,死後脳において視床室傍核の病変の有無を確認し,脳病態に基づく双極性障害の再定義をめざすとともに,病変がみられるようであれば,in vivoでの診断法開発をめざしていく必要がある.もし神経回路病態が明らかになれば,将来的には,ニューロフィードバックなどの神経回路を標的とした治療法の開発も視野に入ってくるであろう.
おわりに
精神疾患は社会的に影響が大きな疾患であり,精神医学は100年前から,困難ななかでも,病理学に根差した医学であろうとし続けてきた.精神疾患の解明には,基礎と臨床の相互的連携が必要であり,こうした連携により,精神疾患の原因解明研究は進んでおり,いずれ脳画像・ゲノムなどの生物学的診断が可能になると期待される.
なお,本論文に関連して開示すべき利益相反はない.
1) Ikeda, M., Takahashi, A., Kamatani, Y., et al.: A genome-wide association study identifies two novel susceptibility loci and trans population polygenicity associated with bipolar disorder. Mol Psychiatry, 23 (3); 639-647, 2018![]()
2) Isshiki, M., Tanaka, S., Kuriu, T., et al.: Enhanced synapse remodelling as a common phenotype in mouse models of autism. Nat Commun, 5; 4742, 2014![]()
3) Kasahara, T., Takata, A., Kato, T. M., et al.: Depression-like episodes in mice harboring mtDNA deletions in paraventricular thalamus. Mol Psychiatry, 21 (1); 39-48, 2016![]()
4) Kataoka, M., Matoba, N., Sawada, T., et al.: Exome sequencing for bipolar disorder points to roles of de novo loss-of-function and protein-altering mutations. Mol Psychiatry, 21 (7); 885-893, 2016![]()
5) Kirouac, G. J.: Placing the paraventricular nucleus of the thalamus within the brain circuits that control behavior. Neurosci Biobehav Rev, 56; 315-329, 2015![]()
6) 厚生労働省: 平成29年 (2017) 患者調査の概況. 2019 (https://www.mhlw.go.jp/toukei/saikin/hw/kanja/17/index.html) (参照2022-03-16)
7) Kushima, I., Aleksic, B., Nakatochi, M., et al.: Comparative analyses of copy-number variation in autism spectrum disorder and schizophrenia reveal etiological overlap and biological insights. Cell Rep, 24 (11); 2838-2856, 2018![]()
8) Matsuo, K., Harada, K., Fujita, Y., et al.: Distinctive neuroanatomical substrates for depression in bipolar disorder versus major depressive disorder. Cereb Cortex, 29 (1); 202-214, 2019![]()
9) Miyazaki, T., Nakajima, W., Hatano, M., et al.: Visualization of AMPA receptors in living human brain with positron emission tomography. Nat Med, 26 (2); 281-288, 2020![]()
10) Moda-Sava, R. N., Murdock, M. H., Parekh, P. K., et al.: Sustained rescue of prefrontal circuit dysfunction by antidepressant-induced spine formation. Science, 364 (6436); eaat 8078, 2019![]()
11) Okada, N., Fukunaga, M., Yamashita, F., et al.: Abnormal asymmetries in subcortical brain volume in schizophrenia. Mol Psychiatry, 21 (10); 1460-1466, 2016![]()
12) Owada, K., Okada, T., Munesue, T., et al.: Quantitative facial expression analysis revealed the efficacy and time course of oxytocin in autism. Brain, 142 (7); 2127-2136, 2019![]()
13) Sugiyama, E., Guerrini, M. M., Honda, K., et al.: Detection of a high-turnover serotonin circuit in the mouse brain using mass spectrometry imaging. iScience, 20; 359-372, 2019![]()
14) Takata, A., Miyake, N., Tsurusaki, Y., et al.: Integrative analyses of de novo mutations provide deeper biological insights into autism spectrum disorder. Cell Rep, 22 (3); 734-747, 2018![]()
15) 「東京大学精神医学教室120年」編集委員会編: 東京大学精神医学教室120年. 新興医学出版社, 東京, 2007
16) World Health Organization: The Global Burden of Disease 2015. (https://www.int/healthinfo/global-burden-disease/GLOBALYmethods-2000-2015.pdf) (参照2022-03-16)
17) Yahata, N., Morimoto, J., Hashimoto, R., et al.: A small number of abnormal brain connections predicts adult autism spectrum disorder. Nat Commun, 7; 11254, 2016![]()
18) Yamasue, H., Okada, T., Munesue, T., et al.: Effect of intranasal oxytocin on the core social symptoms of autism spectrum disorder: a randomized clinical trial. Mol Psychiatry, 25 (8); 1849-1858, 2020![]()