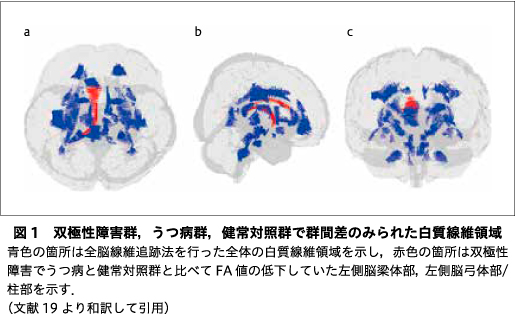
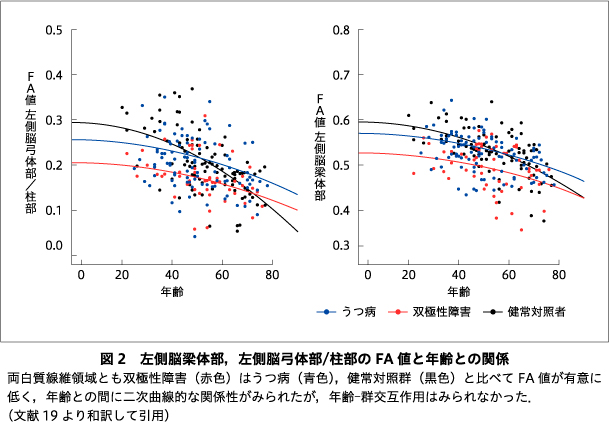
近年の拡散テンソル画像(DTI)研究によって,気分障害の白質統合性低下が比較的一致した所見として示されているが,うつ病と双極性障害間では統合性低下を生じる白質領域の多くは共通し,変化する領域の疾患特異性は乏しいことが指摘されている.また,白質統合性は,健常者では30歳代後半まで増加しその後加齢とともに低下することが知られているが,うつ病と双極性障害を直接比較した報告はなく,両疾患間の白質統合性低下と年齢の関係性に疾患特異性があるか否かは明らかではない.そこで,われわれは両疾患の白質統合性を年齢効果を調整したうえで直接比較した.本稿ではその研究成果について紹介した.双極性障害58名,うつ病101名,ならびに健常対照者98名を対象にDTI撮像を実施し,全脳線維追跡法によって画像解析し,算出した各領域のFA値を応答変数,年齢,群を説明変数に一般化線形モデルを用いて群主効果を有する白質線維領域を求め,年齢―群交互作用の検定を行った.主要な白質線維領域でFA値に対する年齢の主効果を示し,いずれも年齢とともにFA値は低下していた.これらの領域のうち,左側脳梁体部,左側脳弓体部/柱部において群の主効果を示し,事後検定によって双極性障害ではうつ病,健常対照群に比較し有意なFA値の低下を示した.一方で年齢―群交互作用はいずれの白質線維領域にも認められなかった.これらの結果から,双極性障害では早期段階からすでに左側脳梁体部,左側脳弓体部/柱部において白質統合性低下が生じている可能性が示唆された.
2)京都大学大学院工学研究科
はじめに
拡散テンソル画像(diffusion tensor imaging:DTI)は生体内の水分子の拡散情報を定量化することにより,微細な白質構造を非侵襲的に評価可能とするMRI画像法である15).近年の大規模DTI研究によって,双極性障害7)20)22)およびうつ病2)3)11)17)30)の白質統合性低下が一致した所見として示されている.一方,統合性低下の多くは共通した白質線維領域で認められ,両疾患間における疾患特異性は十分明らかになっていない.また,健常者の白質統合性は30歳代後半まで増加し,その後二次関数的に低下する加齢性変化が知られている13).統合失調症では4)14)31),この白質統合性の経年的変化が健常者とは異なることが明らかになってきているが,ENIGMA MDDワーキンググループによる大規模コホート研究で,うつ病患者においても,脳梁膝部,脳梁体部,脳弓/分界条,矢状層(下前頭後頭束,下縦束)で,健常者に比較し加齢に伴う統合性の低下が加速することが報告されている27).一方,双極性障害患者に関しては,鉤状束,帯状束の海馬領域,脳梁膝部および脳梁膨大部において加齢に伴う統合性の低下が加速することが報告されているが5)26),加えて20~30歳代の若い年齢層ですでに脳梁や下縦束などの白質統合性低下が認められ,白質構造の形成不全の可能性についても指摘されている28).このように精神疾患における白質統合性低下を年齢との関連性の観点からみると,若年の段階からすでに統合性低下が生じている場合と,一旦は健常者と同様に白質形成が進むものの,発症以降に急速に低下が進行していく場合の,2通りの機序が推測される.白質統合性への年齢の要因を検討することは,白質構造変化の理解を深めるうえで重要と考えられるが,双極性障害とうつ病で白質統合性の経年的変化を直接比較した報告はなく,両疾患間の白質統合性変化と年齢の関係性に疾患特異性があるか否かは明らかではない.そこでわれわれは,両疾患の白質構造について年齢効果を調整したうえで直接比較し,その差異を明らかにするとともに,白質統合性と年齢との関連について検討を行った19).本稿では,その研究成果について紹介する.
I.研究の方法および結果
1.対象と研究方法
DSM-5診断基準に基づき診断された,双極性障害患者(58名,年齢範囲22~76歳,平均年齢52.0±12.5歳,罹患期間範囲1~51年,平均罹患期間17.4±11.1年)とうつ病患者(101名,年齢範囲25~78歳,平均年齢50.5±13.2歳,罹患期間範囲1~37年,平均罹患期間7.6±7.3年),および健常対照者(98名,年齢範囲20~77歳,平均年齢53.7±13.2歳)を対象とした.すべての患者はうつ病期もしくは寛解期であり,画像撮像時に薬物治療を受けていた.本研究は,広島大学倫理委員会に承認されたプロトコールに従い,十分なインフォームド・コンセントを得て守秘義務を遵守し匿名性の保持に配慮して行った.
DTIはSiemens社製3テスラのMAGNETOM Verioを用いて撮像を行った.撮像パラメーターはTR(repetition time)/TE(echo time):8,100/94 ms,b値:1,000 s/mm2,MPG(motion probing gradient):30軸,field of view:240×240 mm2,voxel size:2.5×2.5×2.5 mm3,image matrix=96×96とした.脳画像解析はOkuhata, S.ら21)の全脳線維追跡法の方法に従い行った.Johns Hopkins大学の提供する脳白質アトラスをもとに主要な白質線維領域を左右54ヵ所に区分し,その全領域を対象に線維追跡を行い,白質統合性を示す指標として,拡散異方性を示すFA(fractional anisotropy)値を算出した.各領域のFA値を応答変数,年齢,群を説明変数に一般化線形モデルを用いて群主効果を有する白質領域を求め,年齢-群交互作用の検定も行った.群の主効果を有する白質領域については多重比較検定を行った.さらに疾患群を対象にして罹患期間を説明変数とし,同様のモデルを用いて罹患期間-群交互作用の検定を行った.Bonferroni補正で多重比較補正を行い,有意水準はP=0.05/54=0.00093に設定した.また性別,病期,薬物負荷指数を共変量として設定した.
2.結 果
FA値に対する年齢と群の効果については,全群において脳梁をはじめとした複数の白質線維領域でFA値に対する年齢の主効果を示し,いずれも年齢とともにFA値は低下していた.左側脳梁体部(P<0.001),左側脳弓体部/柱部(P<0.001)において群の主効果を示し,事後検定によって双極性障害ではうつ病,健常対照群に比較し有意なFA値の低下を示した.一方で年齢-群交互作用はいずれの白質線維領域にも認められなかった(図1, 図2,19)).また,FA値に対する罹患期間と群の効果については,罹患期間,群の主効果,罹患期間-群交互作用ともにいずれの白質線維領域にも認められなかった.
II.考察
本研究の結果,双極性障害はうつ病,健常対照群に比較し左側脳弓体部/柱部と左側脳梁体部で白質統合性が有意に低下しており,同領域では年齢の主効果がみられる一方で交互作用は認められなかった.また罹病期間については主効果や交互作用は認められなかった.以上の結果は,双極性障害の左側脳弓体部/柱部と左側脳梁体部における白質統合性の早期段階での低下を示しているものと考えられた.精神疾患に生じる白質統合性低下の発生機序は依然明らかではないが,その仮説として神経発達に関連する遺伝的な脆弱性が存在し,発症前や発症初期の白質構造に形成不全が生じているとする脆弱性モデルと,発症後のコルチゾール高値,神経炎症活性などの生化学的変化がグリア細胞やミエリン鞘に神経毒性として作用し,疾患の進行とともに統合性低下が生じるとする神経毒性モデルの提唱がなされている23).双極性障害の早期段階での白質統合性低下を示した本結果は,双極性障害の白質統合性低下が脆弱性モデルによって説明できる可能性を示唆するものと考えられた.遺伝子研究では,ミエリン鞘形成過程に重要なDISC1,ニューレグリン1(NRG1)の遺伝子変異が双極性障害の病態にかかわる可能性が指摘されており12),白質統合性低下の発生機序に対する遺伝的関与について,より一層の研究の進展が期待される.脳弓,脳梁はともに左右半球を連絡する交連線維であるが,交連線維は連合線維や投射線維に比較し早期に成熟することが知られている.特に脳弓は乳幼児期や幼児期から形成が始まり,20歳になる前にはFA値がピークに達する,白質線維領域のなかで最も成熟の早い白質領域である9)16).本研究は,双極性障害の白質統合性低下が早期に成熟する白質線維領域で優先的に生じる可能性を示唆しているかもしれない.脳梁は左右大脳半球の相同な皮質間を連絡し半球間の情報を転送,統合する,最大の白質構造である8)16).また,脳弓は大脳半球の内側部に位置する交連および投射線維であり海馬の主要な遠心性神経を構成している6)25).これら交連線維の統合性低下は半球間の情報伝達の効率性を低下させると考えられる.Shobe, E. R.24)は彼の情動処理モデルのなかで交連線維を介した大脳半球の協調的活動の重要性について述べており,そこでは右半球において快・不快情動刺激の識別と理解を直接的に仲介し,その情動に関する情報は脳梁を介して左半球に共有されると提唱している.双極性障害に生じる半球間の情報伝達の非効率化が,情動に関する情報交換を妨げ,情動調整不全をまねく可能性が考えられる33).さらに脳梁と脳弓は作動記憶,問題解決能力,記憶力などの認知機能にかかわると考えられている1)25)34).うつ病と双極性障害はともに広範な領域での認知機能障害を有することが知られているが,両疾患を対象にしたメタ解析では,注意や記憶力などの領域は双極性障害でより重度に障害されると報告されている10)29)32).われわれが行ったうつ病と双極性障害を対象にした白質統合性と認知機能についての検討では18),双極性障害の脳梁体部の白質統合性低下と注意維持障害との関連が示唆された.双極性障害の脳梁体部の白質統合性がうつ病に比較し早期段階で低下していること,またその低下の程度が注意機能障害と関連していることは,両疾患の病因・病態を理解していくうえで重要な知見と考えられ,さらなる検証を重ねていきたい.
おわりに
本研究では双極性障害とうつ病の白質統合性の経年的変化の評価方法に各年齢群と白質統合性の関連性を比較した横断研究を用いたが,この知見を検証するためには同一対象者を継続的に追跡する縦断研究の実施が必要と考えられる.また全脳線維追跡法を用いることで主要な白質線維領域を網羅的に評価できたが,統計的に標本数が十分とはいえず,病期,薬剤,重症度,エピソード回数などの臨床的背景因子の影響については十分には検討できなかった.さらに,白質統合性の経年的変化の機能的意義についても検討が必要である.すでにわれわれの施設では縦断データの収集を進めており,今後は縦断研究を進めるなかで,背景因子の影響や臨床的意義についての検討も行っていきたいと考えている.
なお,本論文に関連して開示すべき利益相反はない.
本論文はPCN誌に掲載された最新の研究論文19)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
1) Aggleton, J. P., O'Mara, S. M., Vann, S. D., et al.: Hippocampal-anterior thalamic pathways for memory: uncovering a network of direct and indirect actions. Eur J Neurosci, 31 (12); 2292-2307, 2010![]()
2) Bracht, T., Linden, D., Keedwell, P.: A review of white matter microstructure alterations of pathways of the reward circuit in depression. J Affect Disord, 187; 45-53, 2015![]()
3) Chen, G., Hu, X., Li, L., et al.: Disorganization of white matter architecture in major depressive disorder: a meta-analysis of diffusion tensor imaging with tract-based spatial statistics. Sci Rep, 6; 21825, 2016![]()
4) Cropley, V. L., Klauser, P., Lenroot, R. K., et al.: Accelerated gray and white matter deterioration with age in schizophrenia. Am J Psychiatry, 174 (3); 286-295, 2017![]()
5) Dev, S. I., Nguyen, T. T., McKenna, B. S., et al.: Steeper slope of age-related changes in white matter microstructure and processing speed in bipolar disorder. Am J Geriatr Psychiatry, 25 (7); 744-752, 2017![]()
6) Douet, V., Chang, L.: Fornix as an imaging marker for episodic memory deficits in healthy aging and in various neurological disorders. Front Aging Neurosci, 6; 343, 2015![]()
7) Duarte, J. A., DeAraújo, E. S. J. Q., Goldani, A. A., et al.: Neurobiological underpinnings of bipolar disorder focusing on findings of diffusion tensor imaging: a systematic review. Braz J Psychiatry, 38 (2); 167-175, 2016![]()
8) Fabri, M., Polonara, G.: Functional topography of human corpus callosum: an FMRI mapping study. Neural Plast, 2013; 251308, 2013![]()
9) Hermoye, L., Saint-Martin, C., Cosnard, G., et al.: Pediatric diffusion tensor imaging: normal database and observation of the white matter maturation in early childhood. Neuroimage, 29 (2); 493-504, 2006![]()
10) Iverson, G. L., Brooks, B. L., Langenecker, S. A., et al.: Identifying a cognitive impairment subgroup in adults with mood disorders. J Affect Disord, 132 (3); 360-367, 2011![]()
11) Kelly, S., van Velzen, L. S., Veltman, D., et al.: White matter microstructural differences in major depression: meta-analytic findings from enigma-MDD DTI. Biol Psychiatry, 81 (Suppl10); S381, 2017
12) Kloiber, S., Rosenblat, J. D., Husain, M. I., et al.: Neurodevelopmental pathways in bipolar disorder. Neurosci Biobehav Rev, 112; 213-226, 2020![]()
13) Kochunov, P., Glahn, D. C., Lancaster, J., et al.: Fractional anisotropy of cerebral white matter and thickness of cortical gray matter across the lifespan. Neuroimage, 58 (1); 41-49, 2011![]()
14) Kochunov, P., Glahn, D. C., Rowland, L. M., et al.: Testing the hypothesis of accelerated cerebral white matter aging in schizophrenia and major depression. Biol Psychiatry, 73 (5); 482-491, 2013![]()
15) Le Bihan, D.: Looking into the functional architecture of the brain with diffusion MRI. Nat Rev Neurosci, 4 (6); 469-480, 2003![]()
16) Lebel, C., Gee, M., Camicioli, R., et al.: Diffusion tensor imaging of white matter tract evolution over the lifespan. Neuroimage, 60 (1); 340-352, 2012![]()
17) Liao, Y., Huang, X., Wu, Q., et al.: Is depression a disconnection syndrome? Meta-analysis of diffusion tensor imaging studies in patients with MDD. J Psychiatry Neurosci, 38 (1); 49-56, 2013![]()
18) Masuda, Y., Okada, G., Takamura, M., et al.: White matter abnormalities and cognitive function in euthymic patients with bipolar disorder and major depressive disorder. Brain Behav, 10 (12); e01868, 2020![]()
19) Masuda, Y., Okada, G., Takamura, M., et al.: Age-related white matter changes revealed by a whole-brain fiber-tracking method in bipolar disorder compared to major depressive disorder and healthy controls. Psychiatry Clin Neurosci, 75 (2); 46-56, 2021![]()
20) Nortje, G., Stein, D. J., Radua, J., et al.: Systematic review and voxel-based meta-analysis of diffusion tensor imaging studies in bipolar disorder. J Affect Disord, 150 (2); 192-200, 2013![]()
21) Okuhata, S., Hodaka, M., Nakai, R., et al.: An atlas-based whole-brain fiber-tracking method with automatic setting of an optimal starting plane in all parcels. J Neurosci Biomed Eng, 6; 28-36, 2018
22) Pauling, M., Henry, C., Sarrazin, S., et al.: Bipolar disorder and white matter microstructure: ENIGMA bipolar disorder fractional anisotropy DTI results. Eur Neuropsychopharmacol, 27 (Suppl 4); S839-840, 2017
23) Peters, B. D., Karlsgodt, K. H.: White matter development in the early stages of psychosis. Schizophr. Res, 161 (1); 61-69, 2015![]()
24) Shobe, E. R.: Independent and collaborative contributions of the cerebral hemispheres to emotional processing. Front Hum Neurosci, 8; 230, 2014![]()
25) Thomas, A. G., Koumellis, P., Dineen, R. A.: The fornix in health and disease: an imaging review. Radiographics, 31 (4); 1107-1121, 2011![]()
26) Toteja, N., Guvenek-Cokol, P., Ikuta, T., et al.: Age-associated alterations in corpus callosum white matter integrity in bipolar disorder assessed using probabilistic tractography. Bipolar Disord, 17 (4); 381-391, 2015![]()
27) van Velzen, L. S., Kelly, S., Isaev, D., et al.: White matter disturbances in major depressive disorder: a coordinated analysis across 20 international cohorts in the ENIGMA MDD working group. Mol Psychiatry, 25 (7); 1511-1525, 2020![]()
28) Versace, A., Ladouceur, C. D., Romero, S., et al.: Altered development of white matter in youth at high familial risk for bipolar disorder: a diffusion tensor imaging study. J Am Acad Child Adolesc Psychiatry, 49 (12); 1249-1259, 2010![]()
29) Willis, M. W., Benson, B. E., Ketter, T. A., et al.: Interregional cerebral metabolic associativity during a continuous performance task (Part I): healthy adults. Psychiatry Res, 164 (1); 16-29, 2008![]()
30) Wise, T., Radua, J., Nortje, G., et al.: Voxel-based meta-analytical evidence of structural disconnectivity in major depression and bipolar disorder. Biol Psychiatry, 79 (4); 293-302, 2016![]()
31) Wright, S., Kochunov, P., Chiappelli, J., et al.: Accelerated white matter aging in schizophrenia: role of white matter blood perfusion. Neurobiol Aging, 35 (10); 2411-2418, 2014![]()
32) Xu, G., Lin, K., Rao, D., et al.: Neuropsychological performance in bipolar I, bipolar II and unipolar depression patients: a longitudinal, naturalistic study. J Affect Disord, 136 (3); 328-339, 2012![]()
33) Yasuno, F., Kudo, T., Matsuoka, K., et al.: Interhemispheric functional disconnection because of abnormal corpus callosum integrity in bipolar disorder type II. BJPsych Open, 2 (6); 335-340, 2016![]()
34) Zahr, N. M., Rohlfing, T., Pfefferbaum, A., et al.: Problem solving, working memory, and motor correlates of association and commissural fiber bundles in normal aging: a quantitative fiber tracking study. Neuroimage, 44 (3); 1050-1062, 2009![]()