統合失調症研究にとって脳は中心的な標的器官である.脳は重量比にして体重の50分の1程度の小さな臓器だが,膨大なエネルギー(全グルコースの5分の1,酸素の4分の1)を必要とする.膨大な酸素とグルコースは,ミトコンドリアの酸化的リン酸化という代謝過程を経てATPにエネルギー転換され,これは神経細胞の静止膜電位の維持に消費される.脳は高度に機能分化した局所の集合体でもあり,血管系と神経系が緻密に連携することで,エネルギーを細部へ効果的に届けることができている.この脳の特徴―グルコース酸化と神経血管カップリング―から,統合失調症の代謝と構造について概説し,統合失調症研究の再現性問題を解決する方策の1例として,症候群から抽出した糖化ストレスを伴う小亜種を紹介した.脳構造を個人差レベルまで識別できる解像度をもつ放射光ナノCT法により,脳血管と神経細胞の構造アンバランスを同定した自験例を,統合失調症のエネルギー代謝研究への応用例として紹介した.
2)東京都立松沢病院
3)名古屋大学大学院医学系研究科
4)高エネルギー加速器研究機構
5)東海大学工学部生命化学科
受理日:2022年5月16日
はじめに
Griesinger, W. が「精神病は脳病である」と述べて以来,神経科学は脳を統合失調症の病態における標的臓器として研究してきた.西丸によればKraepelin, E. はPsychiatrie第5版(1896年)において,粘液水腫,クレチン症,麻痺性痴呆とともに,早発性痴呆を代謝病のなかに位置づけた30).臺によればKraepelinは,自然科学の発展によっていずれ早発性痴呆の神経病理所見が確立されることを期待した45).本稿では,Kraepelinが重視した代謝と構造という視点から,まず脳におけるグルコース酸化という代謝を神経細胞の活動電位の機序から解説し,次に脳のモジュール構造という特徴が脳血流の調節によって機能的に支えられている点について述べる.さらに統合失調症研究の再現性の困難が症候群として異種性に由来する可能性にふれ,異種性の解決をめざし個体差レベルの構造を解析する目的で,大型放射光施設SPring-8を用いたわれわれの研究も紹介して考察を加えた.
I.グルコース酸化とATP
ヒト成人の脳重量は体重のおよそ2%程度にすぎないが,心拍出量の約16%(54 mL/100 g/分)が脳血流となり,全身で消費されるグルコースの約20%(5.4 mg/100 g/分),酸素供給量の25%(3.3 mL/100 g/分)が脳活動で消費される17).これらの酸素は生理的条件下でほとんどがグルコースの酸化―ATP合成―に利用される33).
神経細胞は,ATPを使って細胞内のNa+を細胞外へ排出することで細胞内外にイオン差を発生させ(Na+:細胞外150 mmol/L,細胞内15 mmol/L),細胞内を外側より-60 mV電位差のある環境(分極状態)に維持している5).こうした環境があって初めて,電位依存性Na+チャネルを開くだけ―エネルギーは要らない―で,濃度勾配の圧力で細胞外からNa+が流れ込み,2 msという短時間で電位を90 mVプラス方向に変化(脱分極)させることが可能となる(活動電位).
また,サイクリックAMPはドパミン,ノルアドレナリン,セロトニン,アセチルコリンなどで変化する重要なG蛋白質受容体のセカンドメッセンジャーだが,これもまたATPから合成される.
基質であるグルコース1分子から,解糖系によりATPが2分子,TCA回路で36分子が生成される.解糖系の最終産物であるピルビン酸は,酸素がなければ乳酸やエタノールに変化するが,酸素が存在するとTCA回路に入る.そのため,低酸素状態の脳では解糖系が約8倍も促進されるが,乳酸が蓄積するため脳機能は著明に低下してしまう.活動電位に備えて分極状態を維持することは脳の生命線であり,加えてサイクリックAMPを合成するためにも大量の酸素とグルコースが必要となる.
1950年に,林が統合失調症患者の動静脈血を解析してグルコース酸化の特徴的変化を世界に先駆けて見いだしていた12).脳のグルコースはTCA回路によって,最終的に炭酸ガスと水に分解される.林は,統合失調症患者と対照あわせて200名の内頸静脈・総頸動脈から,同時採血で得たのべ377検体を用いて,炭酸ガスと酸素の分圧,乳酸,ピルビン酸,還元型グルタチオンなどを測定した.林は炭酸ガスと酸素を5種類の分圧比に分類して臨床像と解析し,統合失調症の病態に糖代謝と内呼吸の異常が関連することを示した.ATP産生がミトコンドリアの酸化的リン酸化によることが明らかにされたのは1960年代であり,林自身はグルコース酸化とATPには言及していないが,脳をエネルギー器官として着目したのは林の慧眼であったといえよう.
では,脳におけるこの巨大なグルコース酸化という代謝が,どのようにして血管システムにより支えられているのか,脳の構造的特徴に注目して次項で解説する.
II.モジュール構造と神経血管カップリング
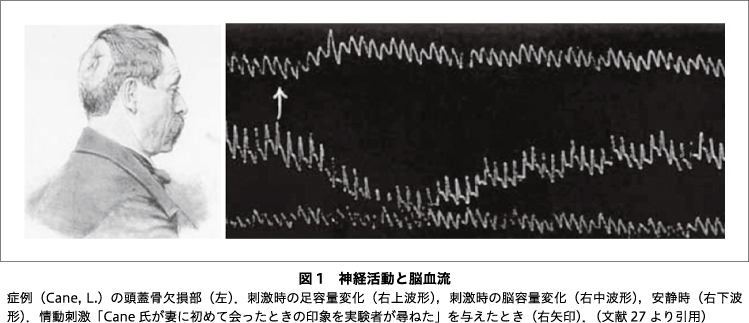
もう1つの脳の特徴が,モジュール構造である.脳は高度に機能分化した局所の集合体であり33),活動中のモジュールがATPを効率的に補充できるよう,局所の脳血流が増加する34).このことを最初に見いだしたのはイタリアの生理学者Mosso, A. で,脳外科手術後に頭蓋骨の欠損部分から大脳皮質の体積(oncograph)を計測し,精神活動に伴って局所的に増加することを見いだして,局所脳循環は精神神経活動によって変動すると発表した27)(図1).Mossoの10年後,Roy, C. S. らは,イヌの坐骨神経を刺激すると体性感覚野の血流が増加することを見いだし,神経活動による代謝亢進と局所脳血流の増加が関連すると推論した35).
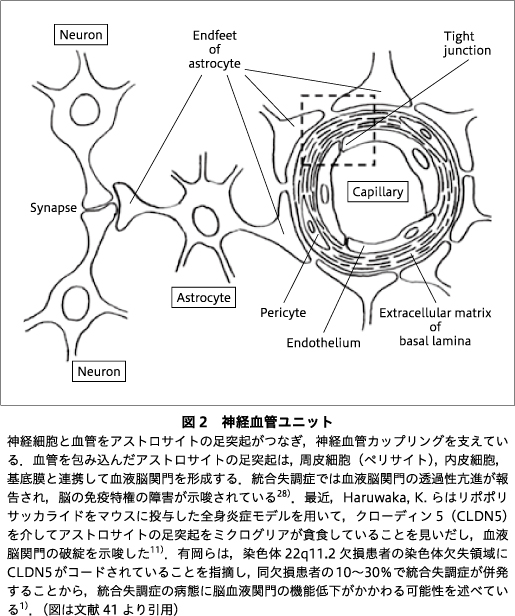
神経活動中の局所血流の増加は,神経血管カップリング(neurovascular coupling)と呼ばれる.アストロサイトが足突起でシナプスを包み込み,同一細胞の別の足突起が微小血管の周囲を取り囲む構造(図2)は神経血管ユニット(neurovascular unit)と名づけられ,この構造から神経活動に伴う毛細血管の口径調節にアストロサイトの関与が示唆されている.神経血管カップリングがグルコース酸化,ATP産生と関連することは,Leybaert, L. により2005年に報告されている19).後述するようにケーブル理論といった信号減衰モデルやレイノルズ応力など流体力学により,神経血管ユニットの構造がグルコース酸化などに影響する可能性が考えられた.
1974年に,Ingvar, D. H. らが13),安静時の統合失調症で前頭部血流の低下(hypofrontality)を報告して以来,課題遂行時を含むさまざまな状況で神経血管カップリングの低下が報告されてきた.脳血流の灌流画像(perfusion weighted image)と放射性ラベルされたフルオロデオキシグルコース(fluorodeoxyglucose:FDG)を用いた,FDG-PETに関する19研究(統合失調症557例,対照584例)のメタ解析によると,島皮質前部,前帯状皮質背側部,被殻,側頭極など10部位で糖代謝と脳血流のカップリングに患者・対照間で差が認められた40).しかし,hypofrontalityについては再現性に異論を示すニューロイメージング研究や22),存在を疑問視する報告もある46).これは,遺伝子研究や治療薬の臨床試験でもみられた統合失調症研究に特徴的な再現性問題―Schizophrenia is the graveyard of neuropathologists. Plum, 1972―である.この再現性問題は,統合失調症が縦断経過を重視したKraepelinによって「慢性に進行する」という類型として提案された症候群であるため,自然種のような均質性と明瞭な境界をもたず,すなわち異種性を内包する可能性が考えられる.われわれは異種性を解決するために,操作的診断基準を用いてリクルートされた対象を,疾患単位より小さい亜種までいったん解体し,そこから均質な集合に再構成する必要があると考えた.このストラテジーを極限まで突きつめれば,解体は個体差レベルまでの細分化に行きつく.次項では,より小さな亜種として細胞レベルの研究を紹介する.
III.細胞の形の個性
脳の神経細胞に限らず,細胞あるいは組織レベルの個人差は,病理学や組織学の分野で研究されてきた.例えば,腫瘍組織は症例によって異なる構造を示すが,このような腫瘍の組織学的な多様性は,遺伝子レベルの個人差に由来するとされている7).また,腫瘍細胞のおかれた不均質な微小環境が予後に影響し,それが各症例の遺伝子変異と関係しているという報告もある29).腫瘍組織に限らず,生物学的構造の個体差に関しては,細胞分裂と関連づけて古くから議論されているが4),細胞自体の形の個性については研究が進んでいない.これは,培養細胞の形に培地環境が影響するように,内在する生物学的性質と外来性の物理化学要因の区別が難しいためと考える.また,細胞が本来は三次元的な存在であるにもかかわらず,顕微鏡下では観察者が決めた方向から二次元的に観察するしかないことや,見る方向に依存した分解能の異方性38)も理由の1つと思われる.では,統合失調症の神経細胞の形態がどのように検討されてきたのか次項で述べ,その次の項目では神経細胞形態の個体差まで迫った自験例について紹介する.
IV.統合失調症の神経病理
先述のような制約のもとでも,精神疾患による神経細胞の構造変化について,さまざまな視点から研究が進められてきた.立津は,1960年に統合失調症例の脳組織切片を網羅的に検討し,先述の自験例でも認めた神経突起の蛇行を含む,いくつかの特徴を報告している43).さらに電子顕微鏡像から超微形態の解析を進め,神経細胞のゴルジ体の顕著な発達や,オリゴデンドロサイトと軸索の境界に集積した特異な構造などに着目して,何らかの酵素の機能不全により神経細胞の代謝が阻害された可能性を指摘している23).また,統合失調症例での神経細胞の形態については,特に海馬を対象に研究が行われてきており,統合失調症例と対照例で細胞体の大きさが異なるとの知見50)や,錐体細胞の配向が有意に異なることが報告されている18).しかし,これらの結果は再現が困難な面もあり,現状では,統合失調症の神経病理学に関してコンセンサスがあるとは言い難い10).
一方で,CTスキャンやMRIによるマクロな視点では,統合失調症における脳室拡大15)21)や,特定の領野の萎縮16)39)42)など,一定の理解が進んでいる.これらのマクロな脳の変化が報告されながら,脳組織を構成する細胞や血管の知見が蓄積してこないのは,統合失調症が巨大な症候群で異種性を有することと,三次元的存在である脳組織を薄切切片とし,顕微鏡で一方向からのみ観察してきたことが要因と考えられる.脳組織を三次元のままで,あらゆる方向から撮像する方法としてはCTスキャンがあるが,残念ながらミリ単位の分解能であり,細胞や神経突起を見ることはできない.これを可能にしたのが,図3で示した放射光マイクロCT法・ナノCT法24)である.この方法では,通常の1千倍から1万倍の解像度のCTスキャンを行うことで,細胞内小器官まで可視化できる.二次元像で解像度が1万倍ということは,X線の輝度としてはその二乗の1億倍でなくてはならない.このため,大型放射光施設SPring-8(兵庫県)やAdvanced Photon Source(米イリノイ州)などの特別な測定施設が必要となる.
冒頭で述べたように統合失調症の病態における中心的臓器として脳を考えるとき,莫大なグルコース酸化を行う代謝臓器であること,モジュール構造という他の臓器にない機能別に特化された部分の集合体臓器であることから,神経血管カップリングこそエネルギー・インフレーションにある脳の正常な稼働を保証している.先にふれたように統合失調症研究の再現性問題という100年余の課題に挑むには,個体差レベルまでの解像度によって血管と神経の解析をする必要性があり,SPring-8はそれに応える能力を備えた解析装置なのである.
V.脳組織の構造的特徴
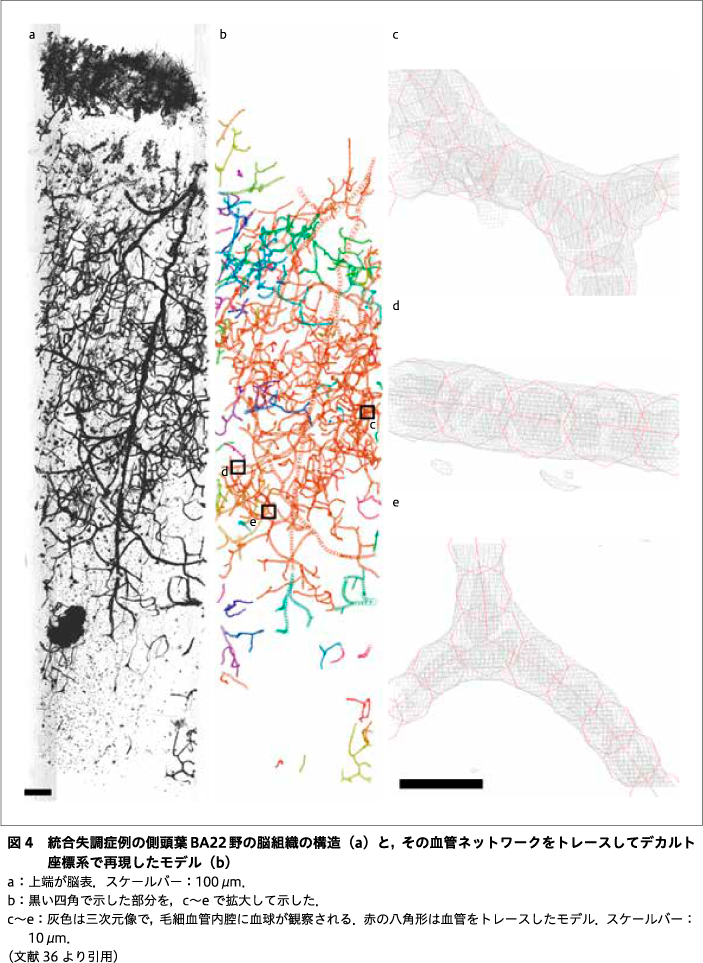
われわれは,この放射光マイクロCT法・ナノCT法を,統合失調症例と年齢・性別を合わせた対照例の剖検脳組織に適用して,三次元構造を解析する研究を進めてきた14)25)26)36).脳組織検体は書面により遺族の同意を得たうえで,プライバシー保護に配慮して取り扱っている.ヒト組織を研究に用いることに関しては,東海大学「人を対象とする研究」に関する倫理委員会,同医学部臨床研究審査委員会,東京都医学総合研究所倫理審査委員会,米国アルゴンヌ国立研究所Institutional Biosafety Committeeを含め,関連各機関での審査を経て,認められた条件に従って研究を実施している.脳の部位としては,統合失調症において体積変化8)31)48)が報告されている前帯状回Brodmann area 24(BA24)と上側頭回BA22を対象とした.脳組織は定法に従ってゴルジ法で染色し,ホウケイ酸ガラスのキャピラリ中でエポキシ樹脂に包埋して,測定検体とした.ゴルジ法では,主に神経細胞と血管が銀により染色され,X線像として可視化される.それら三次元像で描出された構造をトレースして,神経ネットワークや血管ネットワークをデカルト座標系で再現し,その座標値から,微分幾何学を応用して構造の特徴を検討した.図4に,血管ネットワークをトレースした様子を示す.毛細血管には,内腔にひしめく血球が見てとれる36).
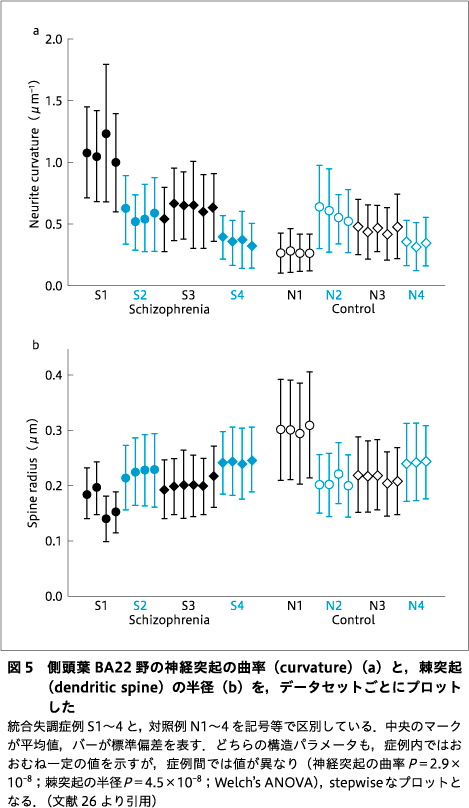
神経ネットワークは,同様の解析を合計89の構造で行い,統合失調症4例と対照4例で構造パラメータの統計を求めた25)26).図5に結果の1例を示す.ここでは,神経突起の曲がり方〔曲率(curvature)〕と,シナプスを形成する棘突起(dendritic spine)の太さ(半径)を,データセットごとにプロットした.これら構造は神経科学では別個に扱われているが,どちらの構造パラメータも,症例内では平均値・標準偏差が似通っているのに対し,症例が異なると値も異なり,プロットが不連続な階段状になっている.すなわち,これらの構造パラメータは症例ごとに固有の値をもつ可能性を示唆している.
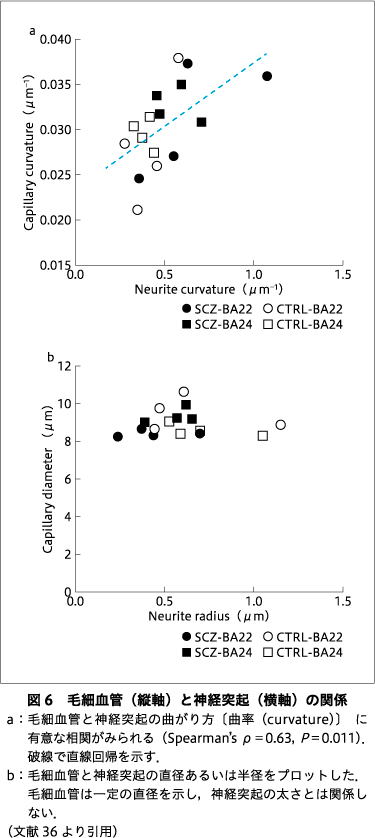
神経突起と毛細血管の構造パラメータを調べてみると,それらの間に相関が見つかった.図6では,神経突起と毛細血管の曲がり方(曲率)や太さの関係を合計24の構造をもとに検討している36).統合失調症例・対照例をとおして,神経突起と毛細血管の曲率は有意な相関を示し(図6a),神経細胞と血管の間に構造上の関係性がある可能性を支持した.神経細胞は,神経板から分化する外胚葉由来の細胞であるが,血管は骨や筋肉とともに主に中胚葉から形成される.このような発生の初期に分かれた細胞の構造が相関を示すということは,曲率が原腸胚より前の未分化な段階で決定される基盤的性質である可能性が示唆される.一方で,毛細血管の太さは神経突起の太さによらず一定であり(図6b),曲率条件よりは非基盤的な性質―血管を血球が通過するという物理的な制約条件―によって,毛細血管の太さが規定されていると思われる.
VI.統合失調症での神経突起と毛細血管
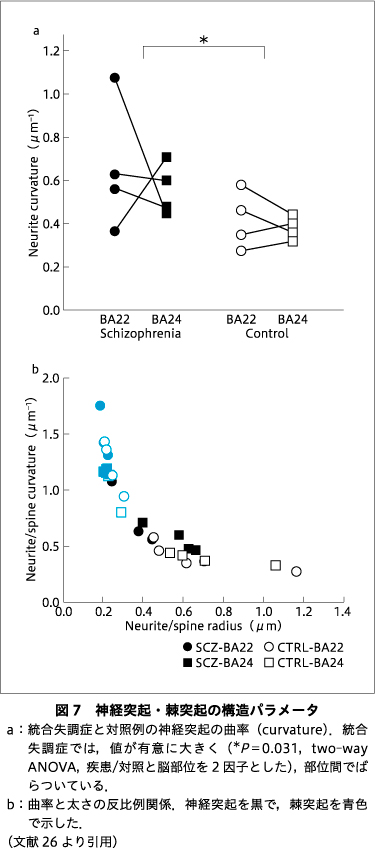
このような方法で求めた神経突起の曲率は,統合失調症例では対照例より有意に高い値を示した(図7a).一般に,細いワイヤは鋭く曲がるが,太いワイヤは緩やかにしか曲がらない.同様のことが神経突起でもみられ,神経突起の曲率は太さと反比例していた(図7b).したがって,統合失調症では曲率が高い=神経突起が細いことになり,脳部位の間のばらつきも対照より大きい傾向にある(図7a).細い神経突起は活動電位の伝達には不利であり9),その脳組織は機能が減弱している可能性がある.
また,統合失調症で神経突起の曲率が高いということは,図6aの相関から,毛細血管も曲がって蛇行していることになる.一方で,図6bより毛細血管の太さは一定であることが示されている.すなわち,太さが一定で蛇行する血管は,まっすぐな血管よりも組織中の体積比率が大きくなり,血流と代謝のバランスに影響しうる.また,流体は蛇行するとレイノルズ応力により粘性を増大し流量の低下を招くので47),統合失調症の脳では対照より血流が低下している可能性が示唆された.統合失調症では脳の血流2)20)32)や代謝3)40)に変化が報告されているが,このような毛細血管の構造上の特徴がかかわっている可能性がある.
一方,曲率の大きい神経突起ほど細い線維だった.神経線維に伝わる活動電位は,細胞膜を通した軸索内外のイオン交換の物理的なモデル(ケーブル理論)によって説明できる6).このモデルでは,神経線維をケーブルに模して,活動電位の伝達を記述する.これに従えば,神経線維が結ぶ2点間の走行距離は,曲率が大きいほど蛇行するので遠くなり,線維は細くなるので活動電位が減衰する.すなわち,統合失調症では対照より遠い神経細胞との連絡が阻害される可能性を示唆している.
脳血管と神経突起の構造についてSPring-8を用いて解析した結果から,統合失調症の脳がエネルギー・インフレーションに促進的な構造変化が示唆される.これらは,放射光ナノCT法が脳組織構造の解明に有益であることを超えて,統合失調症の脳のエネルギー代謝の理解に役立ちえることを示している.
これらわれわれの研究は,1万本あまりの神経突起と全長1 m超の血管を10年かけて解析してきた結果である.解析では盲検化して症例がわからない状態で行っており,事前の作業仮説を設定することなく,得られた結果をすべて用いて,構造パラメータをあるがままに検討した脳組織のデータサイエンスである.今後さらに症例数を重ねる必要はあるが,これまでのデータが指し示すところは,脳組織の構造には個性があり,それが統合失調症で有意に変化する,ということである.これら研究は,米国アルゴンヌ国立研究所からプレスリリースされ37),すでにさまざまな反響を呼んでいる.統合失調症での脳組織のマクロな変化8)15)16)21)31)39)42)48)は広く認められつつあるが,その一因として,脳組織のなかで神経突起や毛細血管が構造変化している25)26)36)とするのが,われわれの主張である.
おわりに
人体は血管系を介した物質輸送によって支えられる生化学的活動系であり,生命機能は毛細血管を介した物質交換とエネルギー消費によって営まれる.したがって,脳のようなエネルギー消費の大きな器官では,毛細血管の構造もそれに対応した「つくり」となる.しかし,脳の毛細血管の三次元構造については,依然として未知の部分が多い.上述の自験例では,大脳皮質の毛細血管の構造を曲率などの幾何学的パラメータに基づいて検討したが,これは他の組織・器官も含めて初めての報告であり,細胞構造との相関が検討されたのも初めてである.このような研究が可能となったのは,三次元構造を忠実に再現できる放射光CT法によるところが大きい14).他の精神疾患・神経疾患にもこの方法を適用し,毛細血管がどんな幾何学的性質を示すのか,検討が必要と思われる.また,エネルギー消費の小さい他の組織・器官と脳を比較したときに,どんな違いが現れるのか,興味がもたれる.
放射光CT法による脳の微細構造の解析では,毛細血管と神経突起の構造相関が示された.これは,エネルギー供給と情報処理の関係性を脳組織の構造のなかに見いだした,と言い換えることができる.すなわち,病理的な情報処理が毛細血管の構造に影響しうることを意味しており,統合失調症ではそれが恒常的に進行している可能性がある.放射光CT法による解析は,現状では上述の統合失調症4例と対照4例にとどまっており,症例数を重ねて知見を充実させることが急務である.また,エネルギー供給からグルコース酸化などを経て神経活動につながる過程について,統合失調症でどのように変化しているのか,両構造をつなぐ生化学的メカニズムの検討も求められる.
そのようなメカニズムとして,1つの仮説を最後に提示したい.ミトコンドリアにおけるグルコース酸化の過程で発生する活性酸素種は,非生理的な糖化修飾―糖化ストレス―を生じる.われわれは腎機能障害と糖尿病―糖化の二大原因―がない統合失調症と対照を検討し,この条件でも糖化ストレスを示した統合失調症が4割いることを見いだし,このなかにミトコンドリアの制御分子(frataxin制御能をもつマイクロRNA)をコードするDNA領域を欠失した症例が含まれた49).服薬の影響を除外するために,糖化ストレスを遺伝学・環境的に再現したマウスの脳を解析したところ,ミトコンドリアに関連する遺伝子の発現が最も大きく変動していた44).このような糖化ストレスは,細胞活動への影響を通して血管や神経細胞の形を変化させる可能性があり,血管と神経細胞の構造相関にかかわるメカニズムの1つになりうる.
以上の結果は,Kraepelinが統合失調症の病態で重視した,代謝と構造の変化を支持していると考える.
注
著者の一人の水谷は,梅雨入り前の6月初めに大型放射光施設SPring-8でヒト脳組織の測定実験を行っていた.一般に,このタイプの施設は24時間体制で運用されるため,それに合わせて24時間体制で交代で実験を行う.そのときの水谷の担当は,午前1時から午後1時の午前シフトであった.そんな毎日を1週間程続けたある日,午後のチームに引継ぎを行いながら,その日に見た神経細胞について,あれこれ話をしていた(図3).すると交代チームが言うには,「それ,前に測定したA症例と同じですね」である.実はその朝の検体は確かにA症例であり,データ量を補うために追加測定を行っていた.A症例は容易に言語化できる構造上の特徴があり,それを会話で伝えるだけで個人識別できた1例である.このように,神経細胞の三次元構造には個人ごとに特徴があって,見る人が見れば,まるで顔のように,個人を特定できる性格を有している.
利益相反
糸川と新井は,ピリドキサミンの統合失調症治療薬への応用に関し特許を保有している.尾崎は以下の企業とのCOI関係がある.
奨学寄附金:大塚製薬株式会社,株式会社地球快適化インスティテュート,大日本住友製薬株式会社,エーザイ株式会社,田辺三菱製薬株式会社,Meiji Seikaファルマ株式会社,アステラス製薬株式会社
講演謝金:大塚製薬株式会社,エーザイ株式会社,武田薬品工業株式会社,ファイザー株式会社,ヤンセンファーマ株式会社,Meiji Seikaファルマ株式会社,アステラス製薬株式会社,MSD株式会社
原稿謝金:ファイザー株式会社
共同研究:株式会社地球快適化インスティテュート,大日本住友製薬株式会社
他の著者は,本論文に関連して開示すべき利益相反はない.
謝 辞 本発表で取り上げた研究は,山本義郎(東海大学理学部),竹腰進,井野元智恵,中村直哉,坪井秋男,大澤資樹(東海大学医学部),井手聡一郎,池田和隆(東京都医学総合研究所),上椙真之,竹内晃久,上杉健太朗,寺田靖子(JASRI/SPring-8),Vincent De Andrade,Francesco De Carlo(米国アルゴンヌ国立研究所)各氏との共同研究である.加えて多くの方々のご指導お力添えをいただいており,すべて挙げられなくて恐縮ながら,関係各位に心より謝意を表する.本研究の一部は,文部科学省科学研究費(21611009,25282250,25610126,18H04040,20H03608),日本医療研究開発機構脳科学研究戦略推進プログラム(発達障害・統合失調症等の克服に関する研究,JP20dm0107087,JP20dm0207075,JP20dk0307081,JP20ak0101113,JP18dm0107088,JP19dm0107088,JP20dm0107088,JP19dm0107108),ならびに関連各機関からの各種補助により行っている.大型放射光施設SPring-8における実験は,以下の課題により実施している:2011A0034,2013A1384,2013A1865,2014A1057,2014B1083,2015A1160,2015B1101,2016B1041,2017A1143,2018A1164,2018B1187,2019A1207,2019B1087,2020A0614,2020A1163,2021A1175.米国アルゴンヌ国立研究所Advanced Photon Sourceにおける放射光実験は,研究課題GUP-45781およびGUP-59766により実施している.本研究は米国エネルギー省科学局の共同利用施設であるAdvanced Photon Sourceの設備等を利用している.当該施設は,アルゴンヌ国立研究所によりエネルギー省科学局に対して協定番号DE-AC02-06CH11357のもとに運営されている.Synchrotron radiation experiments at the Advanced Photon Source were performed under GUP-45781 and GUP-59766. This research used resources of the Advanced Photon Source, a U. S. Department of Energy(DOE)Office of Science User Facility operated for the DOE Office of Science by Argonne National Laboratory under Contract No. DE-AC02-06CH11357.
1) 有岡祐子, 加藤大輔, 和氣弘明ほか: 精神疾患の新たな展望―グリア破綻から見る病態―. BRAIN and NERVE, 73 (7); 787-794, 2021
2) Catafau, A. M., Parellada, E., Lomeña, F. J., et al.: Prefrontal and temporal blood flow in schizophrenia: resting and activation technetium-99m-HMPAO SPECT patterns in young neuroleptic-naive patients with acute disease. J Nucl Med, 35 (6); 935-941, 1994![]()
3) Chou, P. H., Koike, S., Nishimura, Y., et al.: Distinct effects of duration of untreated psychosis on brain cortical activities in different treatment phases of schizophrenia: a multi-channel near-infrared spectroscopy study. Prog Neuropsychopharmacol Biol Psychiatry, 49; 63-69, 2014![]()
4) Conklin, E. G.: The basis of individuality in organisms from the standpoint of cytology and embryology. Science, 43 (1111); 523-527, 1916![]()
5) Ganong, W. F.: Review of Medical Physiology, 22nd ed. McGraw-Hill Medical, New York, 2005 (岡田泰伸, 赤須 崇, 上田陽一ほか訳: 医科生理学展望, 原書22版. 丸善出版, 東京, 2006)
6) Gasser, H. S., Grundfest, H.: Axon diameters in relation to the spike dimensions and the conduction velocity in mammalian a fibers. Am J Physiol, 127 (2); 393-414, 1939
7) Gerdes, M. J., Sood, A., Sevinsky, C., et al.: Emerging understanding of multiscale tumor heterogeneity. Front Oncol, 4; 366, 2014![]()
8) Haijma, S. V., Van Haren, N., Cahn, W., et al.: Brain volumes in schizophrenia: a meta-analysis in over 18,000 subjects. Schizophr Bull, 39 (5); 1129-1138, 2013![]()
9) Hansson, B. S., Hallberg, E., Löfstedt, C., et al.: Correlation between dendrite diameter and action potential amplitude in sex pheromone specific receptor neurons in male Ostrinia nubilalis (Lepidoptera: Pyralidae). Tissue Cell, 26 (4); 503-512, 1994![]()
10) Harrison, P. J.: The neuropathology of schizophrenia: a critical review of the data and their interpretation. Brain, 122 (Pt4); 593-624, 1999![]()
11) Haruwaka, K., Ikegami, A., Tachibana, Y., et al.: Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nat Commun, 10 (1); 5816, 2019![]()
12) 林 道倫: 精神分裂病の研究. 精神経誌, 51 (6); 193-245, 1950
13) Ingvar, D. H., Franzén, G.: Abnormalities of cerebral blood flow distribution in patients with chronic schizophrenia. Acta Psychiatr Scand, 50 (4); 425-462, 1974![]()
14) 糸川昌成, 大島健一, 新井 誠ほか: 放射光ナノトモグラフィ法を用いた統合失調症における神経細胞の構造変化の解析―脳組織の幾何学―. 精神経誌, 121 (12); 926-940, 2019
15) Jernigan, T. L., Zatz, L. M., Moses, J. A. Jr., et al.: Computed tomography in schizophrenics and normal volunteers. I. Fluid volume. Arch Gen Psychiatry, 39 (7); 765-770, 1982![]()
16) Kaur, A., Basavanagowda, D. M., Rathod, B., et al.: Structural and functional alterations of the temporal lobe in schizophrenia: a literature review. Cureus, 12 (10); e11177, 2020![]()
17) Kety, S. S.: Blood flow and metabolism of the human brain in health and disease. Trans Stud Coll Physicians Phila, 18 (3); 103-108, 1950![]()
18) Kuroki, N., Matsushita, M.: Pyramidal cell orientation and density in the hippocampus in schizophrenia. Neuropathology, 18 (2); 235-241, 1998
19) Leybaert, L.: Neurobarrier coupling in the brain: a partner of neurovascular and neurometabolic coupling? J Cereb Blood Flow Metab, 25 (1); 2-16, 2005
20) Liu, F., Zhuo, C., Yu, C.: Altered cerebral blood flow covariance network in schizophrenia. Front Neurosci, 10; 308, 2016![]()
21) Malla, A. K., Mittal, C., Lee, M., et al.: Computed tomography of the brain morphology of patients with first-episode schizophrenic psychosis. J Psychiatry Neurosci, 27 (5); 350-358, 2002![]()
22) Mathew, R. J., Duncan, G. C., Weinman, M. L., et al.: Regional cerebral blood flow in schizophrenia. Arch Gen Psychiatry, 39 (10); 1121-1124, 1982![]()
23) Miyakawa, T., Sumiyoshi, S., Deshimaru, M., et al.: Electron microscopic study on schizophrenia. Mechanism of pathological changes. Acta Neuropathol, 20 (1); 67-77, 1972![]()
24) Mizutani, R., Suzuki, Y.: X-ray microtomography in biology. Micron, 43 (2-3); 104-115, 2012![]()
25) Mizutani, R., Saiga, R., Takeuchi, A., et al.: Three-dimensional alteration of neurites in schizophrenia. Transl Psychiatry, 9 (1); 85, 2019![]()
26) Mizutani, R., Saiga, R., Yamamoto, Y., et al.: Structural diverseness of neurons between brain areas and between cases. Transl Psychiatry, 11 (1); 49, 2021![]()
27) Mosso, A.: Ueber den Kreislauf des Blutes im Menschlichen Gehirn: Untersuchungen. Veit, Leipzig, 1881
28) Najjar, S., Pahlajani, S., De Sanctis, V., et al.: Neurovascular unit dysfunction and blood-brain barrier hyperpermeability contribute to schizophrenia neurobiology: a theoretical integration of clinical and experimental evidence. Front Psychiatry, 8; 83, 2017![]()
29) Natrajan, R., Sailem, H., Mardakheh, F. K., et al.: Microenvironmental heterogeneity parallels breast cancer progression: a histology-genomic integration analysis. PLoS Med, 13 (2); e1001961, 2016![]()
30) 西丸四方: 精神分裂病の歴史と分類. 精神分裂病 (横井 晋, 佐藤壱三ほか編). 医学書院, 東京, p.1-22, 1975
31) Olabi, B., Ellison-Wright, I., McIntosh, A. M., et al.: Are there progressive brain changes in schizophrenia? A meta-analysis of structural magnetic resonance imaging studies. Biol Psychiatry, 70 (1); 88-96, 2011![]()
32) Oliveira, Í. A. F., Guimarães, T. M., Souza, R. M., et al.: Brain functional and perfusional alterations in schizophrenia: an arterial spin labeling study. Psychiatry Res Neuroimaging, 272; 71-78, 2018![]()
33) 大月三郎: 脳のエネルギー代謝とアミノ酸代謝. 血液と脈管, 2 (10); 1345-1350, 1971
34) Raichle, M. E.: Circulatory and metabolic correlates of brain function in normal humans. Handbook of Physiology: The Nervous System, vol. V (ed by Plum, F.). Oxford University Press, New York, p.643-674, 1987
35) Roy, C. S., Sherrington, C. S.: On the regulation of the blood-supply of the brain. J Physiol, 11 (1-2); 85-158, 1890![]()
36) Saiga, R., Uesugi, M., Takeuchi, A., et al.: Brain capillary structures of schizophrenia cases and controls show a correlation with their neuron structures. Sci Rep, 11 (1); 11768, 2021![]()
37) Salles, A.: Seeing schizophrenia: X-rays shed light on neural differences, point toward treatment. 2021 (https://www.anl.gov/article/seeing-schizophrenia-xrays-shed-light-on-neural-differences-point-toward-treatment) (参照2022-04-02)
38) Schermelleh, L., Heintzmann, R., Leonhardt, H.: A guide to super-resolution fluorescence microscopy. J Cell Biol, 190 (2); 165-175, 2010![]()
39) Shenton, M. E., Dickey, C. C., Frumin, M., et al.: A review of MRI findings in schizophrenia. Schizophr Res, 49 (1-2); 1-52, 2001![]()
40) Sukumar, N., Sabesan, P., Anazodo, U., et al.: Neurovascular uncoupling in schizophrenia: a bimodal meta-analysis of brain perfusion and glucose metabolism. Front Psychiatry, 11; 754, 2020![]()
41) 髙橋愼一: Neurovascular unitにおける血液脳関門の役割. 分子脳血管病, 9 (3); 275-281, 2010
42) Tang, J., Liao, Y., Zhou, B., et al.: Decrease in temporal gyrus gray matter volume in first-episode, early onset schizophrenia: an MRI study. PLoS One, 7 (7); e40247, 2012![]()
43) 立津政順: 分裂病脳にみられる特異な組織病理像―終脳における所見―. 精神経誌, 62 (10); 20-43, 1960
44) Toriumi, K., Berto, S., Koike, S., et al.: Combined glyoxalase 1 dysfunction and vitamin B6 deficiency in a schizophrenia model system causes mitochondrial dysfunction in the prefrontal cortex. Redox Biol, 45; 102057, 2021![]()
45) 臺 弘: 精神分裂病問題の歴史と展望. 精神分裂病Ia(懸田克躬, 島薗安雄ほか責任編集, 現代精神医学体系10 A1). 中山書店, 東京, p.3-28, 1981
46) Walter, H., Wunderlich, A. P., Blankenhorn, M., et al.: No hypofrontality, but absence of prefrontal lateralization comparing verbal and spatial working memory in schizophrenia. Schizophr Res, 61 (2-3); 175-184, 2003![]()
47) 渡辺勝利, 大成博文, 斎藤 隆: 低レイノルズ数における蛇行水路乱流の組織構造. 土木学会論文集, 467 (II-23); 9-18, 1993
48) Wright, I. C., Rabe-Hesketh, S., Woodruff, P. W., et al.: Meta-analysis of regional brain volumes in schizophrenia. Am J Psychiatry, 157 (1); 16-25, 2000![]()
49) Yoshikawa, A., Kushima, I., Miyashita, M., et al.: Dysregulation of post-transcriptional modification by copy number variable microRNAs in schizophrenia with enhanced glycation stress. Transl Psychiatry, 11; 331, 2021![]()
50) Zaidel, D. W., Esiri, M. M., Harrison, P. J.: Size, shape, and orientation of neurons in the left and right hippocampus: investigation of normal asymmetries and alterations in schizophrenia. Am J Psychiatry, 154 (6); 812-818, 1997![]()