認知症患者では睡眠の問題として,不眠症状に加え日中の過度な眠気や居眠り,過眠症状を訴えることが臨床上しばしば経験される.加齢性変化において睡眠時間および睡眠の質に問題をきたし,いわゆる不眠や過眠症状をきたす要因としては,身体疾患に伴う症状,ストレス,うつ病などの精神疾患,服用薬剤の影響などさまざまな要因が重複して存在することが特徴であり,このような生理学的加齢性変化に認知症における神経変性過程が加わり,対処困難な睡眠の問題を呈するものと考えられる.さらに,認知症の各原因疾患において,出現しやすい睡眠の問題や,睡眠時無呼吸症候群,概日リズム睡眠障害,レム睡眠行動異常症などの睡眠関連疾患の合併頻度は原因疾患間で共通点と相違点が存在し,睡眠の問題の見立てや対応方法も異なってくる.また近年,認知症の発症にかかわる基礎研究に加え,さまざまな臨床・疫学研究の結果から認知症の危険因子の知見が蓄積されつつある.睡眠に関しても,その生理学的役割のなかで認知機能の維持,脳内蓄積物の排出などに関与し,その障害が認知症の症状修飾および神経変性過程に影響を与えていることが示唆されている.動物およびヒトを対象とした睡眠時間奪取や睡眠の質への介入研究により,睡眠不足・不眠と認知症との関連が多数報告される一方で,日中の過度な眠気や睡眠時間の延長についても,観察研究から認知症との関連について知見が蓄積されつつある.認知症における眠気・過眠への対応としては,睡眠衛生の改善,不眠・過眠の直接原因の緩和,合併する睡眠関連疾患への評価・介入を包括的に行うことが重要である.
2)大阪大学医学部附属病院睡眠医療センター
はじめに
認知症の臨床現場では,しばしば睡眠の問題に遭遇し,その対処に困難をきたすことが経験される.なかでも日中の過度な眠気や過眠は,夜間不眠や昼夜逆転といった睡眠覚醒リズムの著しい破綻をきたし,家族の介護負担や医療スタッフの疲弊にもつながる症状である.本稿では,認知症における眠気・過眠の見立ての注意点と対応とともに,認知症におけるその症状の意義について述べたい.
I.加齢に伴う睡眠の変化
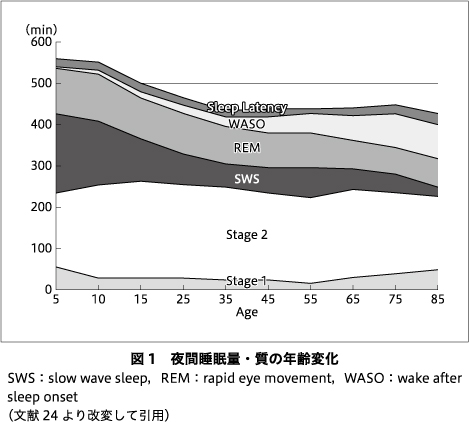
認知症の原因疾患は,その多くが加齢に伴い罹患率は増加する.このため,認知症患者における眠気や過眠の要因として,生理学的な加齢性変化の正しい理解は重要と考えられる.個人差はあるものの,中年期以降になると夜間の総睡眠時間は徐々に減少傾向を示し,睡眠構築自体も特に深睡眠の割合が減少する.一方で,若い頃同様に就床時間を維持しようとする高齢者は多く,その結果,長い夜間睡眠時間を無理にとろうとするために睡眠効率の低下につながる.このように加齢性変化によって睡眠の量・質いずれもが低下をきたす24)(図1).
また,睡眠の問題を引き起こす要因は多様であり,痛み・かゆみ・呼吸苦などの身体症状を示す身体疾患,うつ病や不安障害などの精神疾患,ライフイベントに起因する心理的要因,嗜好品や服用薬剤など,多岐にわたる.高齢者では若年期に比して身体合併症を有していることが多く,このような要因が複数存在しやすい状況にある.実際に,高齢者では併存症の数が増えるほど,睡眠の質が低下することが報告されている9).さらに,このような二次的な睡眠の問題が生じやすいだけではなく,高齢者では,睡眠時無呼吸症候群,レストレス・レッグズ症候群(restless legs syndrome:RLS),レム睡眠行動異常症(REM sleep behavior disorder:RBD)といったさまざまな睡眠関連疾患(睡眠の特殊な病気)の罹患率も上昇することが知られており,より睡眠の問題を経験しやすくなる.
II.認知症の原因疾患による睡眠の問題の差異
認知症の原因疾患はその発症機序が異なり,障害される認知機能や出現しやすい認知症の行動・心理症状(Behavioral and Psychological Symptoms of Dementia:BPSD)も原因疾患により相違がみられる.同様に,睡眠障害についても原因疾患によってその出現しやすい睡眠障害のタイプや有症率が異なることが報告されている11)26).各認知症の原因疾患でみられる睡眠障害は,比較的疾患特異性の高い睡眠関連疾患の合併と,不眠・過眠症状や生理学的な加齢性変化,環境要因の影響が合わさり,最終表現型として睡眠の問題として顕在化しているものと考えられる3).特にヒトにおいては動物モデルと異なり,患者ごとの睡眠障害が,神経変性病理,病期,併存する身体疾患や服用薬剤,睡眠覚醒リズムに与える環境要因など,複雑な相互作用のもとで表現型として出現しているため,明確なメカニズムの解明を困難にしている側面は否めない.
海外の報告では,アルツハイマー型認知症(Alzheimer’s disease:AD)では軽度から中等度の患者で25%程度,中等度から重度の患者で50%程度の患者に何らかの睡眠障害が認められるとされている25).一方,Clinical Dementia Rating scale(CDR)0.5(MCI相当)の極早期からレビー小体型認知症(dementia with Lewy bodies:DLB)では睡眠障害有症率がより高いことが先行研究で示されている13).このような報告からも,認知症の原因疾患において,睡眠障害が発現する機序はかなり異なる部分があるものと考えられる.
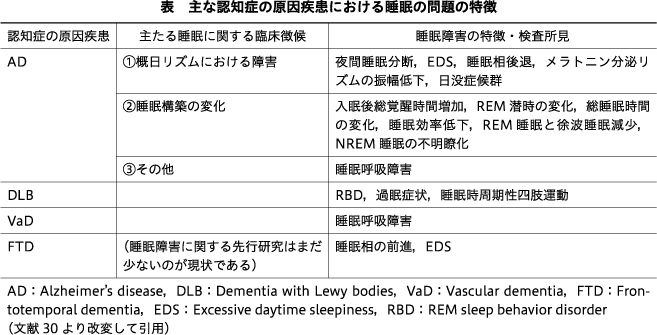
さらに,個々の原因疾患に伴いやすい睡眠関連疾患の存在についても検討がなされている.例えば,RBDはαシヌクレイノパチー,特にDLBやパーキンソン病においてしばしば認められる睡眠関連疾患であり10)16),かつ2017年に改訂された臨床診断基準では,RBD自体がDLBの中核的特徴として取り上げられている20).逆に,ADなどタウオパチーを主病態とする疾患では,RBDの頻度は大幅に低くなる傾向がある10).一方,ADや前頭側頭型認知症(frontotemporal dementia:FTD)においては生物学的な概日リズム機構の障害が睡眠障害の要因の1つとして想定されている1)14).この概日リズム機構の障害パターン自体も,ADとFTDでは同一環境下において深部体温リズム位相の方向性に相違が認められ,概日リズム機構の障害機序は異なるものと考えられる12).このように認知症の原因疾患には比較的併存しやすい特徴的な睡眠の問題が存在することも重要なポイントとなる30)(表).
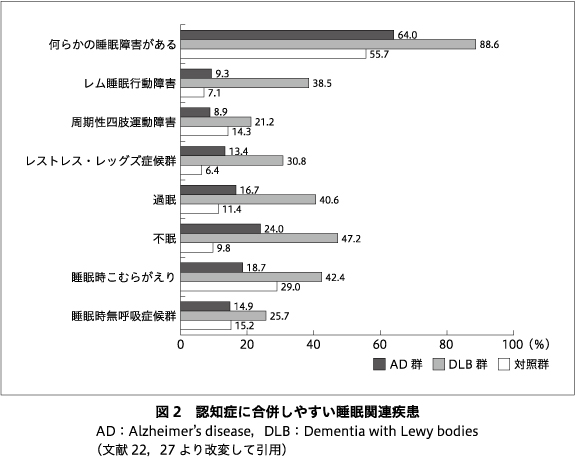
Guarnieri, B.らは11),AD,脳血管性認知症(vascular dementia:VaD),FTD,DLB/PDD(Parkinson’s disease with dementia)における不眠,日中の過度の眠気,睡眠呼吸障害,RBD,RLSの有病率の相違について検討を行っている.RBDがDLB/PDD群に最も多かったこと,VaDでは睡眠呼吸障害が最も有症率が高かったことなどを報告しているが,RLSを除けばいずれの睡眠関連疾患も,主要な認知症原因疾患において一定の割合で出現しうることを示している.また,ADおよびDLBを主とした認知症の軽症例において睡眠関連疾患の合併頻度を検討した報告でも,種々の睡眠関連疾患がADにおいて存在しうることが示されている22)27)(図2).このことは,認知症の原因疾患にかかわらず,実臨床においては多様な睡眠の問題の要因を検討すべく,包括的な睡眠医学的症状の有無を評価することの重要性を示唆している.
III.認知症の危険因子としての睡眠の問題
これまでの基礎研究を中心とした報告からは,睡眠奪取状態がGABAおよびcAMPに影響を受ける神経経路の機能を阻害し,シナプス可塑性に障害をきたす可能性を示唆する結果15)や,疫学および基礎研究両者の検討からアミロイドβの蓄積と睡眠覚醒リズムの双方向性の関連が示唆されており18),睡眠奪取状態がアミロイドβの濃度を高め19),自覚的な短時間睡眠と睡眠の質の低下がアミロイドβの蓄積と関連していることが地域在住高齢者において示されている17)28).このようなアミロイドβの蓄積は,覚醒度の上昇および睡眠パターンの変化と関連があることも報告されている18).また睡眠の問題が,神経炎症の促進と神経新生の阻害によって神経変性過程に影響を与えうることが示唆されている21)31).このほか,睡眠呼吸障害の併存による低酸素血症や,脳血管系における変化などがさまざまに修飾を加え認知症への進展を示すモデルが示されている30).
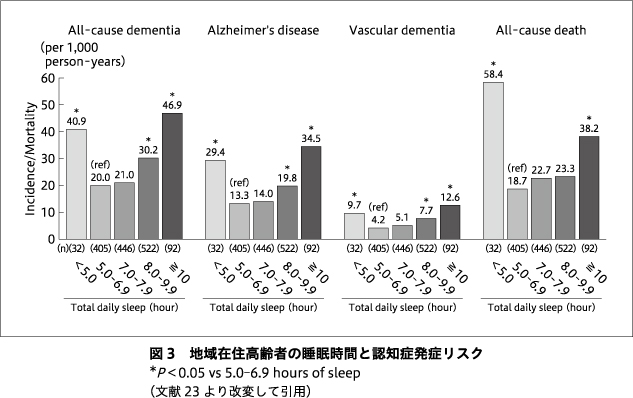
このような生物学的な背景の検討に加え,認知症や軽度認知障害の罹患リスクとしての睡眠の問題も,多数報告がなされている.特に不眠,睡眠時間,日中の眠気,睡眠呼吸障害を主とする睡眠関連疾患においてデータが蓄積されつつある.睡眠時間については,5時間ないし6時間を下回るような短時間睡眠において軽度認知障害および認知症の発症リスクが高まることが報告されており,上述のような動物モデルやヒトにおける睡眠奪取や断眠研究の結果を支持する疫学研究の結果が得られている4)23).また,長時間睡眠や過眠については,不眠や断眠モデルと異なり,実験条件下での生物学的背景を示すことは難しいものと考えられるが,疫学研究からは,8時間を超えるような長時間睡眠をとる者は短時間睡眠と同様に軽度認知障害や認知症の発症リスクが高まることが報告されており4)23),いわゆるU字ないしV字カーブを描くことが示されている(図3).さらに,睡眠時間の変化と認知症発症リスクとの関連も検討がなされている.9時間を超えるような長時間睡眠を要する者は,それより短い睡眠時間の者よりも認知症発症リスクが高いが,そのなかでも元々は9時間よりも睡眠時間が短かった者が9時間を超えるような睡眠時間の延長をきたすことが,最もリスクが高いことが報告されている29).このように単に一時点の睡眠時間の長短だけでなく,以前と比した睡眠時間の変化に着目することも重要であることが示唆されている.
日中の眠気についてのこれまでの研究報告からは,日中の眠気の存在は米国のコホート研究において3年間で約2倍認知症の診断がなされるリスクが高いことや8),英国のコホート研究において10年後の評価で4.44倍血管性認知症のリスクが高まることが報告されている7).
IV.認知症における眠気・過眠への対応
認知症患者では,これまで述べてきた高齢期に特徴的な睡眠の変化に加え,認知症に罹患することによって,さまざまな認知機能の低下が加わり,睡眠の問題がより複雑化することになる.しかし,認知症の原因疾患や個々の患者の背景要因によって差異はあるものの,基本的な睡眠の問題への対処法は,健常高齢者における睡眠指導や不眠・過眠に対する介入法と共通する部分が多い.最終的な目標は,夜間睡眠の質・量をともに増やし,日中の生活機能を改善することである.先にも述べたように,高齢期にはさまざまな要因によって「不眠」が引き起こされる.このため,患者の睡眠に影響を与えうる,夜間あるいは日中の問題となる習慣・行動・環境を把握し,睡眠衛生の改善を図ることがまず優先される.実際の診療場面でも,長すぎる昼寝の時間を減らす,声かけで日中の覚醒度を高める,同調因子としての光をうまく利用する,散歩やデイサービスなどで昼間の活動量を増やすといった生活指導だけでも,睡眠と覚醒の状態が改善する場合がしばしばみられる.なお,これらの介入指導には患者の24時間の生活スケジュールを把握することが重要となるが,認知症患者の場合,上記を問診のみで把握することは特に難しいこともあり,介護者などの情報に基づいた睡眠・覚醒リズム表の利用が勧められる.
健常高齢者に比して,認知症患者では妄想や幻覚,興奮や無為・無関心などさまざまな精神症状や行動面の問題を伴いやすい.これらの認知症におけるBPSD(非認知機能障害)は介護負担を増大させる重要な要因であり,入院や施設入所が必要となる主な原因ともなりうる.このため,催眠・鎮静作用のある薬剤もしばしば用いられる.しかしながら,睡眠衛生などの適正化が行われずに薬物が処方されると,不必要なあるいは必要量以上の薬剤が投与され,日中の眠気の増悪,ADLの全般的な低下,昼夜逆転の悪化など,医原性ともいえる機能低下を引き起こすことにもなりかねないので注意を要する.
このような,睡眠衛生の改善,生活指導などによる不眠や過眠の原因の除去を行うとともに,先に述べてきた睡眠関連疾患の有無を検討する.これら睡眠関連疾患が存在する場合には,介入の検討を行うことになる.特に頻度の高い睡眠呼吸障害に対しては,日中の眠気の増悪や認知機能の改善目的に,持続陽圧呼吸療法(Continuous Positive Airway Pressure:CPAP)を行うことは認知症患者でもしばしば行われる.他のBPSDの存在によりCPAP使用が難しいことも経験されるが,特に軽症から中等症AD患者に対しCPAP療法を行い,良好なアドヒアランスが得られた報告もなされている2).著者の経験からも,認知症発症前や比較的病初期の時期からCPAPを導入しアドヒアランスが良好であった患者では,認知症発症後や進行後も良好なアドヒアランスを維持できていることが多く,早い段階からのルーチン化した使用が維持しやすいものと考えられる.このような認知症に合併した睡眠呼吸障害に対するCPAP療法は,軽症から中等症の認知症患者で主観的な眠気を軽減し5),持続的かつ長期使用により睡眠や気分の改善のみならず認知機能の悪化を遅らせる可能性が報告されている6).
認知症の各原因疾患における睡眠・覚醒に関する神経基盤への直接的・間接的な神経変性過程の影響が眠気や過眠の発現に関与しているものと考えられる.したがって,神経変性により障害された神経基盤への介入を行うことができれば,直接的な眠気・過眠症状の改善が期待されるが,現時点で明確な効果を示すトライアルは存在せず,今後の課題と考えられる.
おわりに
日中の過度な眠気,過眠症状は,認知症において高頻度に認められる症状である.認知症の原因疾患は高齢期に発症しやすい疾患であり,睡眠の加齢性変化も認知症の睡眠の問題に影響を与えていることが考えられる.一方で,認知症の原因疾患は各々その発症病態が異なり,脳内の神経基盤の障害も異なるため,“睡眠の問題”の表現型や合併する睡眠関連疾患も相違がみられる.このため日中の過度な眠気や過眠症状も認知症の原因疾患ごとの異なる背景要因により生じうる.したがって,睡眠衛生の改善,不眠・過眠の直接原因の緩和,合併する睡眠関連疾患への評価・介入を認知症の原因疾患ごとに包括的に行う対応が重要である.また,日中の過度な眠気,過眠症状自体が認知症の発症,進展リスクとなる可能性があり,睡眠時間を含む症状の経時的変化を評価することも認知症診療では重要である.
なお, 本論文に関連して開示すべき利益相反はない.
1) Anderson, K. N., Hatfield, C., Kipps, C., et al.: Disrupted sleep and circadian patterns in frontotemporal dementia. Eur J Neurol, 16 (3); 317-323, 2009![]()
2) Ayalon, L., Ancoli-Israel, S., Stepnowsky, C., et al.: Adherence to continuous positive airway pressure treatment in patients with Alzheimer's disease and obstructive sleep apnea. Am J Geriatr Psychiatry, 14 (2); 176-180, 2006![]()
3) Bombois, S., Derambure, P., Pasquier, F., et al.: Sleep disorders in aging and dementia. J Nutr Health Aging, 14 (3); 212-217, 2010![]()
4) Chen, J. C., Espeland, M. A., Brunner, R. L., et al.: Sleep duration, cognitive decline, and dementia risk in older women. Alzheimers Dement, 12 (1); 21-33, 2016![]()
5) Chong, M. S., Ayalon, L., Marler, M., et al.: Continuous positive airway pressure reduces subjective daytime sleepiness in patients with mild to moderate Alzheimer's disease with sleep disordered breathing. J Am Geriatr Soc, 54 (5); 777-781, 2006![]()
6) Cooke, J. R., Ayalon, L., Palmer, B. W., et al.: Sustained use of CPAP slows deterioration of cognition, sleep, and mood in patients with Alzheimer's disease and obstructive sleep apnea: a preliminary study. J Clin Sleep Med, 5 (4); 305-309, 2009![]()
7) Elwood, P. C., Bayer, A. J., Fish, M., et al.: Sleep disturbance and daytime sleepiness predict vascular dementia. J Epidemiol Community Health, 65 (9); 820-824, 2011![]()
8) Foley, D., Monjan, A., Masaki, K., et al.: Daytime sleepiness is associated with 3-year incident dementia and cognitive decline in older Japanese-American men. J Am Geriatr Soc, 49 (12); 1628-1632, 2001![]()
9) Foley, D., Ancoli-Israel, S., Britz, P., et al.: Sleep disturbances and chronic disease in older adults: results of the 2003 National Sleep Foundation Sleep in America Survey. J Psychosom Res, 56 (5); 497-502, 2004![]()
10) Gagnon, J. F., Postuma, R. B., Mazza, S., et al.: Rapid-eye-movement sleep behaviour disorder and neurodegenerative diseases. Lancet Neurol, 5 (5); 424-432, 2006![]()
11) Guarnieri, B., Adorni, F., Musicco, M., et al.: Prevalence of sleep disturbances in mild cognitive impairment and dementing disorders: a multicenter Italian clinical cross-sectional study on 431 patients. Dement Geriatr Cogn Disord, 33 (1); 50-58, 2012![]()
12) Harper, D. G., Stopa, E. G., McKee, A. C., et al.: Differential circadian rhythm disturbances in men with Alzheimer disease and frontotemporal degeneration. Arch Gen Psychiatry, 58 (4); 353-360, 2001![]()
13) Hashimoto, M., Yatabe, Y., Ishikawa, T., et al.: Relationship between dementia severity and behavioral and psychological symptoms of dementia in dementia with Lewy bodies and Alzheimer's disease patients. Dement Geriatr Cogn Dis Extra, 5 (2); 244-252, 2015![]()
14) Hatfield, C. F., Herbert, J., van Someren, E. J. W., et al.: Disrupted daily activity/rest cycles in relation to daily cortisol rhythms of home-dwelling patients with early Alzheimer's dementia. Brain, 127 (Pt 5); 1061-1074, 2004![]()
15) Havekes, R., Vecsey, C. G., Abel, T.: The impact of sleep deprivation on neuronal and glial signaling pathways important for memory and synaptic plasticity. Cell Signal, 24 (6); 1251-1260, 2012![]()
16) Howell, M. J., Schenck, C. H.: Rapid eye movement sleep behavior disorder and neurodegenerative disease. JAMA Neurol, 72 (6); 707-712, 2015![]()
17) Ju, Y. E. S., McLeland, J. S., Toedebusch, C. D., et al.: Sleep quality and preclinical Alzheimer disease. JAMA Neurol, 70 (5); 587-593, 2013![]()
18) Ju, Y. E. S., Lucey, B. P., Holtzman, D. M.: Sleep and Alzheimer disease pathology: a bidirectional relationship. Nat Rev Neurol, 10 (2); 115-119, 2014![]()
19) Kang, J. E., Lim, M. M., Bateman, R. J., et al.: Amyloid-beta dynamics are regulated by orexin and the sleep-wake cycle. Science, 326 (5955); 1005-1007, 2009![]()
20) McKeith, I. G., Boeve, B. F., Dickson, D. W., et al.: Diagnosis and management of dementia with Lewy bodies: fourth consensus report of the DLB Consortium. Neurology, 89 (1); 88-100, 2017![]()
21) Meerlo, P., Mistlberger, R. E., Jacobs, B. L., et al.: New neurons in the adult brain: the role of sleep and consequences of sleep loss. Sleep Med Rev, 13 (3); 187-194, 2009![]()
22) 三島和夫: 睡眠障害. 老年精神医学雑誌, 25 (増刊1); 103-110, 2014
23) Ohara, T., Honda, T., Hata, J., et al.: Association between daily sleep duration and risk of dementia and mortality in a Japanese community. J Am Geriatr Soc, 66 (10); 1911-1918, 2018![]()
24) Ohayon, M. M., Carskadon, M. A., Guilleminault, C., et al.: Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep, 27 (7); 1255-1273, 2004![]()
25) Petit, D. M. J., St Louis, E. K., Boeve, B. F.: Alzheimer disease and other dementias. Principles and Practice of Sleep Medicine, 6th ed (ed by Kryger, M., Roht, T.). Elsevier, Philadelphia, p.935-937, 2017
26) Pistacchi, M., Gioulis, M., Contin, F., et al.: Sleep disturbance and cognitive disorder: epidemiological analysis in a cohort of 263 patients. Neurol Sci, 35 (12); 1955-1962, 2014![]()
27) Rongve, A., Boeve, B. F., Aarsland, D.: Frequency and correlates of caregiver-reported sleep disturbances in a sample of persons with early dementia. J Am Geriatr Soc, 58 (3); 480-486, 2010![]()
28) Spira, A. P., Gamaldo, A. A., An, Y., et al.: Self-reported sleep and beta-amyloid deposition in community-dwelling older adults. JAMA Neurol, 70 (12); 1537-1543, 2013![]()
29) Westwood, A. J., Beiser, A., Jain, N., et al.: Prolonged sleep duration as a marker of early neurodegeneration predicting incident dementia. Neurology, 88 (12); 1172-1179, 2017![]()
30) Yaffe, K., Falvey, C. M., Hoang, T.: Connections between sleep and cognition in older adults. Lancet Neurol, 13 (10); 1017-1028, 2014![]()
31) Zhu, B., Dong, Y., Xu, Z., et al.: Sleep disturbance induces neuro-inflammation and impairment of learning and memory. Neurobiol Dis, 48 (3); 348-355, 2012![]()