精神疾患の生物学的研究は治療薬の薬理作用の研究に始まり,それら薬物の標的分子のPETによるイメージングが可能になると,統合失調症におけるドパミンD2受容体やうつ病におけるセロトニントランスポーターやノルアドレナリントランスポーターの患者での定量値が報告されるようになった.しかし有意差が出る場合でも,健常者との重なりは大きく,明確な疾患での閾値の設定は難しいことがわかってきた.また,健常者のばらつきも性格傾向との関係が明らかになるなど,正常とされる一群のなかでも性格などの個人差に応じて神経伝達はある幅をもって調節され,精神疾患も正常との連続した変化があることがわかってきた.一方,機能的MRIで測定した安静時の脳活動から機能的結合を推定する方法からは,近年,精神疾患特異的な機能的結合の組み合わせが報告されている.しかし,回路機能の直接的検証には動物を用いた回路操作実験が必要であり,サルのような大型動物を対象に化学遺伝学(DREADD)による回路操作が開発されている.われわれはDREADDにおける人工受容体のPETでのイメージングを通じて,目的とした領域の人工受容体の発現量の定量化に成功し,さらに人工受容体を制御する高性能の薬剤deschloroclozapine(DCZ)も開発しており,今後この方法を使った回路操作実験から詳細な回路機能の解明をめざす.一方,人間で回路の機能をみるうえで障害部位の同定が可能である神経変性疾患は,特に症候との関係が明らかになってきているタウの蓄積を指標にすることによって回路機能の評価が期待できる.症候発現のメカニズムの解明は精神疾患,神経疾患ともに重要であり,そのためには疾患の症状に関連する責任回路や分子の可視化に加えて,動物での回路機能の検証など,臨床研究と基礎研究相互の連携が重要になる.
はじめに―現代精神疾患の立脚点―
現在の精神疾患の診断は,患者の陳述と症状にのみ基づいた米国精神医学会によるDSM(Diagnostic and Statistical Manual of Mental Disorders)の考え方を共通の基盤にしている.しかし度重なる改訂にもかかわらず,DSMの導入後の精神疾患の本質的理解は,いまだ道半ばであり,新薬の開発も期待されたほどには進んでいないどころか,欧米のメガファーマといわれる製薬企業の多くは,精神疾患領域から撤退している状態である.このことは精神疾患の生物学的な病態がいまだに十分わかっていないことと,それゆえ疾患モデル動物の開発が進まないことが大きな要因となっている16).それではこれまでの精神疾患の生物学的研究は何を共通の基盤としてなされてきたかといえば,その多くが偶然にその有効性が発見された抗精神病薬や抗うつ薬などの薬理作用を研究するところから始まっている.例えばクロルプロマジンの精神病に対する症状改善効果が報告されたのが1952年で,1950年代から1960年代にかけて現在の精神薬理の基盤となる発見がなされている.一方,1906年に報告されたアルツハイマー病は1911年に病理所見が報告されたが,長きにわたって治療に結びつくような発見はなかったが,1976年に死後脳の研究からアセチルコリンの減少が報告されて以来,1980年代に入り分子生物学の進展とともに家族性アルツハイマー遺伝子の発見など病因に直結すると思われる発見が次々になされるようになった.そこで本稿ではこれらの基盤に立って,主に脳機能イメージングの視点から精神疾患の研究の流れを概観し,神経変性疾患との接点や新しい動物モデルを用いたトランスレーショナル研究についてもふれてみたい.
I.神経伝達機能イメージングからみた精神疾患
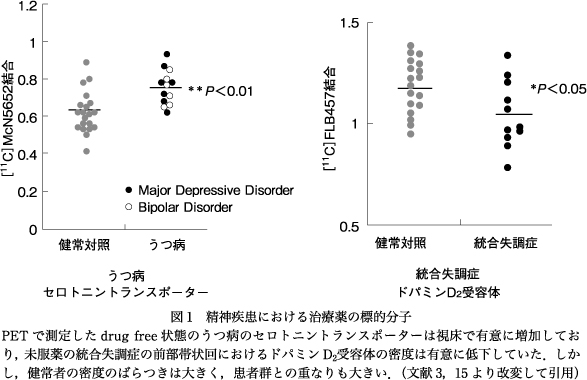
偶然に発見された精神疾患に有効な薬剤の研究から,それらの標的となる分子の研究を通した精神疾患の病態の解明が期待された.特に抗精神病薬の標的分子であるドパミンD2受容体(D2R)は,1983年に生きた人間の脳内のD2Rが[11C]N-metylspireponeによってPET(positron emission tomography)で画像化されると,この方法で統合失調症の線条体におけるD2Rが健常者に比較して増加していることが1986年に報告された23).このことから統合失調症のドパミン過剰仮説を受容体から証明できたのではないかと期待されたが,翌年には[11C]racloprideによるPET研究で統合失調症と健常者の間で線条体のD2Rには有意な差がみられないという報告がなされ5),その後のPET研究からも線条体におけるD2Rには有意な差がみられないか,みられるにしてもごくわずかの増加であるというのが現在の結論である.われわれは,当初ほとんどのPETによるドパミン神経伝達研究が線条体に注目するなか,線条体外のドパミン神経伝達に注目し,大脳皮質領域に多く分布するドパミンD1受容体の統合失調症での前頭葉における低下と陰性症状との負の相関を見出した13).その後,線条体外のD2Rに関しても[11C]FLB457を用いて前部帯状回や視床における低下と陽性症状との負の相関を見出した15)22).一方,抗うつ薬の標的分子であるセロトニントランスポーターやノルアドレナリントランスポーターに関しては,いずれもうつ病患者の視床で有意に増加していることを見出している3)9).しかし,これら精神疾患における受容体,あるいはトランスポーターの密度の分布は健常者の密度分布との重なりが大きく,両者の間に明確な閾値は設定できないことも明らかになった(図1).さらに健常者における密度の分布は同じ年齢で比較しても被検者間でのばらつきが大きく,このばらつきは例えばセロトニントランスポーターであれば神経質傾向と正の相関があるなど,個人の性格など生物学的な意味合いをもつことも明らかになってきている18)19).これらの事実は精神疾患では脳内神経伝達に正常と乖離した大きな異常を示す一群があるのではなく,正常との連続した変化があり,正常とされる一群のなかでも性格などの個人差に応じて神経伝達はある幅をもって調節されていることを示している.実際,近年の精神疾患の考え方は分子遺伝学や画像研究の結果から,疾患相互あるいは疾患と正常に関しても連続したスペクトラムととらえるべきとする方向に向かっている1).
II.脳内蓄積タンパクイメージングからみた神経変性疾患
それでは神経変性疾患に関する考え方はどう変化しているのであろうか.これまでは精神疾患同様に神経症候や行動変化によって病名がつけられていたものが,近年の分子生物学の発展により遺伝子異常や脳内に蓄積するアミロイドやタウ,αシヌクレイン,TDP43(TAR DNA-binding protein of 43 kDa)などのタンパクによる分類が進んでいる.特に神経変性疾患診断における近年の進歩は,それら蓄積タンパクが生体で画像化できるようになったことであろう.病理診断では多様な染色剤が用いられているが,それらを改良して血液脳関門を通過し,非特異結合が少ない化合物を開発して,それをポジトロン放出核種で標識することによってPETでの評価が可能になる.アルツハイマー病の老人斑を構成するアミロイドβ(Aβ)の画像化は2004年に[11C]PIBによって実現された7).これによってAβの蓄積が発症の十数年前に始まり,臨床的に軽度の認知機能障害が認められる頃には脳内に広くAβの蓄積が起こっていることが確認された.また,アルツハイマー病のみならず進行性核上性麻痺や前頭側頭型認知症において脳内に蓄積するタウタンパクの画像化は,2013年にわれわれが開発した[11C]PBB3をはじめとした複数のリガンドによって可能になり,アルツハイマー病では初期に側頭葉内側に蓄積し,臨床症状の進行に伴って脳内に広く蓄積していく過程が明らかになってきている8).もともと神経変性疾患は死後の病理診断で確定診断がつけられるという点で精神疾患とは状況が異なっていたが,それが事実上,生前に病理診断ができるようになったことは診断上の重要な進歩で,これによって神経変性疾患の領域では発症の予測や病型の分類の客観化が現実のものになろうとしている.
III.脳内機能的結合と神経伝達からみた精神症候
神経変性疾患における異常タンパクと異なり,神経伝達にかかわる種々のタンパクは正常でも発現しており,その量も患者と健常者との重なりが大きいことから,診断のバイオマーカーとはなりにくいことがわかってきた.それでは精神症候を説明するうえでどのような指標が考えられるであろうか.脳内の神経は相互に密接なネットワークを形成しているが,近年,神経ネットワークを評価する方法として安静時脳活動から脳内の機能的結合を推定する方法が用いられてきている.安静時に神経が自発的に活動していることは古くから知られていたが,以前はそのような活動は単なる雑音のようにとらえられていた.しかし,神経活動によって変動する局所脳血流を全脳で画像化できる機能的MRI(fMRI)によって安静時の自発脳活動を評価すると,一定の周期で活動している脳領域間でその安静時活動が相関している領域があり,また,その相関に機能的な意味があることも明らかになってきた.脳には無数の機能的結合が存在しているが,近年,いくつかの精神疾患で,疾患特異的な複数の機能的結合の組み合わせが報告されている.例えば自閉スペクトラム症を他の精神疾患から分離できる16個の機能的結合の組み合わせや20),メランコリー型うつ病を他の精神疾患から分離できる10個の機能的結合の組み合わせ2)などが報告されており,この機能的結合の組み合わせから,健常者との違い,疾患相互の関係の近さなどを評価する試みが行われている.
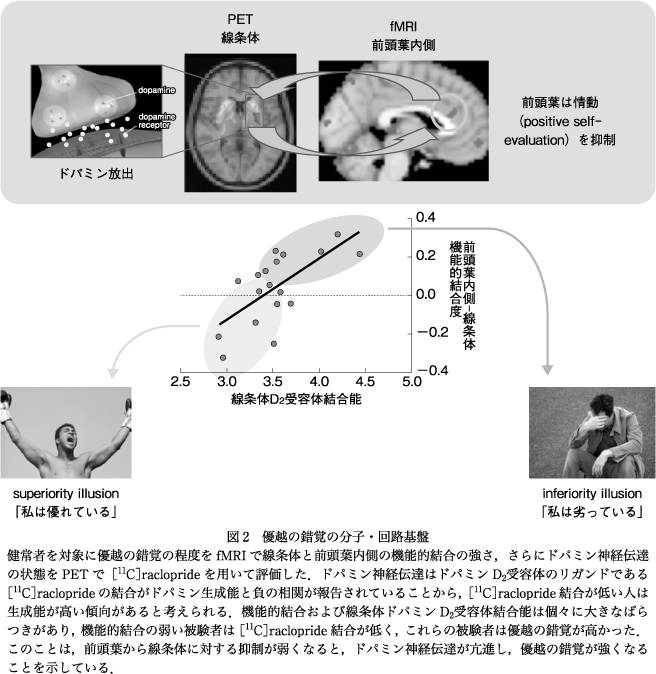
一方で,機能的結合が実際の解剖学的ネットワークと果たして一致するのか否か,神経伝達機能とはどのように関係するのかに関してはまだ不明な点も多い.われわれは健常者における脳内機能的結合と神経伝達との関係を,fMRIによる安静時脳活動とPETによる神経伝達と組み合わせて検討し,さらに霊長類を使って回路と機能との関係を検討している.うつ病では自己評価が低下することがよく知られているが,健常者においての自己評価は通常やや高めに偏ることが知られている.これを優越の錯覚と呼び,個人で異なるこの優越の錯覚の脳内回路―分子的背景を探る目的で,fMRIで測定される脳内の機能的結合と,PETで測定される脳内のドパミン神経伝達と優越の錯覚の関係を検討した.その結果,優越の錯覚が高いほど前部帯状回と線条体の機能的結合は弱く,PETで評価した線条体において放出されているドパミン量は多い傾向にあることがわかってきた.このことは自己評価の高低に脳内のドパミン神経伝達がかかわっており,前頭葉と線条体との機能的結合はドパミン神経伝達に抑制的に働いている可能性が示唆される(図2)21).逆にいえば,自己評価の低い状態は前頭葉と線条体の機能的結合が強くなってドパミン神経伝達の抑制が起こった状態ということもできる.このように機能的結合は脳内の神経伝達の状態と密接に結びついており,うつ病では治療によって機能的結合が変化することも報告されているが2),機能的結合を変化させれば神経伝達も変化するのかどうかに関してはまだわかっていない.
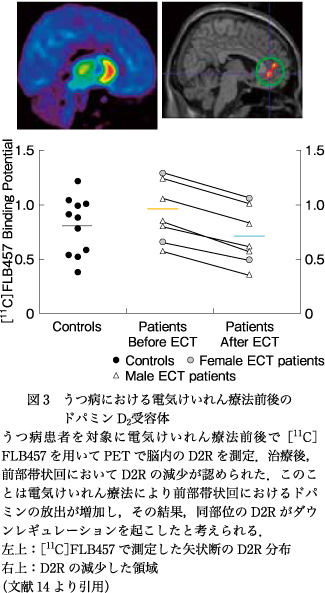
治療による神経伝達の変化に関しては,われわれはうつ病患者で電気けいれん療法の前後で前部帯状回のドパミン神経伝達が変化することをPETの測定から明らかにしたが(図3)14),抑うつの意欲低下モデルとしてわれわれが開発した甲状腺機能低下サルにおいても前部帯状回におけるドパミン神経伝達の変化が認められた.ただ変化の方向は逆で,うつ病患者では電気けいれん療法後,症状が回復した時点で[11C]FLB457で測定したD2Rは前部帯状回で減少し,サルの意欲低下モデルではD2Rは増加していた.この変化は,電気けいれん療法後は同部位におけるドパミンの放出が増加してD2Rがダウンレギュレーションを起こして密度が低下したのに対し,サルの意欲低下モデルではドパミンの放出が低下してD2Rがアップレギュレーションを起こして密度が増加したと考えることができる.
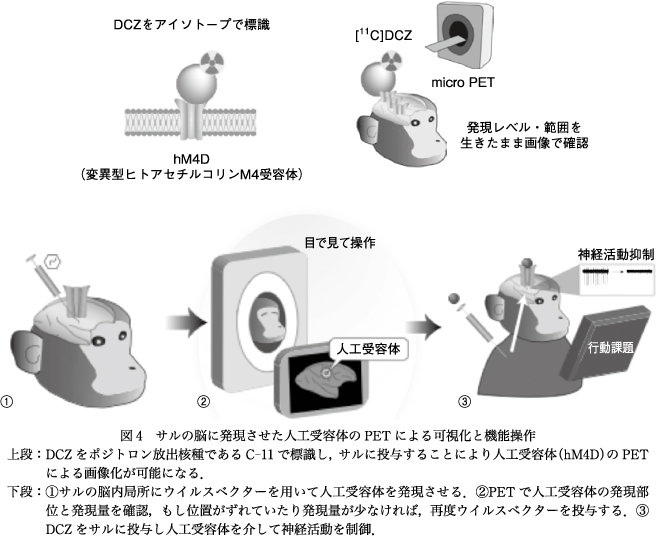
疾患や治療における神経伝達や機能的結合の変化の生物学的実態を解明するにはモデル動物における回路操作と神経伝達の測定を同時に進めていくことが欠かせない.これまでの動物を用いた局所破壊実験では,同じ動物で何回も機能を遮断したり,逆に刺激したりといった回路の操作は難しかったが,近年,光遺伝学や化学遺伝学といった手法を用いることにより,特定の回路のon/offが可能になってきている.しかし,サルのような大型動物では神経細胞に発現させたイオンチャネルを光でon/offさせる光遺伝学は,脳が大きすぎてよく機能しない場合が多いことから,変異型アセチルコリン受容体を特定の神経細胞に発現させ,その神経の活動をCNO(clozapine N-oxide)などの薬剤を使って制御する化学遺伝学DREADD(designer receptors exclusively activated by designer drugs)が使われている.動物における回路操作技術は,特定の行動に関連する回路と神経伝達機能を明確にできる可能性をもっていることから,精神疾患のモデル動物の作製が必ずしもうまくいかない現状で,疾患を構成する症候に着目して,特定の症候発現にかかわる神経回路とその神経伝達機能を明確にし,精神疾患をその構成要素から再構築していくうえできわめて重要な方法となりうる.動物における回路操作ではウイルスベクターによる目的の領域への人工遺伝子の導入が重要となるが,齧歯類では数が稼げるので脳を取り出して人工遺伝子の発現を確認することは大きな障害とならないが,サルでは実験ごとに脳を取り出すことは現実的ではない.仮に人工遺伝子の発現が生体で確認できれば,目的とする行動に変化がなかった場合,その回路が関係なかったのか単に人工遺伝子の導入がうまくいかなかったのかという問題にすぐ解答が得られる.われわれはこの目的のために,DREADDで導入した人工受容体のPETによる可視化を行い,生体で目的とした領域の人工受容体の発現量の定量化に成功した.この方法によって人工受容体の発現量をモニターしながら,発現量が十分ではないときには再度の導入決定も容易となった.さらに人工受容体は導入した神経全体に発現するので神経の走行と投射部位の同定も可能となった11).DREADDにおいて神経活動のon/offを制御するための薬剤としては現在主にCNOが使われている.しかしCNOに関しては,脳への移行性が低いことや,動物種によっては体内で代謝されてclozapineに変換されることがあるなどの問題が指摘されている.われわれはこれらの問題を解決するDREADDの新しい薬剤の開発を試み,DCZ(deschloroclozapine)という化合物の開発に成功した.CNOは静注後脳内の濃度がピークに達するまでに90分程度かかるため,光遺伝学のように光のon/offで行動の迅速な変化を確認することは難しかった.一方,DCZは静注後急速に脳内に分布するため迅速な行動の変化を確認しやすい.また,人工受容体への親和性も高くCNOに比較し100倍の力価をもつ.そのためPETリガンドとして標識した[11C]DCZは人工受容体を高い感度で描出することができる(図4)12).
疾患における機能的結合や神経伝達の変化は人間で再現することは難しいが,このような新しい方法で症候ベースのモデル動物を作製することにより,特定の症候の背景にある回路と神経伝達を明らかにできるものと期待される.
IV.神経変性疾患と精神症状の接点
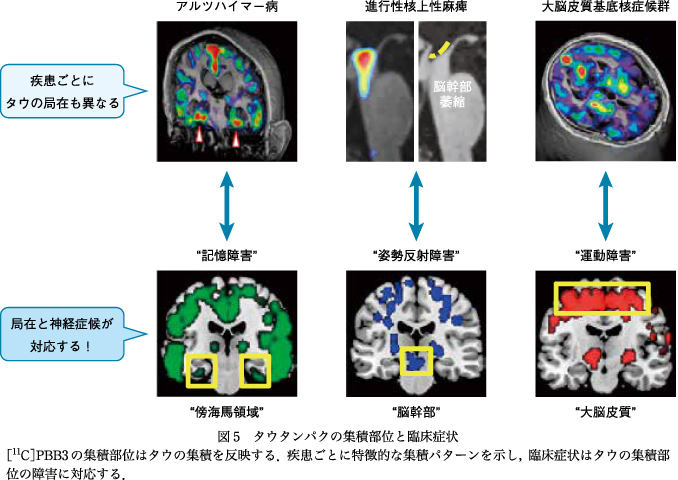
精神疾患の症候発現のメカニズムを考えるうえで,障害の原因がより明確になっている神経変性疾患から症候発現のメカニズムを解析していくことは古くて新しいアプローチである.古くは損傷脳を対象に脳の局在機能などが研究されてきたが,現在ではさまざまなイメージング機器を用いた脳機能の評価が可能になってきている.そのなかで神経変性疾患の脳内に蓄積するタウタンパクは蓄積領域と脳の機能障害がよく相関することから(図5),神経変性疾患で出現する多様な精神症候とタウの関係を解明することにより,精神症候にかかわる回路を明らかにしていける可能性がある.例えば,アルツハイマー病において認められるアパシー症状に関してタウの蓄積との関係を解析したところ,アパシー症状の強いアルツハイマー病群では前頭葉,特にこれまでアパシーとの関連が指摘されている眼窩前頭皮質において[11C]PBB3の集積が高く,眼窩前頭皮質萎縮と鈎状束の白質統合性の低下も明らかになった.眼窩前頭皮質は扁桃体と鈎状束という白質線維でつながり皮質―辺縁ネットワークを形成しており,アパシーの重症度と関連していることから,これらの神経回路がアパシーの発現に重要であることが間接的に確認できた6).より直接的にこの回路の機能を確認するためには,動物でこの回路をDREADDによってon/offして行動の変化を確認することで確かめることが可能となる.
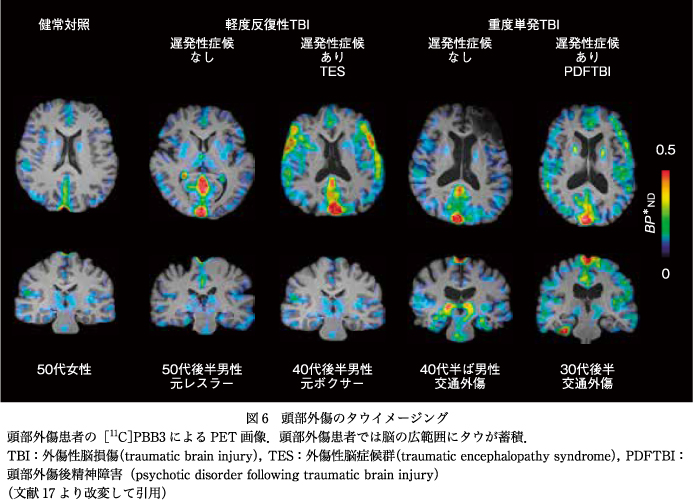
タウがかかわる精神症状が顕著な疾患として,近年,慢性外傷性脳症が注目されている.特に,有名なプロレスラーが引退後,記憶障害や抑うつに苦しんで自殺に至った例や,アメリカンフットボールの元選手が記憶障害,抑うつ,アルコール依存の果てに自殺をした例などの死後の病理解剖で,広範な脳部位に神経原線維変化が認められたことから,特に米国で注目されるようになった.頭部外傷に伴う精神症状として頭部外傷後精神障害という病態も存在する.頭部外傷後4~6年で,幻覚妄想など精神症状や記憶障害,遂行機能障害といった高次脳機能障害も併発する病態で,抗精神病薬に対する反応は低いとされている.このように頭部外傷後の精神症状は多様であるが,われわれはタウの局在を手がかりに精神症状発現に関係する神経回路の同定ができないかと考え,ボクシングなどのコンタクトスポーツによる反復性軽度外傷と,交通事故による外傷患者で,初回受傷後平均で21年という慢性の頭部外傷患者を対象に臨床症状と脳内のタウの蓄積を[11C]PBB3によるPETで評価を行った.その結果,遅発性脳障害の症状を有する群では灰白質との境界の白質表層部にタウの集積が認められ(図6),蓄積が増えるほど幻覚妄想などの精神病症状が重度になる傾向が認められた17).当初,われわれは精神病症状を呈する頭部外傷では特徴的なタウの集積パターンがみられると考え,そこから精神病症状にかかわる脳内回路の同定につながることを期待したが,結果としてはより広い範囲の白質表層部のタウ蓄積量と障害の強さとの関係しか見出すことができなかった.今後はよりタウ蓄積に対する感度の高い[18F]PM-PBB3などを用いることによって,より微細なタウの蓄積を病初期にとらえ,初期の症状に関連する脳内回路をとらえられる期待もある.また,より頻度の高い神経変性疾患であるレビー小体型認知症やパーキンソン病でも抑うつをはじめとした多様な精神症状が認められるが,われわれが現在開発しているαシヌクレインのPETリガンドが臨床に使われるようになれば,これら疾患における初期の精神症状とαシヌクレインの蓄積部位との関係から初期の症状に関連する脳内回路をとらえられる期待もある.
おわりに
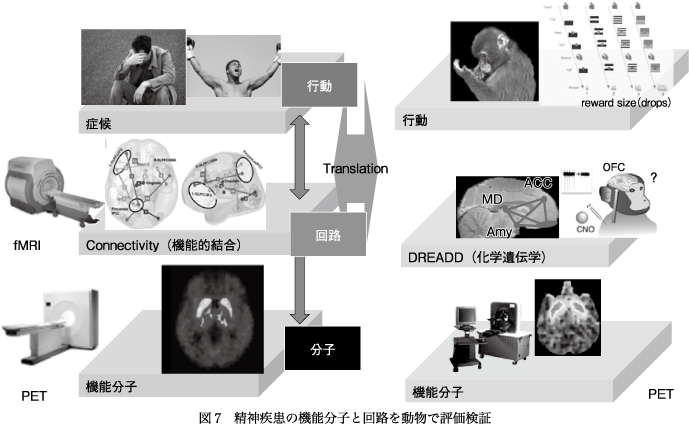
精神医学は,医学領域においていまだに疾患診断において明確なバイオマーカーが存在しない領域で,いまだに臨床症候を組み合わせた操作的診断基準に準拠している状態である.米国NIH(National Institutes of Health)ではDSMに代表される操作的診断基準では臨床研究に不十分として,精神疾患を神経回路の異常と考えて機能ごとに評価し,そこに遺伝子や関連する分子情報も加えて客観的に定義するRDoC(Research Domain Criteria)を提唱している4).RDoCは現在の精神医学の疾患分類は,いずれ生物学的な情報に従って再分類を余儀なくされるだろうという見方に立っている.実際fMRIによる機能的結合の違いからうつ病をいくつかのバイオタイプに分ける試みもなされているが,多様な情報を統合して疾患の再定義をめざすRDoCの考え方はまだ現実の精神疾患を再定義するまでには至っていない.その一方で,これまで精神疾患に分類されていた疾患も器質的な原因が見つかると,精神疾患でなくなり,その後は器質的原因の研究が中心となってきた.例えば抗NMDA受容体脳炎は臨床上,統合失調症との鑑別が困難であったものが自己免疫疾患として特定され,以後は免疫学的視点からの病態解明研究が中心となっている.また,老年期の精神障害のなかにはPETでタウイメージングを行うと,アミロイドの集積はなくタウの集積だけを認める一群がある10).このような一群は慢性外傷性脳症のようにタウ病変が関与する疾患としてタウオパチーと分類されていく可能性がある.しかし病因がわかったからといって,臨床症状がどのような機序で出てくるかについてわかったわけではない.精神疾患においては治療は対症療法にとどまっているのが現状であるが,将来複数の原因が明らかになったとしても,症候発現のメカニズムの解明は精神疾患,神経疾患ともに重要であり,そのためには疾患の症状に関連する責任回路や分子の解析に加えて,動物での回路機能の検証など,臨床研究と基礎研究相互の連携が重要になってくる(図7).
編 注:第115回日本精神神経学会学術総会教育講演をもとにした総説論文である.
なお,本論文に関連して開示すべき利益相反はない.
1) Adam, D.: Mental health: on the spectrum. Nature, 496 (7446); 416-418, 2013![]()
2) Ichikawa, N., Lisi, G., Yahata, N., et al.: Primary functional brain connections associated with melancholic major depressive disorder and modulation by antidepressants. Sci Rep, 10 (1); 3542, 2020![]()
3) Ichimiya, T., Suhara, T., Sudo, Y., et al.: Serotonin transporter binding in patients with mood disorders: a PET study with[11C](+)McN5652. Biol Psychiatry, 51 (9); 715-722, 2002![]()
4) Insel, T., Cuthbert, B., Garvey, M., et al.: Research domain criteria(RDoC): toward a new classification framework for research on mental disorders. Am J Psychiatry, 167 (7); 748-751, 2010![]()
5) Farde, L., Wiesel, F. A., Stone-Elander, S., et al.: D2 dopamine receptors in neuroleptic-naive schizophrenic patients. A positron emission tomography study with[11C]raclopride. Arch Gen Psychiatry, 47 (3); 213-219, 1990![]()
6) Kitamura, S., Shimada, H., Niwa, F., et al.: Tau-induced focal neurotoxicity and network disruption related to apathy in Alzheimer's disease. J Neurol Neurosurg Psychiatry, 89 (11); 1208-1214, 2018![]()
7) Klunk, W. E., Engler, H., Nordberg, A., et al.: Imaging brain amyloid in Alzheimer's disease with Pittsburgh Compound-B. Ann Neurol, 55 (3); 306-319, 2004![]()
8) Maruyama, M., Shimada, H., Suhara, T., et al.: Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron, 79 (6); 1094-1108, 2013![]()
9) Moriguchi, S., Yamada, M., Takano, H., et al.: Norepinephrine transporter in major depressive disorder: a PET study. Am J Psychiatry, 174 (1); 36-41, 2017![]()
10) Moriguchi, S., Takahata, K., Shimada, H., et al.: Excess tau PET ligand retention in elderly patients with major depressive disorder: a PET study. Mol Psychiatry (in press)![]()
11) Nagai, Y., Kikuchi, E., Lerchner, W., et al.: PET imaging-guided chemogenetic silencing reveals a critical role of primate rostromedial caudate in reward evaluation. Nat Commun, 7; 13605, 2016![]()
12) Nagai, Y., Miyakawa, N., Takuwa, H., et al.: Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. Nat Neurosci, (in press)![]()
13) Okubo, Y., Suhara, T., Suzuki, K., et al.: Decreased prefrontal dopamine D1 receptors in schizophrenia revealed by PET. Nature, 385 (6617); 634-636, 1997![]()
14) Saijo, T., Takano, A., Suhara, T., et al.: Electroconvulsive therapy decreases dopamine D2 receptor binding in the anterior cingulate in patients with depression: a controlled study using positron emission tomography with radioligand[11C]FLB 457. J Clin Psychiatry, 71 (6); 793-799, 2010![]()
15) Suhara, T., Okubo, Y., Yasuno, F., et al.: Decreased dopamine D2 receptor binding in the anterior cingulate cortex in schizophrenia. Arch Gen Psychiatry, 59 (1); 25-30, 2002![]()
16) Suhara, T., Chaki, S., Kimura, H., et al.: Strategies for utilizing neuroimaging biomarkers in CNS drug discovery and development: CINP/JSNP working group report. Int J Neuropsychopharmacol, 20 (4); 285-294, 2017![]()
17) Takahata, K., Kimura, Y., Sahara, N., et al.: PET-detectable tau pathology correlates with long-term neuropsychiatric outcomes in patients with traumatic brain injury. Brain, 142 (10); 3265-3279, 2019![]()
18) Takano, A., Arakawa, R., Hayashi, M., et al.: Relationship between neuroticism personality trait and serotonin transporter binding. Biol Psychiatry, 62 (6); 588-592, 2007![]()
19) Tuominen, L., Miettunen, J., Cannon, D. M., et al.: Neuroticism associates with cerebral in vivo serotonin transporter binding differently in males and females. Int J Neuropsychopharmacol, 20 (12); 963-970, 2017![]()
20) Yahata, N., Morimoto, J., Hashimoto, R., et al.: A small number of abnormal brain connections predicts adult autism spectrum disorder. Nat Commun, 7; 11254, 2016![]()
21) Yamada, M., Uddin, L. Q., Takahashi, H., et al.: Superiority illusion arises from resting-state brain networks modulated by dopamine. Proc Natl Acad Sci U S A, 110 (11); 4363-4367, 2013![]()
22) Yasuno, F., Suhara, T., Okubo, Y., et al.: Low dopamine D2 receptor binding in subregions of the thalamus in schizophrenia. Am J Psychiatry, 161 (6); 1016-1022, 2004![]()
23) Wong, D. F., Wagner, H. N. Jr., Tune, L. E., et al.: Positron emission tomography reveals elevated D2 dopamine receptors in drug-naive schizophrenics. Science, 234 (4783); 1558-1563, 1986![]()