遺伝素因による精神疾患の病因の探索研究は,近年の大規模なゲノム網羅的相関研究によりようやく陽の目を見つつあるが,病因の解明というには程遠い.エピジェネティクスは,環境と遺伝子の相互作用の機序にかかわると考えられており,トラウマやストレスといった環境因子により引き起こされる精神疾患が,分子レベルでどのような変化を起こしているのかという理解の助けになると期待され,精神疾患にかかわるエピジェネティクスの研究論文数は過去10年で指数関数的に増加している.エピジェネティクスの機序としては,DNAのメチル化をはじめ,ヒストン修飾や,近年注目を集めているマイクロRNAによるコントロールなどがあるが,最もよく研究されているのがDNAのメチル化である.遺伝子研究における技術の進歩により,遺伝子研究と同様に,エピジェネティクスの研究も,候補遺伝子研究からゲノム網羅的研究へと推移してきており,イルミナ社のEPICアレイを用いた研究がしばらく中心になると思われる.本稿では,エピジェネティクスと精神疾患のかかわりについて,概論の後,各精神疾患の研究例も含め紹介する.これらの研究成果は,ヒトの行動,内分泌機能,生理的機能などがエピジェネティクスによって変更を受けていることを示唆しており,それは,すなわち精神疾患の治療効果にもエピジェネティクスが役割を果たしている可能性を示している.
はじめに
著者のような臨床医の観点からエピジェネティクスが興味深いのは,精神科臨床に直結する知見が得られるかもしれない,という期待によるところが大きい.遺伝素因による精神疾患の病因の探索研究は,近年の大規模なゲノム網羅的相関研究(genome-wide association study:GWAS)によりようやく陽の目を見つつあるが,そうして見つかる遺伝子多型のエフェクトサイズは非常に小さく,病因の解明というには程遠い.その点,エピジェネティクスは,環境と遺伝子の相互作用の機序にかかわると考えられており,心的外傷後ストレス障害(posttraumatic stress disorder:PTSD)や大うつ病などの,トラウマやストレスといった環境因子により引き起こされる精神疾患が,分子レベルでどのような変化を起こしているのかという理解の助けになると期待されている.
どうしてエピジェネティクスがそれほど精神疾患に大事かを理解するうえで,著者がよく引用する2つの研究をまずご紹介したい.1つ目のHeim, C. とNemeroff C. B. らのグループが2000年にJAMAに発表した研究では,児童虐待歴のある群とない群のTrier Social Stress Test(TSST)に対する反応を比べ,コルチゾール,副腎皮質刺激ホルモン(ACTH),および心拍数の上昇が,虐待群では有意に高いということが示された6).ストレスが精神疾患の予後に影響を与えることは精神科臨床では以前からよく知られていた事実であるが,この研究は,何年も前の児童虐待の影響が,精神疾患の予後のみならず,後年にわたるまで内分泌機能および循環器機能にも影響を残すということを示しており,極めて重要な結果といえる.
2つ目は,それと相対するもので,動物実験にてWeaver, I. C. らが2004年にNature Neuroscienceで示したエピジェネティクス研究の金字塔的な論文である.彼らは,ラットの生後環境で通常行われるべき毛づくろいをしない母ラットに育てられると,その子ラットは抑制ストレスによるコルチコステロンの上昇度が高まる,ということを示した.彼らはそうしたストレス反応性の上昇が,まずグルココルチコイド受容体の遺伝子のDNAメチル化が増加することで遺伝子の転写が抑制され,結果としてグルココルチコイド受容体蛋白の発現が低下することによって,視床下部-下垂体-副腎系(HPA axis)のネガティブフィードバックが抑制されることに起因する,ということを示した.しかも,そのうえでtrichostatin A(TSA)というヒストン脱アセチル化酵素(histone deacetylase:HDAC)阻害薬を与えた場合,養育環境による悪影響を相殺することができるということまで示したのである23).その意味で,この論文がエピジェネティクス研究で金字塔的である理由は明らかであると思う.
この結果は,もし動物にTSAのような薬剤を投与することで,トラウマやストレスの悪影響を防ぐことができるとしたら,ヒトにおいても,薬剤によってトラウマやストレスの影響を回避することが,可能になるかもしれない,ということを意味している.このことは,臨床医にとって,非常に夢のある,期待を抱くに十分な結果といえる.そのため,著者は臨床医にもかかわらず,エピジェネティクスを用いた臨床・トランスレーショナル研究にかかわることになったのである.
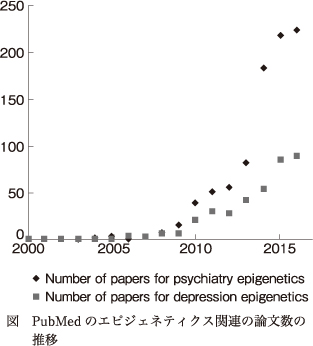
参考までに,現在までのPubMedにおける精神疾患にかかわるエピジェネティクスの論文数の推移をみると,図のように,過去10年で指数関数的に増加していることがわかる.実際,丁度10年前の2007年に著者が初めてエピジェネティクスについて学んだ際,PubMedでdepressionとepigenetics,あるいはpsychiatryとepigeneticsで論文を検索しても,10本以下しか見つけることができなかったが,今では年間100本を超えている状況である.以下,主だった精神疾患に関するエピジェネティクス研究の現状をご紹介する.
I.エピジェネティクスの概論
エピジェネティクスはダイナミックなプロセスであり,その点が静的な遺伝子変異との相関研究とは決定的に異なる.ほとんどの精神疾患が時間とともに変化することを考えると,エピジェネティクスのかかわりの重要性が理解できると思う.エピジェネティクスの機序としては,DNAのメチル化をはじめ,ヒストン修飾や,近年注目を集めているマイクロRNAによるコントロールなどがあるが,この論説では,主にDNAのメチル化と精神疾患のかかわりについて紹介する.
1.DNAメチル化
DNAのメチル化はエピジェネティクスの機序のなかで最もよく研究されており,近年,精神疾患との関連でも多数の報告がなされている.メチル化は通常,遺伝子配列のシトシン(C)の後にグアニン(G)が続いた塩基配列のシトシン上に起こる.2つの塩基はリン酸(p)により結合しているため,こうした遺伝子部位はCpGと表記されることが多い.遺伝子のプロモーター領域にあるCpGにメチル化が起こると,その部位は転写因子の結合が阻害され,結果としてメチル化はその遺伝子の転写を抑制することにつながり得る.そのため,通常,メチル化の程度と転写の程度は反比例する傾向になる.
2.ヒストン修飾
もう1つ重要なエピジェネティクスの機序はヒストン修飾である.ヒストン蛋白にはいくつか種類があり,八量体として集まり,DNAがその周囲に巻き付くことで折りたたまれ,クロマチンを形成することになる.ヒストン修飾には,アセチル化,メチル化,ユビキチン化など多数が知られているが,最もよく知られているのがヒストンのアセチル化である.ヒストンがアセチル化されると,DNAはヒストン周囲への巻き付きが緩くなり,そのため転写因子の結合がしやすくなり,遺伝子の効率的な転写が起こる.その反対に,アセチル化が除かれる(脱アセチル化する)と,遺伝子はヒストン周囲に固く巻き付き,転写が抑制されることになる.このアセチル化と脱アセチル化は平衡状態にあり,酵素や薬剤でそのバランスが変わることで,転写が促進されたり抑制されたりすることになる.脱アセチル化を進める酵素をHDACといい,この酵素の作用を抑制する薬剤をHDAC阻害薬と呼ぶ.HDACは脱アセチル化を進めることで転写を抑制する一方,HDAC阻害薬は逆にアセチル化を進めることで転写を亢進させる.興味深いことに,双極性障害の治療薬である気分安定薬のバルプロ酸は,HDAC阻害薬であることが知られており,双極性障害の病態にヒストン修飾が影響している可能性を示している.
3.ノンコーディングRNA
ヒトの全ゲノムはおよそ30億塩基からなるといわれているが,その膨大な塩基配列のなかで遺伝子をコードしている部分はわずか2~3%といわれている.しかし,その他にもDNAから転写されているRNAは多数存在し,それらも実は遺伝子の転写,翻訳のプロセスにさまざまな形で関与していることが明らかになってきている.そのなかでよく知られている機能はRNA干渉のような機序であり,そのようなノンコーディングRNAは遺伝子をコードしているDNAの転写を抑制することになる.こうした知見はエピジェネティクスのなかでも比較的新しい分野であり,近年ますます多くの報告がなされるようになってきている.
4.候補遺伝子アプローチとゲノム網羅的アプローチ
遺伝子研究における技術の進歩により,遺伝子研究と同様に,エピジェネティクスの研究も,候補遺伝子研究から,ゲノム網羅的研究へと推移してきている.かつては,候補遺伝子におけるDNAのメチル化やヒストン修飾が精神疾患との相関をみるために調べられていた.そうした候補遺伝子は,さまざまな疾患の病態仮説に基づいて選択されてきた.例えば,うつ病の研究では,モノアミン仮説に基づいて,セロトニントランスポーター遺伝子(SLC6A4)が調べられたり12),神経成長因子仮説に基づいて,脳由来神経成長因子遺伝子(BDNF)が調べられてきた4).統合失調症では,ドパミン仮説に基づいてドパミン受容体の遺伝子(DRD2)が調べられた27).DNAのメチル化の研究で,最も信頼度が高いとされるのはバイサルファイト処理の後にパイロシークエンシングを行う手法であるが,バイサルファイト処理では,メチル化されていないシトシンはウラシル,さらにはチロシンに変化するが,メチル化されているとシトシンは変化を受けず,シトシンとして残る.この差を調べることで,特定の座位のメチル化の比率を求めることができる.この手法はゲノム網羅的な手法で得られたシグナルを確認するために,現在でも多用されている.
近年では,ゲノム網羅的手法が主流になってきており,その傾向はますます強まることが確実である.最も多用されているプラットフォームはイルミナ社のDNAメチレーションアレイで,初期のものは27Kアレイと呼ばれる約27,000ヵ所のCpGを調べるものであり,10年ほど前から使用され,その後,450Kアレイが主流となった.2016年にはさらに実に約850,000ヵ所ものCpGをカバーするEPICアレイが発売され,今後しばらくはこの手法が主流となると思われる.こうした実験はいまだ高額で,多数のサンプルを解析するには膨大な研究費が必要になる.
5.精神科エピジェネティクス研究における組織特異性の問題
精神疾患のエピジェネティクス研究の結果を吟味する際に注意しなくてはならないのは,エピジェネティクスの状態は組織によって異なるという事実である.この点が,遺伝子研究とは大きく異なる.遺伝子研究の場合には,どの組織を採取して遺伝子型を測定しようとも,その個人の遺伝子型は末梢組織でも脳組織でもほぼ同じであるから問題はなかった.しかし,エピジェネティクスの情報は組織ごと,さらにいえば,細胞種ごとに異なっており,この点が大きな問題になる.例えば,血液の場合,リンパ球,好中球,単球など,さまざまな種類の血球細胞から成り立っている.また,唾液はリンパ球と上皮細胞の混成であることが知られている.これと同様に脳組織にもさまざまな細胞があり,単純に神経細胞とグリア細胞という以上に細分化されたさまざまな細胞が存在し,グリア細胞のなかでもアストロサイト,ミクログリア,オリゴデンドロサイトなど多種多様である.最も重要な点は,精神疾患の病態部位は脳にあるという事実である.脳組織を採取して調べることは,死後脳を除けば極めて困難であり,そのため,ほとんどの精神疾患のエピジェネティクス研究は,末梢組織を使用するか,死後脳を利用するかしかない.しかし,死後脳のサンプルの質は,死後から保存されるまでの間における変性がまちまちであり,エピジェネティクスの状態が大きく変化している可能性を否定できないうえ,通常サンプル数も非常に限られる.したがって,末梢組織が多用されているが,末梢サンプルにおけるエピジェネティクスの状態が,どの程度,脳組織のそれと相関しているのか,という疑問が残ることになる.
そうした疑問点に答えるため,いくつかの研究グループが末梢組織と脳組織のDNAメチル化状態を比較した研究を行っているが,往々にして,異なる個人間のデータをまとめて比較していることに注意が必要である21).また,他のケースでは,同一個人間であっても,組織の採取の時期が異なっている場合もあり,エピジェネティクスの状態がダイナミックに時間とともに変化することを考えると,果たして正確に組織間の相関を測定できているか疑問が残ることになる5).さらに,脳との比較対象が1つの組織,例えば血液だけに限られていることが多く,果たしてどの末梢組織が脳の代替として最も適切であるか,という疑問には答えられていない5).そこで,著者のグループは脳外科医と協力し,治療抵抗性てんかんの治療のための切除脳を利用し,同時に血液および唾液,口腔粘膜を採取して,ゲノム網羅的にDNAのメチル化を比較検討した2)19).また,われわれはデータをオンライン検索可能にするサイトを構築し公開する予定であり,他の研究者がエピジェネティクス研究を計画する際に,特定の計画によって興味のある遺伝子,遺伝子座によって,どの末梢組織を選択することが最適かの決定に寄与することをめざしている.
II.個々の精神疾患のエピジェネティクス研究
1.統合失調症
先に述べたように,統合失調症を対象とした初期のエピジェネティクス研究は候補遺伝子を調べるものが主であり,モノアミン仮説に基づいてcatechol-O-methyltransferase(COMT)や5-hydroxytryptamine receptor 2A(HTR2A),DRD2やSLC6A4など,また,神経成長因子仮説に基づいてBDNFなどが,末梢血や限られた数の死後脳を用いて報告されている26)27).しかし,サンプル数が少ないこと,また,調べられた候補遺伝子の数も極めて限定的なことなどから,現在のところはっきりした結論は得られておらず,再現性も低いといわざるを得ない.例えば,調べられた候補遺伝子のメチル化は,増加していたり減少していたり,方向性が組織によって一致しない場合もあり,そうした結果が,疾患群と対照群における実際の生物学的な差によるものなのか,実験上の誤差によるものなのかの判別が困難となってしまっている.そのため,近年では,遺伝子研究と同じく,エピジェネティクス研究でも,ゲノム網羅的な手法が主流となってきているが,まだまだそうした研究,とくに,サンプル数の大きい報告は限られているのが現状である.最近のAberg, K. A. らによる報告はスウェーデンからのもので,全体数が1,497名のうち,759名の患者群と738名の対照群を比較している.この研究では,一般的に用いられるアレイによるのではなく,シークエンスに基づいた手法によりゲノム上のメチル化情報を網羅している.この手法により見出された統合失調症との関連座位FAM63Bは,独立した群でも再現されたと報告されている1).
2.双極性障害
双極性障害のエピジェネティクス研究は,死後脳のサンプル数が限られるため,統合失調症とまとめて報告されていることが多い.統合失調症の研究同様,初期にはやはり候補遺伝子に注目した研究が多く,ゲノム網羅的研究の報告数も限られている.近年のゲノム網羅的研究報告では,躁状態と通常の状態の比較が行われるものがみられているが,そうした手法はエピジェネティクス研究ならではの取り組みであり,重要である.ある研究では,20名の躁状態の入院患者群と20名の健常群をイルミナ社の450Kアレイで比較し,患者群においてCYP11A1遺伝子のメチル化が低下していることを報告している.さらに興味深いことに,この遺伝子座位のDNAのメチル化の程度は,躁状態で入院時から6ヵ月後に測定したところ,健常群と同程度まで回復していたということで,このDNAのメチル化の程度が気分状態の程度と相関している可能性を示している18).この研究自体は,ゲノム網羅的な研究としてはサンプル数が非常に少ないのが難点ではあるが,こうした手法は重要であり,双極性障害におけるエピジェネティクスの役割を理解するうえで適切である.同様の手法でより大きいサンプル数による研究が待ち望まれる.
双極性障害は,家族内での遺伝率が高いことから,遺伝子素因による病因の可能性が高いと考えられ,多くの遺伝子研究が積み重ねられてきた.しかし,遺伝率が高いとはいっても100%ではなく,80~90%と報告されており,一卵性双生児においても必ずしも双子の両方が罹患するわけではないことが知られている.その原因には環境の影響があることも知られているが,おそらくその一部は,分子レベルにおいてはエピジェネティクスが関与しているのであろうと推察されている.そのため,理化学研究所の加藤,岩本らは,まず一卵性双生児の双極性障害不一致例のDNAのメチル化の違いを調べることで,候補遺伝子領域を洗い出し,その遺伝子のDNAのメチル化の違いをさらに多数の疾患群と健常群で比較して確認した8).Dempster, E. L. らも同様の手法を採用し,双極性障害のみでなく,統合失調症も調べ,両者をまとめた群から,ST6GALNAC1という遺伝子に違いがあることを報告している3).残念ながら,明らかに似た手法を用いた2つの研究結果は一致せず,さらなる研究が必要であることを示している.
3.大うつ病
大うつ病の最初のゲノム網羅的エピジェネティクス研究はPotash, J. B. らのグループによって発表されている.この研究では39例の患者死後脳の前頭葉を使用し,26例の健常群と比較している17).この研究ではcomprehensive high-throughput arrays for relative methylation(CHARM)platformと呼ばれる実に350万ヵ所のCpGをカバーする手法が用いられた.メチル化に10%以上の差がある224ヵ所の候補領域を発見し,別サンプルで再現性を調べた結果,proline-rich membrane anchor 1(PRIMA1)という遺伝子の領域でDNAのメチル化が患者群で12~15%高く,発現も低下し,統計的にも有意であることが確認された.その後,近年,いくつかゲノム網羅的な研究が報告されている.注意すべき点としては,患者群では投薬治療を受けていることがほとんどであり,その場合,薬剤のエピジェネティクスの状態への影響が懸念される.そのため,徳島大学の沼田らは,投薬を受けたことがない患者群を用いて健常群とDNAのメチル化を比較した研究を発表している.39名のテスト群と,24名の再現性を確認するための群をイルミナ社の450Kアレイで測定し,DNAのメチル化に違いがあるCpGを用いると,罹患の有無を正確に予測できるということを報告している11).こうした研究手法は極めて重要であり,今後,さらに多数のサンプルを用いた研究で確認されれば,将来的にはうつ病の診断,他の精神疾患との鑑別,治療反応性の予後判定などに応用できるのではと期待されている.
4.PTSD
環境によりエピジェネティクスの状態が変化するという概念は,精神疾患で最も重要な環境因子の1つであるストレスやトラウマの研究で特に注目を集め,したがって,PTSDは最もエピジェネティクス研究がされている分野の1つとなっている.候補遺伝子研究ではトラウマやストレス応答の観点から,HPA axisにかかわる遺伝子が検討され,先に述べたグルココルチコイド受容体(NR3C1)遺伝子24)や,そのコシャペロン蛋白であるFK506 binding protein(FKBP5)7)25)などが調べられてきた.そのなかで最も注目に値する候補遺伝子研究の1つがRessler, K. J. らの報告したPAC1(ADCYAP1R1)であろう15).この研究ではPAC1遺伝子のメチル化の程度とPTSDの重症度が相関していることが報告されている(r=0.354,P<0.0005).ゲノム網羅的研究で最初のものは,2つほぼ同時に同じような研究が発表されている.1つはエモリー大学のSmith, A. K. らによる,ジョージア州アトランタにある貧困地域の患者層を対象にしたもの20),もう1つがミシガン大学のUddin, M. らによる,デトロイトの貧困層を対象にしたものである22).両研究ともイルミナ社の27Kアレイという初期の手法を用いて合計100名ほどをPTSDの有無で比較している.両研究とも炎症反応や免疫に関連した遺伝子が有意な差を示したと報告しており,個々の遺伝子では異なっていたものの,PTSDの病態にそうした機序がかかわっている可能性を示唆している点は,さらなる検討に値するものといえる.その後,同じエモリー大学のグループは,ゲノム領域のカバー範囲が20倍近く増えたイルミナ社の450Kアレイを用いて同様の貧困層を対象に研究し,さらに報告をしているが,PTSDの患者群でも,児童虐待歴の有無によって,メチル化に差がみられる遺伝子のネットワークはまったく異なるということを示したことは注目に値する9).近年では,Psychiatric Genomics Consortium(PGC)のグループの1つであるPGC PTSDのなかに,著者も参加しているEpigenome-Wide Association Study(EWAS)グループが組織され,多施設の研究者が参加して研究に取り組んでいる.2017年現在,サンプル数は1,800を超えているが,GWASと比べるとまだまだ少なく,著者の研究チームもサンプル数の増加に貢献すべく研究を進めているところである.
5.依存症
依存症のなかでも重要なアルコール依存症では近年になってやっとゲノム網羅的手法の研究が報告されつつあるが,まだまだ少数である16).依存症のエピジェネティクス研究で留意しなくてはならないのは,依存症の場合,薬物そのものに対する曝露によるエピジェネティクスの変化をみているのか,あるいは,依存症の原因としてよく知られている環境要因,例えば児童虐待歴,ストレス,他の精神疾患の罹患状態などの影響をみているのかという点であり,文献を吟味するうえで注意が必要である.
精神科関連のエピジェネティクス研究で現在のところ最も再現性が高いと考えられているのがニコチン依存症におけるaryl hydrocarbon receptor repressor(AHRR)遺伝子のメチル化であろう10)13)14).とくに特定のCpG[cg05575921]のメチル化は喫煙に関連して何度も再現され,精神科遺伝学では稀にみる極めて小さいP値が報告されている.そのため,臨床応用も間近とされている.
おわりに
以上の研究成果は,ヒトの行動,内分泌機能,生理的機能などがエピジェネティクスによって変更を受けている可能性を示している.そうしたエピジェネティクスの変化がストレスやトラウマなどの環境によって形作られるとするならば,精神療法や薬剤などによる治療効果もまた,エピジェネティクスの変化を元に戻すことにより導かれている可能性があるとも考えられ,将来の治療選択のバイオマーカーとしての有用性が期待されるところである.著者が遺伝子とエピジェネティクスを比較して考えるときに例として用いるのは,コンピューターでいうハードウェアとソフトウェアの違いである.遺伝情報はある意味,ハードウェアのように,どんなに細かく分解して解析しても違いはあったとしてもわかりにくいし,固定されたパーツは変更不可能である.一方,エピジェネティクスは,成長過程に応じて経験により変更を受け続ける点が,ソフトウェアのようにプログラムされるものと考えられ,機能や行動を理解するには,プログラムを「読む」必要があるのであろう.さらに重要と考えるのは,エピジェネティクスによるプログラムが書き換え可能であるならば,エピジェネティクスを変化させることで,精神疾患の治療が可能になるかもしれない,という希望を精神科医に与えてくれることなのである.
なお,本論文に関連して開示すべき利益相反はない.
1) Aberg, K. A., McClay, J. L., Nerella, S., et al.: Methylome-wide association study of schizophrenia: identifying blood biomarker signatures of environmental insults. JAMA Psychiatry, 71 (3); 255-264, 2014![]()
2) Braun, P., Hafner, M., Nagahama, Y., et al.: Genome-wide DNA methylation comparison between live human brain and peripheral tissues within individuals. Eur Neuropsychopharmacol, 27; S506, 2017
3) Dempster, E. L., Pidsley, R., Schalkwyk, L. C., et al.: Disease-associated epigenetic changes in monozygotic twins discordant for schizophrenia and bipolar disorder. Hum Mol Genet, 20 (24); 4786-4796, 2011![]()
4) Fuchikami, M., Morinobu, S., Segawa, M., et al.: DNA methylation profiles of the brain-derived neurotrophic factor (BDNF) gene as a potent diagnostic biomarker in major depression. PLoS One, 6 (8); e23881, 2011![]()
5) Hannon, E., Lunnon, K., Schalkwyk, L., et al.: Interindividual methylomic variation across blood, cortex, and cerebellum: implications for epigenetic studies of neurological and neuropsychiatric phenotypes. Epigenetics, 10 (11); 1024-1032, 2015![]()
6) Heim, C., Newport, D. J., Heit, S., et al.: Pituitary-adrenal and autonomic responses to stress in women after sexual and physical abuse in childhood. JAMA, 284 (5); 592-597, 2000![]()
7) Klengel, T., Mehta, D., Anacker, C., et al.: Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat Neurosci, 16 (1); 33-41, 2013![]()
8) Kuratomi, G., Iwamoto, K., Bundo, M., et al.: Aberrant DNA methylation associated with bipolar disorder identified from discordant monozygotic twins. Mol Psychiatry, 13 (4); 429-441, 2008![]()
9) Mehta, D., Klengel, T., Conneely, K. N., et al.: Childhood maltreatment is associated with distinct genomic and epigenetic profiles in posttraumatic stress disorder. Proc Natl Acad Sci U S A, 110 (20); 8302-8307, 2013![]()
10) Monick, M. M., Beach, S. R., Plume, J., et al.: Coordinated changes in AHRR methylation in lymphoblasts and pulmonary macrophages from smokers. Am J Med Genet B Neuropsychiatr Genet, 159B (2); 141-151, 2012![]()
11) Numata, S., Ishii, K., Tajima, A., et al.: Blood diagnostic biomarkers for major depressive disorder using multiplex DNA methylation profiles: discovery and validation. Epigenetics, 10 (2); 135-141, 2015![]()
12) Philibert, R. A., Sandhu, H., Hollenbeck, N., et al.: The relationship of 5HTT (SLC6A4) methylation and genotype on mRNA expression and liability to major depression and alcohol dependence in subjects from the Iowa Adoption Studies. Am J Med Genet B Neuropsychiatr Genet, 147B (5); 543-549, 2008![]()
13) Philibert, R. A., Beach, S. R., Brody, G. H.: Demethylation of the aryl hydrocarbon receptor repressor as a biomarker for nascent smokers. Epigenetics, 7 (11); 1331-1338, 2012![]()
14) Philibert, R. A., Beach, S. R., Lei, M. K., et al.: Changes in DNA methylation at the aryl hydrocarbon receptor repressor may be a new biomarker for smoking. Clin Epigenetics, 5 (1); 19, 2013![]()
15) Ressler, K. J., Mercer, K. B., Bradley, B., et al.: Post-traumatic stress disorder is associated with PACAP and the PAC1 receptor. Nature, 470 (7335); 492-497, 2011![]()
16) Ruggeri, B., Nymberg, C., Vuoksimaa, E., et al.: Association of protein phosphatase PPM1G with alcohol use disorder and brain activity during behavioral control in a genome-wide methylation analysis. Am J Psychiatry, 172 (6); 543-552, 2015![]()
17) Sabunciyan, S., Aryee, M. J., Irizarry, R. A., et al.: Genome-wide DNA methylation scan in major depressive disorder. PLoS One, 7 (4); e34451, 2012![]()
18) Sabunciyan, S., Maher, B., Bahn, S., et al.: Association of DNA methylation with acute mania and inflammatory markers. PLoS One, 10 (7); e0132001, 2015![]()
19) Shinozaki, G., Braun, P., Hing, B., et al.: Genome-wide DNA methylation comparison by illumina epic array between live human brain and peripheral tissues within individuals. Biol Psychiatry, 81 (10); S24, 2017
20) Smith, A. K., Conneely, K. N., Kilaru, V., et al.: Differential immune system DNA methylation and cytokine regulation in post-traumatic stress disorder. Am J Med Genet B Neuropsychiatr Genet, 156B (6); 700-708, 2011![]()
21) Smith, A. K., Kilaru, V., Klengel, T., et al.: DNA extracted from saliva for methylation studies of psychiatric traits: evidence tissue specificity and relatedness to brain. Am J Med Genet B Neuropsychiatr Genet, 168B (1); 36-44, 2015![]()
22) Uddin, M., Aiello, A. E., Wildman, D. E., et al.: Epigenetic and immune function profiles associated with posttraumatic stress disorder. Proc Natl Acad Sci U S A, 107 (20); 9470-9475, 2010![]()
23) Weaver, I. C., Cervoni, N., Champagne, F. A., et al.: Epigenetic programming by maternal behavior. Nat Neurosci, 7 (8); 847-854, 2004![]()
24) Yehuda, R., Daskalakis, N. P., Lehrner, A., et al.: Influences of maternal and paternal PTSD on epigenetic regulation of the glucocorticoid receptor gene in Holocaust survivor offspring. Am J Psychiatry, 171 (8); 872-880, 2014![]()
25) Yehuda, R., Daskalakis, N. P., Bierer, L. M., et al.: Holocaust exposure induced intergenerational effects on FKBP5 methylation. Biol Psychiatry, 80 (5); 372-380, 2016![]()
26) Yoshino, Y., Kawabe, K., Mori, T., et al.: Low methylation rates of dopamine receptor D2 gene promoter sites in Japanese schizophrenia subjects. World J Biol Psychiatry, 17 (6); 449-456, 2016![]()
27) Zhang, A. P., Yu, J., Liu, J. X., et al.: The DNA methylation profile within the 5'-regulatory region of DRD2 in discordant sib pairs with schizophrenia. Schizophr Res, 90 (1-3); 97-103, 2007![]()