【背景】グリシン開裂系は脳内NMDA受容体機能を制御している可能性が示唆されている.同系遺伝子の機能喪失に起因するグリシン脳症の非典型例は統合失調症類似の精神症状を呈する場合がある.本研究では統合失調症のNMDA受容体機能低下仮説に基づき,グリシン開裂系の本病態への関与を検討した.【方法】統合失調症患者474名と健常対照者475名を対象とし,グリシン開裂系遺伝子群(GLDC,AMT,GCSH,DLD)の全コーディング領域のDNA配列解析およびGLDCエクソン欠失解析を行い,疾患との遺伝学的関連を検討した.次に,同系遺伝子変異保持者の血漿を用いたメタボローム解析から,変異と代謝産物量の関連,代謝産物量と臨床指標との相関を調べた.【結果】遺伝学的解析では,患者群で非典型グリシン脳症原因変異近傍の変異,統合失調症と病態基盤を共有する可能性のある神経管欠損症の原因と想定される変異,ナンセンス変異など,機能的影響が示唆される変異を認めた.メタボローム解析では,変異保持患者でNMDA受容体機能にかかわりうる5-オキソプロリン,アスパラギン酸,グルタミン酸の濃度上昇を見出し,臨床指標では陰性症状とアスパラギン酸濃度の間に負の相関を認めた.【結論】グリシン開裂系遺伝子の稀な変異は,アスパラギン酸濃度上昇を通して統合失調症の陰性症状軽減に関与している可能性が示唆された.
2)(現所属)Northwestern University,Feinberg School of Medicine,Psychiatry and Behavioral Sciences,東京都医学総合研究所統合失調症プロジェクト
3)(現所属)東京大学バリアフリー支援室
はじめに
統合失調症においては遺伝要因の関与が示されており,多くのゲノム研究がなされているが,近年では頻度の高いDNA多型に加え,稀な変異の病態への関与の可能性についても注目されている5)12).これまで,統合失調症においてはN-methyl-D-aspartate型グルタミン酸受容体(NMDA受容体)機能低下仮説が病態仮説として支持されてきた3)8)9)15)17).グリシンはNMDA受容体のコ・アゴニストとしてD-セリンとともにNMDA受容体の機能調節にかかわる9)16).グリシン開裂系は,グリシンデカルボキシラーゼ(glycine decarboxylase:GLDC),アミノメチルトランスフェラーゼ(aminomethyltransferase:AMT),グリシン開裂系タンパク質H(glycine cleavage system protein H:GCSH),ジヒドロリポアミドデヒドロゲナーゼ(dihydrolipoamide dehydrogenase:DLD)より構成されるグリシンの主要な代謝系であるが7),脳内では,NMDA受容体と共局在し,D-セリンの動態に関与している可能性が示されるなど,同受容体機能の直接的な制御が示唆されている13)14).同系遺伝子の変異あるいはGLDCエクソン欠失による機能喪失は,常染色体劣性遺伝病であるグリシン脳症を引き起こし7),典型例は新生児早期に死亡する一方11)18),非典型例には遅発性に精神症状を呈する症例が存在する1)2)6).
I.研究の方法および結果
1.対象および方法
東京大学医学部附属病院精神神経科および関連施設で収集された日本人統合失調症患者474名,および健常対照者475名を対象として,全コーディング領域およびスプライス部位のDNA配列解析およびMLPA法によるGLDCエクソン欠失解析を行った.DNA配列解析は,次世代シークエンサーMiSeq(イルミナ社)により,TruSeq Custom Ampliconを用いて行い,アンプリコン設計困難領域/低カバレッジ領域の配列解析,および次世代シークエンサーによる配列解析結果の確認はサンガー法で行った.アレル頻度0.5%以下の稀な変異に注目し,患者群および健常対照群における総数の比較を行うとともに,dbNSFP(https://sites.google.com/site/jpopgen/dbNSFP)を用い変異の機能を評価した.
メタボローム解析は血漿が採取可能であったグリシン開裂系遺伝子群の変異保持患者5名および健常者5名を対象とし,CE-TOFMS法により行った.また,代謝産物相対値の2群比較はStudent's t-testにより行い,続いて,患者群において代謝産物相対値と陽性・陰性症状評価尺度(Positive and Negative Syndrome Scale:PANSS)スコアの相関を調べた.本研究はヘルシンキ宣言に基づき東京大学大学院医学系研究科倫理審査委員会で承認され〔承認番号No. G0639-(33)〕,すべての対象者から書面にて研究参加の同意および承諾を得て実施された.
2.結 果
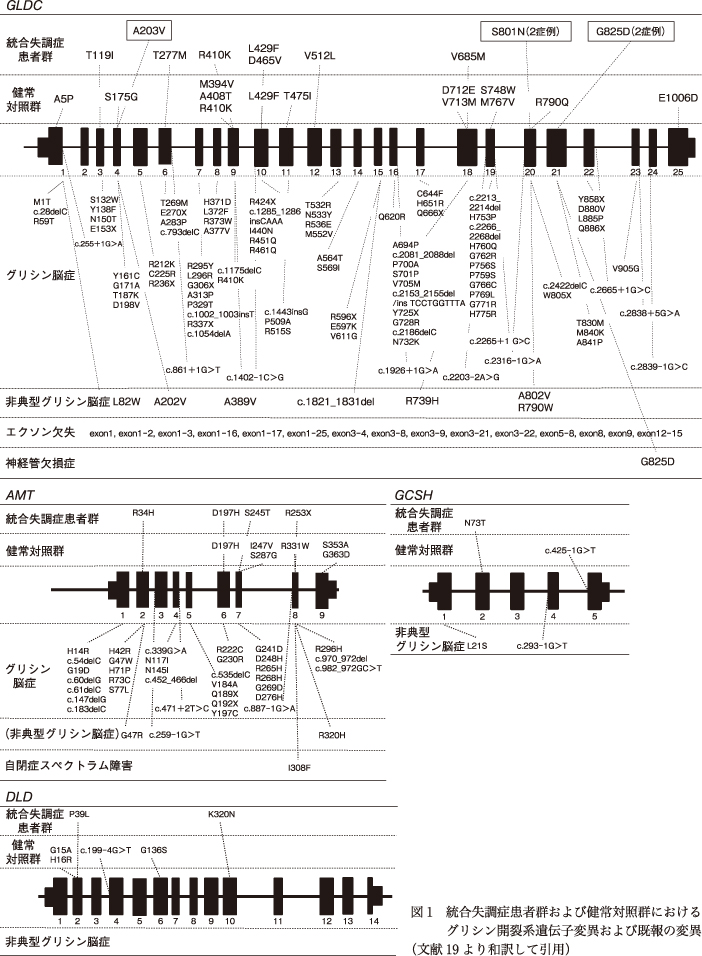
DNAのquality不良と判定された患者8検体および健常者12検体を除外し,患者466名および健常者463名を解析した.配列解析結果およびGLDCエクソン欠失解析結果から,非典型グリシン脳症が統合失調症と診断されている症例に含まれている可能性は本研究の対象患者群においては否定的であった.稀な非同義置換およびスプライス部位の変異と疾患との関連について,変異総数を患者群と健常群間で比較したが,いずれの遺伝子においても有意差は認められなかった(GLDC:P=1.000,AMT:P=0.419,GCSH:P=0.624,DLD:P=0.725,Fisher's exact test).しかしながら,見出された稀な変異を詳細に検討したところ,患者群では非典型グリシン脳症の原因変異の隣のアミノ酸置換を伴う変異(GLDC A203V 1名,GLDC S801N 2名),ヘテロ接合体で神経管欠損症の原因の可能性が示唆されている変異(GLDC G825D 2名),ナンセンス変異(AMT R253X 1名)など病態への関与が示唆される変異を患者群において認めた(図1).
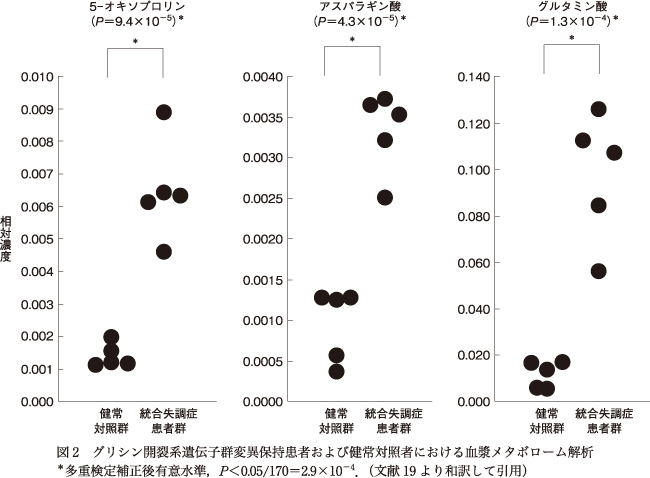
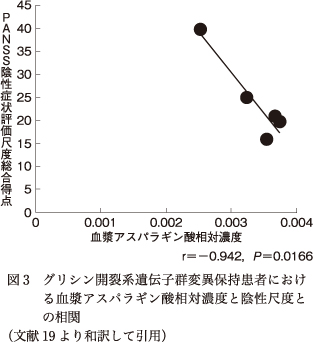
メタボローム解析では,稀な非同義置換(GLDC:T119I,A203V,V685M,S801N,DLD P39 L)をヘテロ接合体で保持する患者の血漿において,170の候補代謝産物中,3代謝産物で有意な上昇が認められた(図2).また,各代謝産物とPANSSスコアとの相関を調べたところ,アスパラギン酸では,陰性症状との間に有意な負の相関が認められた(図3).
II.考察―本論文の意義,苦労・工夫したことなどを含めて―
今回われわれは,グリシン開裂系遺伝子群と統合失調症との遺伝学的解析から,患者群において,非典型グリシン脳症の原因変異近傍の変異や,本症と疫学的関連が示唆され病態基盤を一部共有する可能性のある神経管欠損症の原因変異の可能性が示唆される変異,ナンセンス変異などの機能的影響の可能性がある変異を見出した19).また,メタボローム解析から,変異保持患者で上昇が見出されたL-グルタミン酸およびアスパラギン酸,グルタミン酸の前駆物質5-オキソプロリンは,いずれもNMDA受容体機能にかかわる可能性があり10),さらに,陰性症状との間に相関が認められたアスパラギン酸は先行研究においても治療抵抗性統合失調症治療薬クロザピンによる陰性症状改善との相関が報告されている4).変異保持患者では,アスパラギン酸の濃度上昇が,陰性症状の軽減に影響していた可能性が考えられた.
統合失調症の遺伝学的研究はこれまで精力的に行われ,ゲノムワイド関連研究やエクソーム解析などにより,NMDA受容体機能低下仮説を支持する所見も報告されてきているが,本論文は,NMDA受容体機能を直接制御することが示唆されているグリシン開裂系について,非典型例を含めグリシン脳症が統合失調症と診断されている症例に含まれている可能性を想定して研究を行っている.研究を進めるにあたっては,次世代シークエンサーの精度が未知であり,結果として候補となった変異はすべてサンガー法で確認し直す必要があったこと,また,稀な変異保持者に注目してのメタボローム解析を行わざるを得なかったため,解析対象が小集団となってしまった点などにおいて苦慮した.
おわりに―今後の課題および方向性―
本研究ではNMDA受容体機能低下仮説に基づき,グリシン開裂系の統合失調症病態への関与を検討し,同系遺伝子変異保持患者におけるNMDA受容体機能に関与しうる代謝産物の濃度上昇,さらに陰性症状とアスパラギン酸濃度の負の相関を示した.アスパラギン酸の濃度上昇と陰性症状軽減の機序が明らかとなり,陰性症状の新規治療につながれば,本症患者の社会復帰を含めた長期予後の改善に寄与する可能性がある.
本研究は科学研究費補助金(No. JP16H06395,16H06399,16K21720)および日本医療研究開発機構からの助成を受けて行われた.
本論文はPCN誌に掲載された最新の研究論文19)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して,開示すべき利益相反はない.
謝 辞 研究に参加いただいたすべての方々に謝意を表します.
1) Dinopoulos, A., Kure, S., Chuck, G., et al.: Glycine decarboxylase mutations: a distinctive phenotype of nonketotic hyperglycinemia in adults. Neurology, 64; 1255-1257, 2005![]()
2) Dinopoulos, A., Matsubara, Y., Kure, S.: Atypical variants of nonketotic hyperglycinemia. Mol Genet Metab, 86; 61-69, 2005![]()
3) Dracheva, S., Marras, S. A., Elhakem, S. L., et al.: N-methyl-D-aspartic acid receptor expression in the dorsolateral prefrontal cortex of elderly patients with schizophrenia. Am J Psychiatry, 158; 1400-1410, 2001![]()
4) Evins, A. E., Amico, E. T., Shih, V., et al.: Clozapine treatment increases serum glutamate and aspartate compared to conventional neuroleptics. J Neural Transm, 104; 761-766, 1997![]()
5) Genovese, G., Fromer, M., Stahl, E. A., et al.: Increased burden of ultra-rare protein-altering variants among 4,877 individuals with schizophrenia. Nat Neurosci, 19; 1433-1441, 2016![]()
6) Hayasaka, K., Tada, K., Fueki, N., et al.: Nonketotic hyperglycinemia: analyses of glycine cleavage system in typical and atypical cases. J Pediatr, 110; 873-877, 1987![]()
7) Kikuchi, G.: The glycine cleavage system: composition, reaction mechanism, and physiological significance. Mol Cell Biochem, 1; 169-187, 1973![]()
8) Kim, J. S., Kornhuber, H. H., Schmid-Burgk, W., et al.: Low cerebrospinal fluid glutamate in schizophrenic patients and a new hypothesis on schizophrenia. Neurosci Lett, 20; 379-382, 1980![]()
9) Labrie, V., Roder, J. C.: The involvement of the NMDA receptor D-serine/glycine site in the pathophysiology and treatment of schizophrenia. Neurosci Biobehav Rev, 34; 351-372, 2010![]()
10) Mashkina, A. P., Tyulina, O. V., Solovyova, T. I., et al.: The excitotoxic effect of NMDA on human lymphocyte immune function. Neurochem Int, 51; 356-360, 2007![]()
11) Perry, T. L., Urquhart, N., MacLean, J., et al.: Nonketotic hyperglycinemia. Glycine accumulation due to absence of glycerine cleavage in brain. N Engl J Med, 292; 1269-1273, 1975![]()
12) Purcell, S. M., Moran, J. L., Fromer, M., et al.: A polygenic burden of rare disruptive mutations in schizophrenia. Nature, 506; 185-190, 2014![]()
13) Sakata, Y., Owada, Y., Sato, K., et al.: Structure and expression of the glycine cleavage system in rat central nervous system. Brain Res Mol Brain Res, 94; 119-130, 2001![]()
14) Sato, K., Yoshida, S., Fujiwara, K., et al.: Glycine cleavage system in astrocytes. Brain Res, 567; 64-70, 1991![]()
15) Schizophrenia Working Group of the Psychiatric Genomics Consortium: Biological insights from 108 schizophrenia-associated genetic loci. Nature, 511; 421-427, 2014![]()
16) Thomson, A. M.: Glycine is a coagonist at the NMDA receptor/channel complex. Prog Neurobiol, 35; 53-74, 1990![]()
17) Timms, A. E., Dorschner, M. O., Wechsler, J., et al.: Support for the N-methyl-D-aspartate receptor hypofunction hypothesis of schizophrenia from exome sequencing in multiplex families. JAMA Psychiatry, 70; 582-590, 2013![]()
18) Trauner, D. A., Page, T., Greco, C., et al.: Progressive neurodegenerative disorder in a patient with nonketotic hyperglycinemia. J Pediatr, 98; 272-275, 1981![]()
19) Yoshikawa, A., Nishimura, F., Inai, A., et al.: Mutations of the glycine cleavage system genes possibly affect the negative symptoms of schizophrenia through metabolomic profile changes. Psychiatry Clin Neurosci, 72; 168-179, 2018![]()