がん患者は様々な苦痛を経験するが,その中の1つに認知機能障害がある.がんの診断あるいは治療に関連するこの認知機能障害は総称して“cancer related cognitive impairment(CRCI)”と呼ばれている.このうち,特に化学療法,ホルモン療法,放射線療法といったがん治療に関連した認知機能障害に関する報告が近年増えている.がん患者は,病状や治療に関する不安や心配を抱えるだけではなく,記憶や注意力,集中力などの問題も経験していることは決して少なくない.CRCIは,たとえ障害が微細であっても,社会とのかかわり,労働能力などに加え,治療方針決定への参加,意義のある生活を送る上で患者に大きな影響を与える.これまでの研究では,およそ75%(12~82%)のがん患者がCRCIを経験するといわれており,さらに,長期(~20年)にわたって続く症例も報告されている.しかしながら,医師や医療スタッフのほとんどはCRCIを認知していないか,その理解に乏しい.CRCIは,主に血液循環中の炎症性サイトカインの上昇やホルモンの変化によって引き起こされると考えられている.また,がん自体による影響,ストレス,注意疲労,さらには個々の要因として,遺伝的要因,合併症・併存症の種類や数による影響が考えられている.研究者のみならず患者自身も,有効な介入方法や日常で役に立つ対処行動を積極的に模索している.多くの患者は,自分の病状や今後の治療について医療者や家族と話し合いたいと思っており,さらに,その中には終末期のケアについても話し合いたいと思っている患者もいる.しかしながら,認知機能障害をもつと,明確な自分の意思を表明することは困難となる.アドバンス・ケア・プラニング(ACP)はそのような状況に備えたコミュニケーションを支援・促進する方法の1つである.この過程では,患者,家族と医療者が一緒になって,患者の価値観や望む治療,終末期をどのように過ごしたいか,どのようなケアを受けたいかといった希望を明確化し,熟考し,共有する.超高齢化社会を迎えて,認知機能障害をもつがん患者は明らかに増加している.精神科医は,適切な介入やケアの発展をめざすとともに,患者の意に沿ったケアが提供できるようにACPの重要性についても理解を深めておくことが必要である.本総説では,これまであまり扱われてこなかった「がん医療における様々な認知機能障害と今後の課題」について,特に化学療法,ホルモン療法,放射線療法など治療に関連する影響について概説する.また,認知機能障害や意識障害などの進行によって,患者本人の意思表示が困難な状態となった場合に,意思決定の助けとなるACPについても簡単に紹介する.
京都大学医学部附属病院緩和ケアセンター/緩和医療科
はじめに
がんは病死の第1位を占める重大な疾患であり,その脅威は患者とその家族に大きな心理的反応を引き起こす.2007年4月に施行された「がん対策基本法」に基づき,2007年6月に策定されたがん対策推進基本計画の中で,がん患者およびその家族への心のケアの重要性が強調され,精神腫瘍医の育成が必要であることが明記された.さらには,2008年の診療連携拠点病院の整備指針では,精神科医を含む緩和ケアチームを設置する義務も述べられている.近年のこれらの政策からもわかるように,がん医療ではこれまで以上に精神科医の参加が強く求められている.
精神腫瘍学(psycho-oncology)とは,「がんが精神医学的にどのような影響を患者やその家族に与えるか」,そして,「精神医学的問題ががんにどのような影響をもたらすか」といった双方向性の疑問を対象とする学問領域である.近年のメタ解析によると,25~30%のがん患者になんらかの精神医学的診断が該当し,その主なものはうつ病,不安障害,適応障害などである63)80).こうした傾向はがんの進行に伴って変化し,せん妄などの意識変容の頻度が高くなっていく51)64).したがって,がん医療における精神医学的問題では,まずこの不安・抑うつ,せん妄をしっかり理解しておく必要があり,さらに,「がん医療におけるコミュニケーション」を加えた教育プログラムが,2008年3月に策定された,「がん診療に携わる医師に対する緩和ケア研修会の開催指針」に基づき全国で開催されている.
一方,未曾有の超高齢化社会を迎えた現在,高齢がん患者の増加(65歳以上)とともに認知症を伴うがん患者と遭遇する機会も増えている.そのため,緩和ケアチームや精神科医に対する依頼として,がん患者の認知機能障害についての相談も増えてきている.しかしながら,がん患者に認められる認知機能障害はせん妄や認知症ばかりではない.化学療法や放射線療法による認知機能への影響も近年注目を集めている.がん患者の認知機能は,がん治療中における治療選択や治療後の社会機能の維持,有意義な生活を送る上で非常に重要であり,患者の治療アドヒアランスやquality of life(QOL)の障害,あるいは様々な場面での意思決定,家族とのコミュニケーションなどにも大きく影響する10).
本総説では,これまであまり扱われてこなかった「がん医療における様々な認知機能障害と今後の課題」について,特に化学療法,ホルモン療法,放射線療法など治療に関連する影響について概説する.また,認知機能障害や意識障害などの進行によって,患者本人の意思表示が困難な状態となった場合に,意思決定の助けとなるアドバンス・ケア・プラニング(advance care planning:ACP)についても簡単に紹介する.
I.がん患者にみられる認知機能障害
化学療法,放射線療法の進歩や分子標的療法の開発は,生存率に大きく貢献している.しかし,これらの治療法の発展は,副作用により患者のQOLを大きく損ねる側面もある.副作用の中でも認知機能障害は,治療中,特に抗がん剤による化学療法中に生じる頻度の高い症状の1つとして近年注目されている.一方,がん患者では,がん治療の前からなんらかの認知機能障害が認められることも報告されている.このように,がん患者に認められる認知機能障害を総称して,“cancer related cognitive impairment(CRCI)”と呼ぶ.CRCIに関する長期にわたる神経心理学的評価を行った研究によると,がんの治療を受ける前から約30%の患者に,また治療経過中には75%に及ぶ患者に認知機能障害が認められ,このうち35%は治療終了後も数ヵ月~数年にわたり症状が継続していたことが報告されている36).
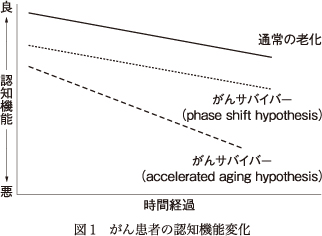
CRCIには,軽度な障害から重度な障害,一時的なものから長期的に続くもの,安定するものから進行するもの,また,その進行のスピード自体が通常の加齢性変化と変わらないものとそれ以上に加速するものなど様々なバリエーションがある7)(図1).最近の研究では,化学療法を受ける患者のCRCIは遅発性であり96),治療終了後も20年近く続く可能性も報告されている47).
このようなことから近年,CRCIの問題点の整理やそのメカニズムの解明,マネジメントストラテジーを検討した研究も活発になってきている.
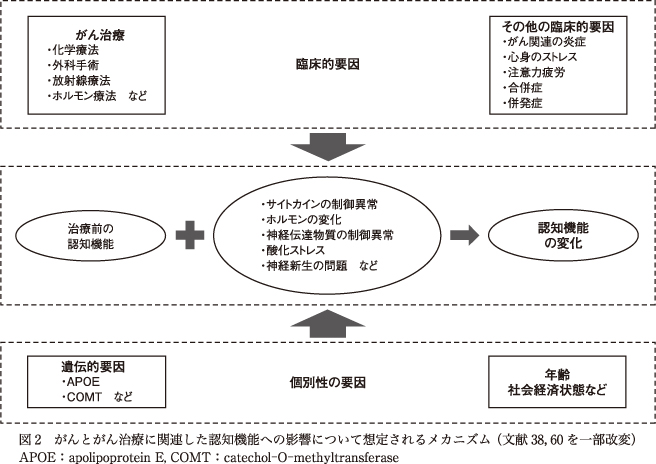
CRCIの想定されているメカニズムとしては,炎症性サイトカインの増加やホルモンの変化などの関与4),がんの生物学的要因以外のストレスや倦怠感などによる影響23)42),さらには遺伝的要因や合併症,併存症など個々の症例で異なる要因などが考えられている.また,認知機能障害の重症度は年齢に影響を受けやすいことも知られている7)(図2).
1.治療前にみられる認知機能障害
化学療法などの治療前(ベースライン)における認知機能は,外科治療20)や手術中に行われる麻酔36),あるいはがん自体により,すでに影響を受けている可能性が示唆されている.これまでの調査では,がん患者の30%に,健常群と比べ化学療法前に,言語学習や言語記憶,反応時間5),あるいは全般機能39)における障害が認められたという報告がある.また,がんの診断後に生じた不安や抑うつといった心理精神的問題やその対処行動によって認知機能が影響を受ける可能性も示唆されている72).
2.放射線療法に関連した認知機能障害
放射線による脳障害は,部分照射,全脳照射で認められ,形態的にも機能的にも変化をもたらす.臨床症状の発現時期から,急性障害,早期障害,晩期障害に分けられている87).急性障害は,放射線照射後,数日~数週で認められるものであり,近年の放射線療法の技術ではめったにみられないものになっている.早期障害は,照射して1~6ヵ月後に生じるものであり,脱髄性の障害を伴い眠気・傾眠などが認められる.通常,これらの急性,早期の脳障害は可逆性であり自然に軽快する.一方,晩発性の脳障害は,放射線照射後6ヵ月以上経過して起こるものであり,血管の異常や脱髄性の変化が認められ,最終的に白質壊死などの組織的変化をきたす.この晩発性脳障害は不可逆性かつ進行性であるといわれている75).
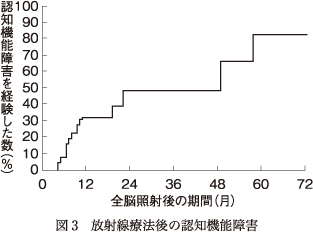
脳への放射線照射による認知機能障害は,放射線療法を受けてから半年以上経過した成人男性の50~90%に認められる21)30)41)61).この認知機能障害では,言語性記憶,空間認知,注意機能,問題解決能力などが障害されることが報告されているが32)50)73)88),この他にも,倦怠感,気分の変動も認められる31).また,放射線療法を受けた患者の20%が,認知機能障害の影響でKarnofsky performance statusが10%以上低下するとも報告されている69).頻度および重症度は経過とともに増加し,約2年後には49%が重大な認知機能障害を呈する(図3)69).中には,進行性の記憶障害,運動失調,尿失禁などを呈する認知症に進行する例もある91).1回の照射が3グレイ以下であれば,認知症への進行はまれだと考えられているが,照射後2年以上経過した患者では,経過とともに認知症の発生リスクは上昇する76).このような晩発性脳障害は,グリア細胞や血管内皮細胞の増殖能の低下の結果として最終的に白質の壊死が起きるため生じると考えられてきたが,画像的あるいは臨床的には脱髄性の変化や白質の壊死などの所見はとらえられていない25)77).近年では,酸化ストレスや慢性炎症,神経新生への影響の観点からの研究が進められており,同時に抗酸化作用物質,抗炎症物質,神経幹細胞移植による介入法も検討されている.
3.化学療法およびホルモン療法に関連した認知機能障害
化学療法による認知機能障害はもっとも研究されている領域の1つである8).いくつかの抗がん剤,特に脳腫瘍治療を目的とした抗がん剤(carmustineなど)は,血液脳関門を通過する.また,髄腔内投与を行う薬剤(methotrexateなど)では,中枢神経系に直接的なダメージが生じる可能性もある4).高濃度の抗がん剤治療では,通常濃度の治療よりも強いダメージを与えるし89),さらに抗がん剤治療に伴う心臓毒性によって脳血流が低下することでも,認知機能へ影響をもたらす場合がある4).これらの研究報告の多くは乳がん患者を対象としたものであるが,補助化学療法後の15~75%の患者に軽度から中等度の認知機能障害が認められると報告されており,“chemobrain”あるいは“chemofog”と呼ばれている2)16)74)85)86).
一方,ホルモン療法では,ホルモンレベルの変化によって認知機能障害が認められる13).例えばエストロゲンは,言語性記憶や学習などに重要な役割を果たしており,アセチルコリンの産生,海馬に代表される記憶機能に関係した脳領域のシナプス構築の促進などにも関与している53).乳がんの治療では,抗エストロゲン療法として,アロマターゼ阻害薬や抗エストロゲン薬(tamoxifenなど)がホルモン感受性腫瘍の再発防止のために用いられる.この治療によって閉経状態になると,エストロゲンレベルが減少し,認知機能の変化も引き起こされることがある13).化学療法,ホルモン療法を受けた患者群と健常群において認知機能を比較した研究では,化学療法のみならず,ホルモン療法においてもCRCIが認められている6).また,化学療法とtamoxifenの併用は化学療法単独群よりも認知機能障害の程度が強かったといった報告もある18)70).一方,テストステロンも海馬のシナプス密度維持のみならず,認知機能,特に視空間認知やワーキングメモリーに重要な役割を果たし,気分や認知機能の向上と関係するが,そのレベル低下によって倦怠感,抑うつ気分,認知機能障害を引き起こすことがある11).ホルモン感受性前立腺がんの治療に用いられるアンドロゲン除去療法は,テストステロンの高度な減少をもたらし,認知機能障害を引き起こしうる68).先述のアロマターゼは,テストステロンをエストロゲンに変換するため,テストステロンの減少はエストロゲンの減少も引き起こす.したがって,このエストロゲンの減少が,アンドロゲン除去療法の際の前立腺がん患者の認知機能にも影響していると考えられている19)68).
II.Cancer related cognitive impairmentの背景因子や想定されている病態とそのメカニズム
1.患者背景と医学的特徴
もっともよく説明される要因は年齢であるが若年者でも認められる.また,人種,民族性,社会経済的地位,閉経後,病期,食事やbody mass indexなどの影響54)55)78),低い認知的予備力(cognitive reserve)などの背景因子も報告されている6).
2.脳の構造および機能的変化
神経(機能)画像的研究も精力的に行われている.化学療法を受けていない対照群との比較研究では,対照群に比べ,①灰白質と白質の体積減少,②白質線維の整合性や拡散能の低下,③脳の活性化の変化などが示されている.灰白質の体積減少は,前頭前野,頭頂葉,後頭葉(楔前部など),側頭葉(視床,海馬,海馬傍回領域など)で認められるが,特に前頭前野で顕著にみられると報告されている1)22)24)35)83).これらは,治療後12ヵ月~20年にわたる調査であることから,がんやその治療の影響が長期にわたること,不可逆的な変化を一部の患者に引き起こすことが画像的にも示唆されている.最近の研究からは,脳の特定の部位による障害ではなく,広範囲にわたるネットワーク機構の破綻による可能性が示唆されている17)26)33)43).
3.免疫機能の変化
がん患者は,健常人に比べて血液循環中のサイトカインが増加している48).また,炎症は化学療法および認知機能障害ともに関連しており37),“sickness behavior”(倦怠感,睡眠障害,食欲不振,精神医学的行動など)の原因としても重要な役割を果たしている.向炎症性サイトカインであるinterleukin(IL)-1β,IL-6のレベルが化学療法前と比べて上昇しているという報告や,anthracyclineをベースとした抗がん剤治療を受けている乳がん患者は,内皮細胞や血小板の活性化に関する生物学的マーカーの変化が認められるといった報告がある62).また,この患者群では,他のレジメンによる抗がん剤治療を受けた群に比べてmonocyte chemoattractant protein one(MCP-1),IL-6,IL-8が上昇しており,MCP-1と認知機能との関係性が重要であることが示されている37).さらに,最近の大規模な前向きコホート研究では,血液循環中の可溶型tumor necrosis factor(TNF)受容体2の増加が,化学療法後に認められる高度の認知機能障害と関連し,さらには可溶型TNF受容体2レベルの低下は認知機能の改善(1年後)と関係していることが示されている.これらのことは,炎症がCRCIを進行させ,炎症を減少させることが認知機能の改善をもたらすことを示している29).乳がん患者における脳の局所の体積とIL-6,TNFαとの関係について健常人と比較した研究では,高IL-6,TNFα値と海馬体積の減少に相関が認められており,これらのサイトカインがCRCIと関係する可能性を示唆している44).
4.遺伝的要因
Apolipoprotein E(ApoE)とcatechol-O-methyltransferase(COMT)との関係性を調べた報告がある3)81).ApoE4は加齢による認知機能障害やアルツハイマー型認知症,脳血管障害や頭部外傷における認知機能の低下などに関連する遺伝子であるが,がんサバイバーにおいてもE4アレルを1つでももっている場合,非キャリア群と比較して,視空間認知の有意な低下と遂行機能が低い傾向が認められている3).
COMT Val158Metのsingle nucleotide polymorphism(SNP)は,前頭前野のドパミンレベルと関係することが知られているが,COMT Valキャリアにおけるドパミン代謝は,COMT Metキャリアにおける代謝より速いために,ドパミンの利用率が低下し,認知機能に影響を及ぼすと考えられている.化学療法中のがん患者と健常人を調べた研究では,COMT Valキャリアは,注意機能,言語流暢性,運動速度などにおいてCOMT Metキャリアより劣っていたと報告されている.
5.その他に想定されている病態仮説
海馬における神経新生の破綻65),酸化ストレスの上昇9)などに関する研究が行われている.また最近筆者らも,化学療法における小胞体ストレスの観点から神経障害メカニズムについて報告している84).
これまで報告されている生物学的なリスクファクターについて表1に示す58).
III.Cancer related cognitive impairmentがquality of lifeおよびactivity of daily livingに与える影響
筆者が経験した症例を提示する.
症例A(40歳代,女性,乳癌)
手術後,補助化学療法1次治療として,cyclophosphamide,epirubicin,fluorouracil(CEF)療法を3コース受け,さらにdocetaxelによる2次療法を3コース受けた.その後,tamoxifenによる補助ホルモン療法を受けている.
内服開始2ヵ月後の筆者のサイコオンコロジー外来にて「最近,考えがまとまらず計画をうまく組み立てられなくなったと感じる.これまでスムーズだった買い物や料理にも時間がかかるようになった.鍵の締め忘れやガスをつけっぱなしで外出することが数回続き,外出がとても不安になった.また,新たに始めたアルバイトでの簡単な作業がなかなか覚えられず,管理者に注意を受けることが多い」と話し,社会復帰に対しても不安を感じていた.
このように,がん治療中に日常生活における支障が認められ,その背景としてCRCIの影響が考えられるケースは決して少なくない.これまでの長期にわたる多数の大規模研究でも,化学療法を受ける患者の12~82%がCRCIを示し,遂行機能,記憶,精神活動スピード,注意機能などの認知機能領域の低下が認められることが報告されている(文献5)ほか多数)(表2).
筆者らも,乳がん患者会の協力を得て,CRCIの日常生活における支障についての調査を行っている(「乳がん治療経過中にみられるさまざまな変化と日常の支障についての調査」UMIN試験ID:UMIN000013238).「抗がん剤(ホルモン療法を含む)治療中(または治療後)に自分が感じたり,人に指摘された日常生活上の支障について」を尋ねたところ,98名のうち自分で感じたことでは,「仕事や家事の作業のスピードが遅くなった」(56.1%),「物事に集中できなくなった」(45.9%),「物忘れが増えた」(43.9%)などの回答が多くみられた.そしてこれらを感じた時期は,治療後平均15.2週(SD=23.0)であった.一方,人に指摘された経験については,「特にあてはまるものはない」(63.3%),がもっとも多く,次いで「物忘れが増えた」(19.4%),「仕事や家事の作業のスピードが遅くなった」(14.3%)の順で回答が得られた.この結果からは,自覚的な支障の頻度と人から指摘される支障の頻度に大きな差が認められている.これまでの報告においても,自覚的な認知機能変化を評価するセルフレポートによる結果は,客観的に評価した場合の結果と相関性は決して高くはないことが報告されている49)90).神経心理学的評価はあくまで検査時の断片的な結果であるため,日常生活での体験に基づく患者の自覚的評価は大切に考える必要がある.また,CRCIの症状は変動しやすく,神経心理学的評価を行うタイミングで必ずしもとらえられるとは限らないことも念頭に入れておく必要がある.CRCIによる日常生活への影響は,特に遂行機能による生産性の低下,社会的役割や機能の低下,コミュニティーへの参加の減少などと関係すると報告されている71).さらに運転や読書にも困難をきたしQOLも損なわれること67)や社会復帰にも影響を及ぼし,復職率の低下や機能の制限などにも影響を与えることが報告されている15)95).
このように,重度な場合を除き,CRCIががん診療の場面で顕在化したり,それがとらえられる可能性はほとんどない.また,がん治療医からCRCIについて,積極的に患者に尋ねられる機会も少ないと思われる.一方患者は,症例に示したような日常生活の支障は,がん治療とはあまり関係ないと思っていることが多く,治療医に対して自ら相談する機会は少ない.したがって,日常生活上の支障の有無については,治療医から丁寧に尋ねていくことが大切である.特に精神科医は,不安,抑うつのみならず,日常生活における認知機能障害の影響にも注意を向けて診察にあたる必要がある.
IV.Cancer related cognitive impairmentに対する対処法
1.コーピングストラテジー
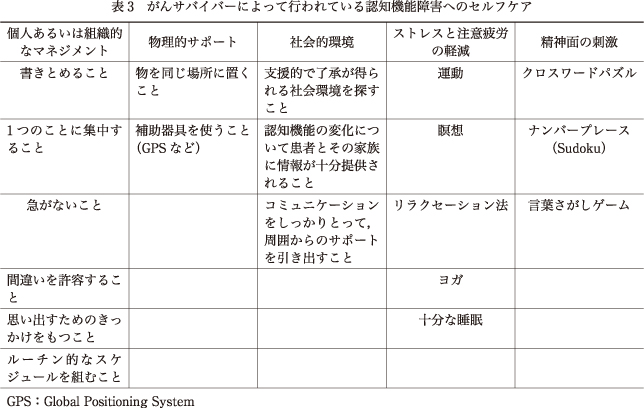
がんサバイバーからの聞き取り調査などから,CRCIに対する対処行動のエビデンスが得られつつある66)67)93).例えば,①必要なことを忘れないように書き出す,②作業に際しては,一度に1つのことのみ行う,③作業を行う際は急がない(焦らない),④自分の失敗を許容するなどの工夫が挙げられている67).特に,“必要なことは書き出す”ことは最も大切な方法として報告されている28).他には,“リマインダーとして何かの手がかり(cue)を残す”“自分の行うべき作業をルーチン化する”“物の置き場所を一定にする”なども有効であると報告されている14)28).さらに,サバイバー自身の社会的環境が認知機能のマネジメントには大切であり,他者からの支援と検証(確認)が重要であること66)67)93),また,治療により自分たちにどのような認知機能の変化や症状が起こりうるかを,家族,友人,職場の雇用者に知っておいてもらうことなどが希望として挙げられている28)66)67)93).これらの報告は,周囲の人が支援をしない姿勢(避ける,否認,批判,無関心など)52)をとったり,サバイバーの社会的制約につながるような行動をとることを減らすことが大切であることを示唆している.また,サバイバーはセルフケアとして,“ストレスを解決しようとすること”“注意疲労(attentional fatigue)を減らすこと”“リラクセーション”“定期的な運動をすること”28)に取り組んでいたり,クロスワードパズルや言葉探しゲーム,ナンバープレース(Sudoku)などに取り組んで気持ちを高める工夫を行っていることも報告されている14)28)66)67)(表394)).
2.Cancer related cognitive impairmentのマネジメント
CRCIに対する明確なマネジメント法は確立していないが,いくつかの介入法(薬物療法,非薬物療法)についての検証が行われている.
非薬物療法では,認知行動療法(cognitive behavioral therapy:CBT)や認知トレーニングプログラム,補完代替療法的アプローチ〔ビタミンE,Ginkgo biloba(銀杏),運動などの身体活性化〕などが候補として検討されている.記憶や注意機能を高めるための“brief CBT”の実行可能性の検証も行われており,小規模でのpreliminaryな結果ではあるが,安全性,実行可能性が確認され,患者満足度も高く,ワーキングメモリーの改善とQOLを高めるといった結果が得られている27).認知トレーニングは,遂行機能の改善を目的とするオンラインでの自宅学習型のプログラムであるが,多面的な遂行機能の改善が主観的にも客観的にも認められている45).また,記憶および処理速度の改善を目的とする別の認知トレーニングにおいても改善効果が認められている92).さらに高齢のがん患者を対象とした運動による介入効果を調べた大規模調査では,介入群では,非介入群に比べ認知機能の低下が軽度であったとの報告がある82).また,ハーバルサプリメントであるGinkgo bilobaを用いたCRCIへの予防効果の検証を行った試験も行われているが,主観的,客観的共にCRCIを改善する結果は残念ながら得られていない12).
一方,薬物療法としては,わが国では使用が難しいものの,精神刺激薬(dexmethylphenidate/methylphenidateやmodafinil),コリンエステラーゼ阻害薬などが検討されている.倦怠感を伴う乳がん患者におけるmodafinil中断群とmodafinil継続群のrandomized controlled trial(RCT)での比較検討によると,継続群において症状の改善が認められたと報告されている46).またパイロット的なプラセボコントロール試験においても,精神運動活動スピード,注意機能の改善が認められている57).methylphenidateの認知機能への効果について,非中枢性がん患者を対象としたプラセボコントロール試験も行われているが,これまでのところ,有望な結果は得られていない56)59).コリンエステラーゼ阻害薬では,donepezilを用いた検討が行われているが結果は分かれている.donepezil 5 mgおよび10 mgを18週にわたって投与した脳腫瘍の患者における試験では,注意機能とともに言語性および構成認知の有意な改善が認められている77).一方,肺がん患者を対象とし,ビタミンEとの併用によるdonepezilの効果を評価した試験では,有効性の検証はできなかった40).
V.認知機能障害とエンド・オブ・ライフケアをめぐる問題
症例B(70歳代,女性,胆管癌)
入院にて化学療法を受けていたが,原因不明の心筋障害から急性心不全,肺水腫が出現し,それに伴い呼吸不全状態となった.一時,人工呼吸器管理となったが回復.その後,再度肺水腫と肺炎を合併し,再び呼吸不全状態となった.疼痛および呼吸苦の緩和目的にて緩和ケアチームに依頼があった.
子どもはおらず夫と二人暮らし.患者は5年前にラクナ梗塞を発症し,その後,認知機能が低下していた.入院中も10分前に話したことを忘れてしまったり,部屋を間違えることもしばしばみられていた.夫によると認知症を患う前から,「もし治癒が望めない病気・状態になったら,そのときは延命などを望まず苦痛をとって静かに最期を迎えたい」とお互いに話し合っていたという.
このように認知機能障害は,終末期において患者が希望するケアを表明する機会を奪うことがある.認知機能障害が不可逆性に生じた場合,あるいは認知症が進んで意思決定が困難となった場合には,本人が人生の最後にどのように過ごしたかったかをはかり知ることは難しい.したがって,本症例のように事前に自分の最後の時(end of life:EOL)について家族や医療者と話し合っておくことは有用である.
アドバンス・ケア・プランニング(ACP)とは,将来の状態変化に備えて,医療者が,患者・家族とケア全体の目標や具体的な治療・療養の方法を話し合うプロセスのことであり,心配事や価値観,目標,現在の病状や今後の見通し,治療や療養場所に関する選択肢,アドバンスディレクティブ(advance directives:AD)などについて話し合い,全体的なケアの計画を立てる共同作業のことである.ADとは,事前の意思表示,リビング・ウィルのことであり,患者の意思決定能力がなくなったときの選択を口頭か書面で示しておく方法である.
この中には,
・今後の医療行為について(延命治療,蘇生処置の有無など)
・療養生活の快適さ(痛みがなく過ごしたいなど)
・周囲の人々からの配慮(最後は家族に囲まれて迎えたい,自宅で最期を迎えたいなど)
・死後の家族への希望(献体をしたい,臓器提供をしたい,遺言,残しておきたいものや処分してほしいものなど)
・伝えておきたい言葉(感謝,許容,惜別に関する音葉など)
などが含まれている.
これらによって,患者が現在治療を受けながら,将来もし自分に意思決定能力がなくなっても,自分が語ったことや,書き残したものから自分の意思が尊重され,医療スタッフや家族が,自分にとって最善の医療を選択してくれるだろうと患者が思えるようなケアを提供することが可能となる.患者の中には,実際に自分のEOLの過ごし方や自分が受けたいケアについて話したいと思っている人もいる.しかしながら,そのような機会はあまり得られていない現状がある.その背景には,患者と医療者間のEOLコミュニケーションの異なったバリアが存在するといわれている.例えば,医療者は多忙で時間もなく,そのような話題を扱うトレーニングを受けておらず,患者からの感情表出を受け止めることにも不慣れであったり,患者の希望が損なわれるかもしれないといった心配や不安がある.また患者は,ACPが行われる必要性を認識しておらず,医師がいつか必要になったときにはそれを行ってくれるだろうと思っていることがほとんどであるといわれる.しかし,ACPが行われないことによって,終末期の支援,特に急変などでは緊急的対応がしばしば行われ,患者が求める終末期ケアと一致しないことが多く,そのことは家族の苦痛の増大とも関係することが知られている79).ACPによる介入を行うことでADが促進され,ACPについて話し合う機会も増え,患者が望むケアと実際に提供されるケアが近づくようになり,コミュニケーションの質の向上,患者とその家族,介護者の負担も軽減するといった報告がある34).
終末期の話はしたくないといった患者や家族も存在するが,患者の意思決定が困難になった際にどのようなケアを望むかといったことを話題にすることは,上記の視点から大切である.医療者が,ACPについての理解を深め,状況に応じて患者や家族と話し合える準備をしておくことは,今後さらに重要になってくると思われる.
おわりに
以上,がん患者にみられる様々な認知機能障害について,主に化学療法に関連したものを中心に,病態,想定されるメカニズム,介入法などについて症例も交え概説した.また,がん医療における意思決定,特に終末期における意思決定について,ACPの話題についてもふれた.超高齢化社会を迎え,認知機能障害を呈するがん患者は増えているが,その中には,今回概説したがん治療に関連した認知機能障害も存在する.そして,それらの患者に対する意思決定支援も含めた相談が,今後ますます精神科医になされていくことが予想される.我々は,他科の医師や医療スタッフと丁寧に連携をとりながら,患者およびその家族の終末期をも含めた意思決定支援にも取り組んでいく必要がある.
編 注:編集委員会からの依頼による総説論文である.
なお,本論文に関連して開示すべき利益相反はない.
1) Abraham, J., Haut, M. W., Moran, M. T., et al.: Adjuvant chemotherapy for breast cancer: effects on cerebral white matter seen in diffusion tensor imaging. Clin Breast Cancer, 8; 88-91, 2008![]()
2) Ahles, T. A., Saykin, A. J., Furstenberg, C. T., et al.: Neuropsychologic impact of standard-dose systemic chemotherapy in long-term survivors of breast cancer and lymphoma. J Clin Oncol, 20; 485-493, 2002![]()
3) Ahles, T. A., Saykin, A. J., Noll, W. W., et al.: The relationship of APOE genotype to neuropsychological performance in long-term cancer survivors treated with standard dose chemotherapy. Psychooncology, 12; 612-619, 2003![]()
4) Ahles, T. A., Saykin, A. J.: Candidate mechanisms for chemotherapy-induced cognitive changes. Nat Rev Cancer, 7; 192-201, 2007![]()
5) Ahles, T. A., Saykin, A. J., McDonald, B. C., et al.: Cognitive function in breast cancer patients prior to adjuvant treatment. Breast Cancer Res Treat, 110; 143-152, 2008![]()
6) Ahles, T. A., Saykin, A. J., McDonald, B. C., et al.: Longitudinal assessment of cognitive changes associated with adjuvant treatment for breast cancer: impact of age and cognitive reserve. J Clin Oncol, 28; 4434-4440, 2010![]()
7) Ahles, T. A., Root, J. C., Ryan, E. L.: Cancer- and cancer treatment-associated cognitive change: an update on the state of the science. J Clin Oncol, 30; 3675-3686, 2012![]()
8) Ahles, T. A.: Brain vulnerability to chemotherapy toxicities. Psychooncology, 21; 1141-1148, 2012![]()
9) Aluise, C. D., Miriyala, S., Noel, T., et al.: 2-Mercaptoethane sulfonate prevents doxorubicin-induced plasma protein oxidation and TNF-alpha release: implications for the reactive oxygen species-mediated mechanisms of chemobrain. Free Radic Biol Med, 50; 1630-1638, 2011![]()
10) Anderson-Hanley, C., Sherman, M. L., Riggs, R., et al.: Neuropsychological effects of treatments for adults with cancer: a meta-analysis and review of the literature. J Int Neuropsychol Soc, 9; 967-982, 2003![]()
11) Bain, J.: Testosterone and the aging male: to treat or not to treat? Maturitas, 66; 16-22, 2010![]()
12) Barton, D. L., Burger, K., Novotny, P. J., et al.: The use of Ginkgo biloba for the prevention of chemotherapy-related cognitive dysfunction in women receiving adjuvant treatment for breast cancer, N00C9. Support Care Cancer, 21; 1185-1192, 2013![]()
13) Bender, C. M., Paraska, K. K., Sereika, S. M., et al.: Cognitive function and reproductive hormones in adjuvant therapy for breast cancer: a critical review. J Pain Symptom Manage, 21; 407-424, 2001![]()
14) Boykoff, N., Moieni, M., Subramanian, S. K.: Confronting chemobrain: an in-depth look at survivors' reports of impact on work, social networks, and health care response. J Cancer Surviv, 3; 223-232, 2009![]()
15) Bradley, C. J., Neumark, D., Bednarek, H. L., et al.: Short-term effects of breast cancer on labor market attachment: results from a longitudinal study. J Health Econ, 24; 137-160, 2005![]()
16) Brezden, C. B., Phillips, K. A., Abdolell, M., et al.: Cognitive function in breast cancer patients receiving adjuvant chemotherapy. J Clin Oncol, 18; 2695-2701, 2000![]()
17) Bruno, J., Hosseini, S. M., Kesler, S.: Altered resting state functional brain network topology in chemotherapy-treated breast cancer survivors. Neurobiol Dis, 48; 329-338, 2012![]()
18) Castellon, S. A., Ganz, P. A., Bower, J. E., et al.: Neurocognitive performance in breast cancer survivors exposed to adjuvant chemotherapy and tamoxifen. J Clin Exp Neuropsychol, 26; 955-969, 2004![]()
19) Cherrier, M. M., Matsumoto, A. M., Amory, J. K., et al.: The role of aromatization in testosterone supplementation: effects on cognition in older men. Neurology, 64; 290-296, 2005![]()
20) Cibelli, M., Fidalgo, A. R., Terrando, N., et al.: Role of interleukin-1beta in postoperative cognitive dysfunction. Ann Neurol, 68; 360-368, 2010![]()
21) Crossen, J. R., Garwood, D., Glatstein, E., et al.: Neurobehavioral sequelae of cranial irradiation in adults: a review of radiation-induced encephalopathy. J Clin Oncol, 12; 627-642, 1994![]()
22) Deprez, S., Amant, F., Yigit, R., et al.: Chemotherapy-induced structural changes in cerebral white matter and its correlation with impaired cognitive functioning in breast cancer patients. Hum Brain Mapp, 32; 480-493, 2011![]()
23) De Raedt, R., Koster, E. H.: Understanding vulnerability for depression from a cognitive neuroscience perspective: A reappraisal of attentional factors and a new conceptual framework. Cogn Affect Behav Neurosci, 10; 50-70, 2010![]()
24) de Ruiter, M. B., Reneman, L., Boogerd, W., et al.: Late effects of high-dose adjuvant chemotherapy on white and gray matter in breast cancer survivors: converging results from multimodal magnetic resonance imaging. Hum Brain Mapp, 33; 2971-2983, 2012![]()
25) Dropcho, E. J.: Central nervous system injury by therapeutic irradiation. Neurol Clin, 9; 969-988, 1991![]()
26) Dumas, J. A., Makarewicz, J., Schaubhut, G. J., et al.: Chemotherapy altered brain functional connectivity in women with breast cancer: a pilot study. Brain Imaging Behav, 7; 524-532, 2013![]()
27) Ferguson, R. J., McDonald, B. C., Rocque, M. A., et al.: Development of CBT for chemotherapy-related cognitive change: results of a waitlist control trial. Psychooncology, 21; 176-186, 2012![]()
28) Fitch, M. I., Armstrong, J., Tsang, S.: Patients' experiences with cognitive changes after chemotherapy. Can Oncol Nurs J, 18; 180-192, 2008![]()
29) Ganz, P. A., Bower, J. E., Kwan, L., et al.: Does tumor necrosis factor-alpha (TNF-alpha) play a role in post-chemotherapy cerebral dysfunction? Brain Behav Immun, 30(Suppl); S99-108, 2013![]()
30) Giovagnoli, A. R., Boiardi, A.: Cognitive impairment and quality of life in long-term survivors of malignant brain tumors. Ital J Neurol Sci, 15; 481-488, 1994![]()
31) Gleason, J. F., Jr., Case, D., Rapp, S. R., et al.: Symptom clusters in patients with newly-diagnosed brain tumors. J Support Oncol, 5; 427-433, 436, 2007![]()
32) Hochberg, F. H., Slotnick, B.: Neuropsychologic impairment in astrocytoma survivors. Neurology, 30; 172-177, 1980![]()
33) Hosseini, S. M., Koovakkattu, D., Kesler, S. R.: Altered small-world properties of gray matter networks in breast cancer. BMC Neurol, 12; 28, 2012![]()
34) Houben, C. H., Spruit, M. A., Groenen, M. T., et al.: Efficacy of advance care planning: a systematic review and meta-analysis. J Am Med Dir Assoc, 15; 477-489, 2014![]()
35) Inagaki, M., Yoshikawa, E., Matsuoka, Y., et al.: Smaller regional volumes of brain gray and white matter demonstrated in breast cancer survivors exposed to adjuvant chemotherapy. Cancer, 109; 146-156, 2007![]()
36) Janelsins, M. C., Kohli, S., Mohile, S. G., et al.: An update on cancer- and chemotherapy-related cognitive dysfunction: current status. Semin Oncol, 38; 431-438, 2011![]()
37) Janelsins, M. C., Mustian, K. M., Palesh, O. G., et al.: Differential expression of cytokines in breast cancer patients receiving different chemotherapies: implications for cognitive impairment research. Support Care Cancer, 20; 831-839, 2012![]()
38) Janelsins, M. C., Kesler, S. R., Ahles, T. A., et al.: Prevalence, mechanisms, and management of cancer-related cognitive impairment. Int Rev Psychiatry, 26; 102-113, 2014![]()
39) Jansen, C. E., Cooper, B. A., Dodd, M. J., et al.: A prospective longitudinal study of chemotherapy-induced cognitive changes in breast cancer patients. Support Care Cancer, 19; 1647-1656, 2011![]()
40) Jatoi, A., Kahanic, S. P., Frytak, S., et al.: Donepezil and vitamin E for preventing cognitive dysfunction in small cell lung cancer patients: preliminary results and suggestions for future study designs. Support Care Cancer, 13; 66-69, 2005![]()
41) Johannesen, T. B., Lien, H. H., Hole, K. H., et al.: Radiological and clinical assessment of long-term brain tumour survivors after radiotherapy. Radiother Oncol, 69; 169-176, 2003![]()
42) Juster, R. P., McEwen, B. S., Lupien, S. J.: Allostatic load biomarkers of chronic stress and impact on health and cognition. Neurosci Biobehav Rev, 35; 2-16, 2010![]()
43) Kesler, S. R., Wefel, J. S., Hosseini, S. M., et al.: C. L. Watson, F. Hoeft, Default mode network connectivity distinguishes chemotherapy-treated breast cancer survivors from controls. Proc Natl Acad Sci U S A, 110; 11600-11605, 2013![]()
44) Kesler, S., Janelsins, M., Koovakkattu, D., et al.: Reduced hippocampal volume and verbal memory performance associated with interleukin-6 and tumor necrosis factor-alpha levels in chemotherapy-treated breast cancer survivors. Brain Behav Immun, 30(Suppl); S109-116, 2013![]()
45) Kesler, S., Hadi Hosseini, S. M., Heckler, C., et al.: Cognitive training for improving executive function in chemotherapy-treated breast cancer survivors. Clin Breast Cancer, 13; 299-306, 2013![]()
46) Kohli, S., Fisher, S. G., Tra, Y., et al.: The effect of modafinil on cognitive function in breast cancer survivors. Cancer, 115; 2605-2616, 2009![]()
47) Koppelmans, V., Breteler, M. M., Boogerd, W., et al.: Neuropsychological performance in survivors of breast cancer more than 20 years after adjuvant chemotherapy. J Clin Oncol, 30; 1080-1086, 2012![]()
48) Korkaya, H., Liu, S., Wicha, M. S.: Breast cancer stem cells, cytokine networks, and the tumor microenvironment. J Clin Invest, 121; 3804-3809, 2011![]()
49) Lai, J. S., Butt, Z., Wagner, L., et al.: Evaluating the dimensionality of perceived cognitive function. J Pain Symptom Manage, 37; 982-995, 2009![]()
50) Laukkanen, E., Klonoff, H., Allan, B., et al.: The role of prophylactic brain irradiation in limited stage small cell lung cancer: clinical, neuropsychologic, and CT sequelae. Int J Radiat Oncol Biol Phys, 14; 1109-1117, 1988![]()
51) LeGrand, S. B.: Delirium in palliative medicine: a review. J Pain Symptom Manage, 44; 583-594, 2012![]()
52) Lepore, S. J., Silver, R. C., Wortman, C. B., et al.: Social constraints, intrusive thoughts, and depressive symptoms among bereaved mothers. J Pers Soc Psychol, 70; 271-282, 1996![]()
53) Liu, F., Day, M., Muniz, L. C., et al.: Activation of estrogen receptor-beta regulates hippocampal synaptic plasticity and improves memory. Nat Neurosci, 11; 334-343, 2008![]()
54) Loef, M., Walach, H.: Fruit, vegetables and prevention of cognitive decline or dementia: a systematic review of cohort studies. J Nutr Health Aging, 16; 626-630, 2012![]()
55) Loef, M., Walach, H.: Midlife obesity and dementia: meta-analysis and adjusted forecast of dementia prevalence in the United States and China. Obesity (Silver Spring), 21; E51-55, 2013![]()
56) Lower, E. E., Fleishman, S., Cooper, A., et al.: Efficacy of dexmethylphenidate for the treatment of fatigue after cancer chemotherapy: a randomized clinical trial. J Pain Symptom Manage, 38; 650-662, 2009![]()
57) Lundorff, L. E., Jonsson, B. H., Sjogren, P.: Modafinil for attentional and psychomotor dysfunction in advanced cancer: a double-blind, randomised, cross-over trial. Palliat Med, 23; 731-738, 2009![]()
58) Mandelblatt, J. S., Jacobsen, P. B., Ahles, T.: Cognitive Effects of Cancer Systemic Therapy: Implications for the Care of Older Patients and Survivors. J Clin Oncol, 32; 2617-2626, 2014![]()
59) Mar Fan, H. G., Clemons, M., Xu, W., et al.: A randomised, placebo-controlled, double-blind trial of the effects of d-methylphenidate on fatigue and cognitive dysfunction in women undergoing adjuvant chemotherapy for breast cancer. Support Care Cancer, 16; 577-583, 2008![]()
60) Merriman, J. D., Von Ah, D., Miaskowski, C., et al.: Proposed mechanisms for cancer- and treatment-related cognitive changes. Semin Oncol Nurs, 29; 260-269, 2013![]()
61) Meyers, C. A., Brown, P. D.: Role and relevance of neurocognitive assessment in clinical trials of patients with CNS tumors. J Clin Oncol, 24; 1305-1309, 2006![]()
62) Mills, P. J., Ancoli-Israel, S., Parker, B., et al.: Predictors of inflammation in response to anthracycline-based chemotherapy for breast cancer. Brain Behav Immun, 22; 98-104, 2008![]()
63) Mitchell, A. J., Chan, M., Bhatti, H., et al.: Prevalence of depression, anxiety, and adjustment disorder in oncological, haematological, and palliative-care settings: a meta-analysis of 94 interview-based studies. Lancet Oncol, 12; 160-174, 2011![]()
64) Miovic, M., Block, S.: Psychiatric disorders in advanced cancer. Cancer, 110; 1665-1676, 2007![]()
65) Monje, M., Dietrich, J.: Cognitive side effects of cancer therapy demonstrate a functional role for adult neurogenesis. Behav Brain Res, 227; 376-379, 2012![]()
66) Munir, F., Kalawsky, K., Lawrence, C., et al.: Cognitive intervention for breast cancer patients undergoing adjuvant chemotherapy: a needs analysis. Cancer Nurs, 34; 385-392, 2011![]()
67) Myers, J. S.: Chemotherapy-related cognitive impairment: the breast cancer experience. Oncol Nurs Forum, 39; E31-40, 2012![]()
68) Nelson, C. J., Lee, J. S., Gamboa, M. C., et al.: Cognitive effects of hormone therapy in men with prostate cancer: a review. Cancer, 113; 1097-1106, 2008![]()
69) Nieder, C., Leicht, A., Motaref, B., et al.: Late radiation toxicity after whole brain radiotherapy: the influence of antiepileptic drugs. Am J Clin Oncol, 22; 573-579, 1999![]()
70) Palmer, J. L., Trotter, T., Joy, A. A., et al.: Cognitive effects of Tamoxifen in pre-menopausal women with breast cancer compared to healthy controls. J Cancer Surviv, 2; 275-282, 2008![]()
71) Reid-Arndt, S. A., Yee, A., Perry, M. C., et al.: Cognitive and psychological factors associated with early posttreatment functional outcomes in breast cancer survivors. J Psychosoc Oncol, 27; 415-434, 2009![]()
72) Reid-Arndt, S. A., Matsuda, S., Cox, C. R.: Tai Chi effects on neuropsychological, emotional, and physical functioning following cancer treatment: a pilot study. Complement Ther Clin Pract, 18; 26-30, 2012![]()
73) Roman, D. D., Sperduto, P. W.: Neuropsychological effects of cranial radiation: current knowledge and future directions. Int J Radiat Oncol Biol Phys, 31; 983-998, 1995![]()
74) Schagen, S. B., van Dam, F. S., Muller, M. J., et al.: Cognitive deficits after postoperative adjuvant chemotherapy for breast carcinoma. Cancer, 85; 640-650, 1999![]()
75) Schultheiss, T. E., Stephens, L. C.: Invited review: permanent radiation myelopathy. Br J Radiol, 65; 737-753, 1992![]()
76) Scott, J. N., Rewcastle, N. B., Brasher, P. M., et al.: Which glioblastoma multiforme patient will become a long-term survivor? A population-based study. Ann Neurol, 46; 183-188, 1999![]()
77) Shaw, E. G., Rosdhal, R., D'Agostino, R. B. Jr, et al.: Phase II study of donepezil in irradiated brain tumor patients: effect on cognitive function, mood, and quality of life. J Clin Oncol, 24; 1415-1420, 2006![]()
78) Sherwin, B. B.: Estrogen and cognitive functioning in women: lessons we have learned. Behav Neurosci, 126; 123-127, 2012![]()
79) Simpson, C.: Advance care planning in COPD: care versus "code status". Chron Respir Dis, 9; 193-204, 2012![]()
80) Singer, S., Das-Munshi, J., Brahler, E.: Prevalence of mental health conditions in cancer patients in acute care-a meta-analysis. Ann Oncol, 21; 925-930, 2010![]()
81) Small, B. J., Rawson, K. S., Walsh, E., et al.: Catechol-O-methyltransferase genotype modulates cancer treatment-related cognitive deficits in breast cancer survivors. Cancer, 117; 1369-1376, 2011![]()
82) Sprod, L. K., Mohile, S. G., Demark-Wahnefried, W., et al.: Exercise and cancer treatment symptoms in 408 newly diagnosed older cancer patients. J Geriatr Oncol, 3; 90-97, 2012![]()
83) Swayampakula, A. K., Alkhouri, N., Haut, M. W., et al.: Cognitive impairment with significant brain parenchymal volume loss following standard adjuvant chemotherapy in a patient with breast cancer. Clin Adv Hematol Oncol, 5; 985-987: discussion 987-988, 2007![]()
84) Tanimukai, H., Kanayama, D., Omi, T., et al.: Paclitaxel induces neurotoxicity through endoplasmic reticulum stress. Biochem Biophys Res Commun, 437; 151-155, 2013![]()
85) Tannock, I. F., Ahles, T. A., Ganz, P. A., et al.: Cognitive impairment associated with chemotherapy for cancer: report of a workshop. J Clin Oncol, 22; 2233-2239, 2004![]()
86) Tchen, N., Juffs, H. G., Downie, F. P., et al.: Cognitive function, fatigue, and menopausal symptoms in women receiving adjuvant chemotherapy for breast cancer. J Clin Oncol, 21; 4175-4183, 2003![]()
87) Tofilon, P. J., Fike, J. R.: The radioresponse of the central nervous system: a dynamic process. Radiat Res, 153; 357-370, 2000![]()
88) Twijnstra, A., Boon, P. J., Lormans, A. C., et al.: Neurotoxicity of prophylactic cranial irradiation in patients with small cell carcinoma of the lung. Eur J Cancer Clin Oncol, 23; 983-986, 1987![]()
89) van Dam, F. S., Schagen, S. B., Muller, M. J., et al.: Impairment of cognitive function in women receiving adjuvant treatment for high-risk breast cancer: high-dose versus standard-dose chemotherapy. J Natl Cancer Inst, 90; 210-218, 1998![]()
90) Vardy, J., Wong, K., Yi, Q. L., et al.: Assessing cognitive function in cancer patients. Support Care Cancer, 14; 1111-1118, 2006![]()
91) Vigliani, M. C., Duyckaerts, C., Hauw, J. J., et al.: Dementia following treatment of brain tumors with radiotherapy administered alone or in combination with nitrosourea-based chemotherapy: a clinical and pathological study. J Neurooncol, 41; 137-149, 1999![]()
92) Von Ah, D., Carpenter, J. S., Saykin, A., et al.: Advanced cognitive training for breast cancer survivors: a randomized controlled trial. Breast Cancer Res Treat, 135; 799-809, 2012![]()
93) Von Ah, D., Habermann, B., Carpenter, J. S., et al.: Impact of perceived cognitive impairment in breast cancer survivors. Eur J Oncol Nurs, 17; 236-241, 2013![]()
94) Von Ah, D., Storey, S., Jansen, C. E., et al.: Coping strategies and interventions for cognitive changes in patients with cancer. Semin Oncol Nurs, 29; 288-299, 2013![]()
95) Wefel, J. S., Lenzi, R., Theriault, R. L., et al.: The cognitive sequelae of standard-dose adjuvant chemotherapy in women with breast carcinoma: results of a prospective, randomized, longitudinal trial. Cancer, 100; 2292-2299, 2004![]()
96) Wefel, J. S., Saleeba, A. K., Buzdar, A. U., et al.: Acute and late onset cognitive dysfunction associated with chemotherapy in women with breast cancer. Cancer, 116; 3348-3356, 2010![]()