新たな倫理指針が2021年6月30日に施行となった.主な改正点は,(i)「一括した審査」の原則化(一研究一審査),(ii)「研究協力機関」の新設,(iii)「e-consent(電磁的同意)」の新設である.(i)では,従来は,研究機関の長の依頼に基づき中央倫理審査は可能であったが,その運用は自機関に倫理審査委員会が設置されていない場合など限定的であった.また,倫理審査委員会は研究機関の長の諮問機関であり,研究機関の長が最終責任を負うとの位置づけであった.新倫理指針では,一括審査が原則となり,臨床研究法の場合と同様に,研究代表者が取りまとめ1つの倫理審査委員会に申請し,研究機関の長の実施許可は,一括審査後に各研究機関で取得する手順となる.(ii)では,従来は,研究目的で新たに試料・情報を取得する場合は,研究者等/研究機関と位置づけられ,倫理審査申請,研究倫理教育受講,利益相反(COI)管理などの,研究機関としての体制整備が求められた.新倫理指針では,新たに試料・情報の取得・提供を行う場合であっても,研究者等/研究機関ではない「研究協力機関」としての位置づけが可能となった.(iii)では,情報通信技術(ICT)を用いて,研究参加の同意を取得する方法が認められた.マルチメディアを用いた同意説明や電子署名によって,遠隔地からの研究参加を容易にするなどの効果が期待される.本稿では,精神疾患レジストリの事例を中心に,国立精神・神経医療研究センターにおける新倫理指針への対応について紹介し,新倫理指針の円滑な運用と,非介入研究のさらなる推進策について考えてみたい.
はじめに
「人を対象とする生命科学・医学系研究に関する倫理指針」(以下,「生命科学・医学系指針」という)が2021年3月23日に告示,同年6月30日に施行となった3).主な改正点は,(i)「一括した審査」の原則化(一研究一審査),(ii)「研究協力機関」の新設,(iii)「e-consent(電磁的同意)」の新設である.
(i)では,従来は,研究機関の長の依頼に基づき中央倫理審査は可能であったが,その運用は自機関に倫理審査委員会が設置されていない場合など限定的であった.また,倫理審査委員会は研究機関の長の諮問機関であり,研究機関の長が最終責任を負うとの位置づけであった.生命科学・医学系指針では,一括審査が原則となり,臨床研究法の場合と同様に,研究代表者が取りまとめて1つの倫理審査委員会に申請し,研究機関の長の実施許可は,一括審査後に各研究機関で取得する手順となる.倫理審査委員会は独立した主体として研究計画の審査に責任を負い,研究者は研究の実施に責任を負い,研究機関の長は監督責任を負うことと,3者による責任分有が明確となった.
(ii)では,従来は,研究目的で新たに試料・情報を取得する場合は,研究者等/研究機関と位置づけられ,倫理審査申請,研究倫理教育受講,利益相反(conflict of interest:COI)管理などの,研究機関としての体制整備が求められた.例外的に,既存の試料・情報の提供のみを行う場合は,研究者等/研究機関の責務を負わないスキームは認められていた.生命科学・医学系指針では,新たに試料・情報の取得・提供を行う場合であっても,研究者等/研究機関ではない「研究協力機関」としての位置づけが可能となった.
(iii)では,情報通信技術(information and communication technology:ICT)を用いて,研究参加の同意を取得する方法が認められた.マルチメディアを用いた同意説明や電子署名によって,遠隔地からの研究参加を容易にするなどの効果が期待される.
本稿では,精神疾患レジストリの事例を中心に,国立精神・神経医療研究センターにおける生命科学・医学系指針への対応について紹介し,生命科学・医学系指針の円滑な運用と,非介入研究のさらなる推進策について考えてみたい.
I.精神疾患レジストリの概要
米国医療研究・品質庁(Agency for Healthcare Research and Quality:AHRQ)は患者レジストリを,「患者レジストリとは,ある特定の疾患,状態または曝露によって定義された集団の特定のアウトカムを評価するために,観察研究の手法を用いて一様なデータ(臨床情報等)を収集し,事前に決定された科学的,臨床的または政策的な目的に資する組織化されたシステムである」1)と定義している.精神科領域においては,気分障害に関する大規模コホート2),精神病症状を伴う患者(統合失調症,統合失調感情障害,双極性障害)を対象とした大規模サンプル7),自閉スペクトラム症および神経発達障害の発症に関与する特定の変異(16p11.2,1q21.1の欠失・重複など)をもつ被験者を縦断的に追跡する試みもある6)が,いずれも海外のものである.わが国では,2018年度に,日本医療研究開発機構障害者対策総合研究開発事業(精神障害)において「精神疾患レジストリの構築・統合により新たな診断・治療法を開発するための研究(課題番号:18dk0307081h0002)」(研究開発代表者:中込和幸)が採択され,国立精神・神経医療研究センターと日本精神神経学会が中心となって,オールジャパン体制でその運営・管理が行われている.
1.精神疾患レジストリの全体構想
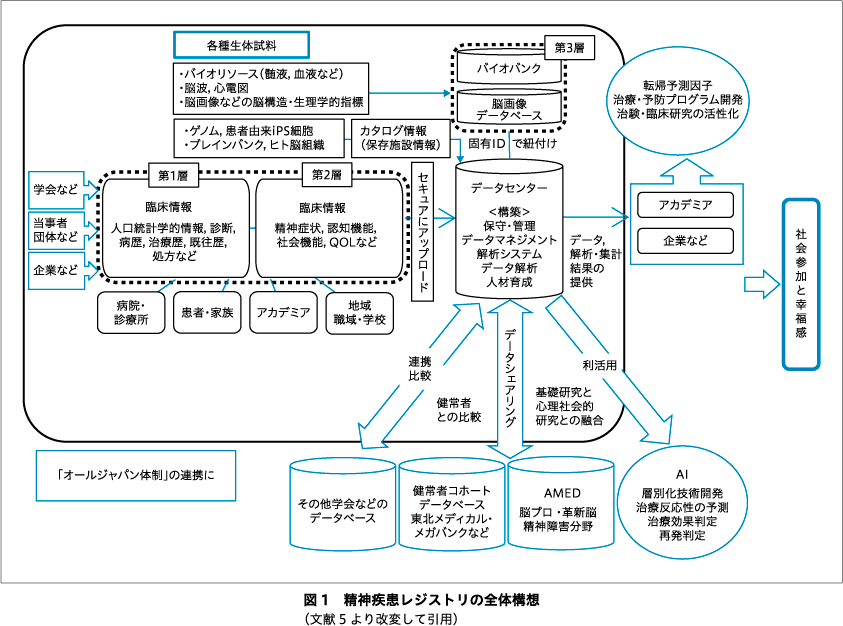
精神疾患レジストリの全体構想を図1に示す.本研究では,対象者の基本情報〔人口統計学的情報,診断,アレルギー,家族歴,既往歴,自殺企図歴,喫煙歴,問題飲酒歴,物質乱用歴,学歴,職業,就学・就労状況,婚姻状態,家族構成,ケアギバーの有無,病歴,検査(脳画像・機能,血液生化学,心電図・レントゲン,の実施状況,異常所見の有無),処方歴(5年間),薬物療法以外の治療歴,行動制限,障害福祉サービスの受給状況〕の「第1層」の臨床情報に加え,機能ドメインを反映する感情価,認知機能,社会機能,睡眠,QOL,ウェアラブルデバイスによる生体モニタリング情報の「第2層」の臨床情報を付加する.なお,「第2層」は,QOL,感情価,睡眠の自己記入式の項目を研究対象者本人から電子的に収集,および心拍数,呼吸数,アクティブ時間,睡眠時間,睡眠スコア,心拍から算出したストレス関連値などの生体モニタリング情報をウェアラブルデバイスにより収集する「第2層a」と,精神症状,認知機能,社会機能などの医師・評価者による評価結果を各医療機関から収集する「第2層b」に分類される.さらに,研究対象者識別コード(1次ID),固有ID(2次ID),ならびに提供ID(3次ID)を用いることで生体試料・情報〔生体試料:血液(血清,血漿)20 mL,髄液10 mL,脳組織,生体情報:生体試料の解析から得られる情報,および脳神経画像(3 D-T1,3 D-T2,rsfMRI,DTI,NRC),脳波(臨床データ,携帯型脳波計による生体情報),ポリソムノグラフィー(臨床データ),心電図(臨床データ)とその解析より得られる情報〕と第1層・第2層の臨床情報との連結をはかり,縦断的な経過を追う.
集約されたビッグデータをもとに,均質な集団を抽出する解析方法を見いだし,その病因,病態の解明に基づく個別化医療や精神医療の標準化の促進に取り組む.また,日本精神神経学会,日本精神科病院協会,日本精神神経科診療所協会,当事者団体(患者会,家族会),企業と連携し,幅広い視点から,データ収集項目の選定,患者レジストリの運営,インフォームド・コンセントや,内資系の企業のみならず外資系の企業を含む二次利用・第三者提供の利活用の方法などに配慮する5).
2.精神疾患レジストリにおける試料・情報の管理
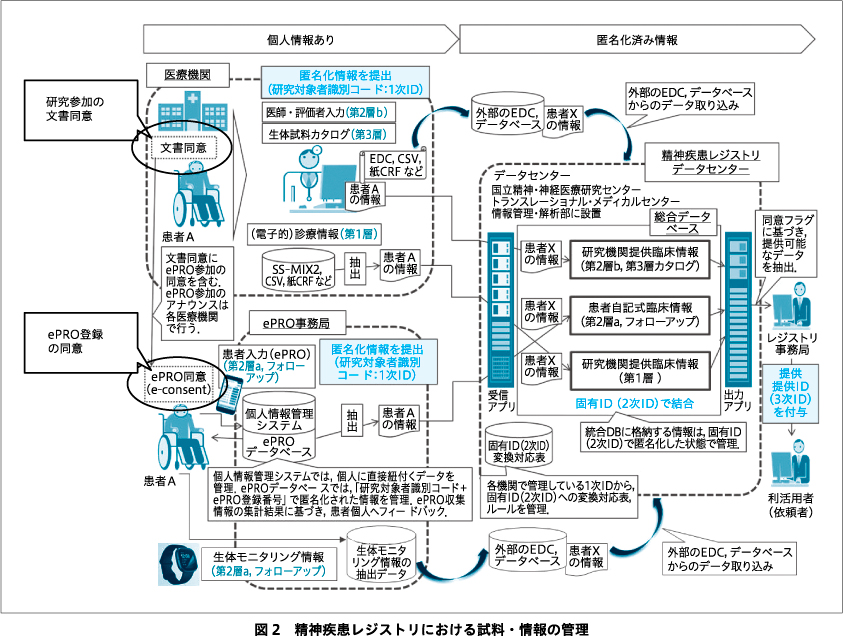
精神疾患レジストリにおける臨床情報,生体試料・情報のカタログ情報の管理を図2に示す.精神疾患レジストリにおけるデータソースや収集方法はさまざまである.第1層,第2層a・bの臨床情報,第3層の生体試料・情報のカタログ情報は,固有ID(2次ID)により統合された同一研究対象者のデータを,「統合データベース」に格納し管理する.国立精神・神経医療研究センターのアカデミック臨床研究機関(academic research organization:ARO)機能に設置されたデータセンターが,統合データベースの管理やデータクリーニング,データ利活用時のデータセット作成,ならびにそれらに関する文書・記録類の作成および保管などの業務を担当する.
第1層情報の収集は,電子カルテの退院サマリ,外来サマリから抽出(事前に入力画面をテンプレート機能により実装),または「基本情報入力システム」と称するWebシステムからの退院サマリ,外来サマリ作成ツールから抽出されたCSV形式のデータを統合データベースに取り込む.第2層aの情報収集は,電子患者報告アウトカム(electronic patient-reported outcomes:ePRO)製品により,個人情報管理システムおよびePROデータベースを介して,統合データベースに自動収集する.また,スマートウォッチなどの生体モニタリング情報は,その抽出データを入力した外部データベースから統合データベースに取り込む.第2層bの情報および第3層カタログ情報の収集は,電子媒体の症例報告書(case report form:CRF)の情報をデータセンター内でelectronic data capture(EDC)に登録し,その後に統合データベースに取り込む.レジストリデータの利活用は,臨床情報に関しては,データセンターで提供ID(3次ID)を付与し,依頼者(研究者,企業など)に提供する.生体試料・情報に関しては,研究対象者識別コード(1次ID)と提供ID(3次ID)の対応表を,データセンターから試料・情報を保有する研究機関に提供し,当該研究機関から提供ID(3次ID)を付与された試料・情報が,依頼者(研究者,企業など)に提供される.
システムのセキュリティ対策としては,それぞれのデータベースをAmazon Web Services(AWS)の国内サーバ(国内法準拠)に構築し,データをインフラレイヤーで暗号化し,AWSサーバが物理的な被害にあった場合でも第三者がデータを読み取れないようにしている.また,氏名,電話番号,メールアドレスといった直ちに特定の個人に紐づく情報は,個人情報管理システムのみに保存され,研究対象者本人と直接の連絡が必要となるePRO事務局(研究者やデータセンターと独立して設置)の担当者のみが閲覧できる.
3.精神疾患レジストリの運営・管理体制
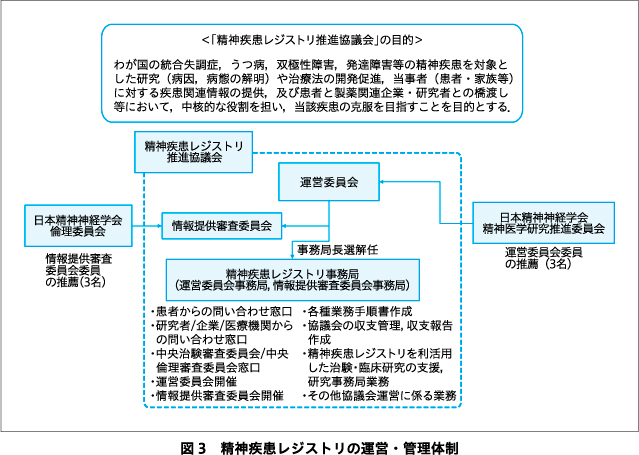
精神疾患レジストリの運営・管理体制を図3に示す.まず,「精神疾患レジストリ推進協議会」(以下,本協議会)を設立し,本協議会をレジストリ保有者として,精神疾患レジストリの構築,運営・管理を行う.ここでは,本協議会の運営・活動方針の決定などを行う運営委員会を設置し,レジストリの運営全般を担う.
会員は,精神疾患レジストリの活動に賛同する機関および個人で,運営委員会の承認を得た者(一般会員)と,本協議会の事業を賛助する意思を有する団体で,運営委員会の承認を得た者(法人会員)で構成され,精神疾患レジストリの構築にかかわる研究となる「精神疾患レジストリの構築・統合により新たな診断・治療法を開発するための研究(研究代表者:中込和幸)」の研究代表者が,本協議会の会長に就任する.現時点では,レジストリで収集されたデータを用いた利活用研究のための試料・情報提供にかかる申請は,推進協議会の会員のみが可能としている.
運営委員会委員長は本協議会の会長が就任し,日本精神神経学会精神医学研究推進委員会からの推薦者(3名),研究代表者からの推薦者(2名),日本精神科病院協会からの推薦者(1名),日本精神神経科診療所協会からの推薦者(1名),当事者・家族の委員(2名)で構成される.運営委員会の決議事項は,運営方針の決定,活動方針の決定,本協議会の収支,情報提供審査委員会の委員長および委員の選任・解任,精神疾患レジストリ事務局長の選任・解任,精神疾患レジストリ進捗管理のほか,精神疾患レジストリを利活用した治験および臨床研究の実施採択に関する事項やその進捗管理に関する事項などである.
データ提供にかかる利活用ルールは,情報提供審査委員会で作成し,運営委員会の承認を経て,審査体制を構築する.なお,依頼者(研究者,企業など)からデータ利活用の申請が提出された場合,運営委員会は情報提供審査委員会に審査を依頼し,その結果報告を受けて利活用の可否を判断する.また,依頼者は年に1回,研究の進捗状況に関する報告を運営委員会事務局に提出し,情報提供審査委員会は必要に応じて依頼者からの年次報告に対して,その審査を行う.なお,情報提供審査委員会は,国立精神・神経医療研究センター病院精神診療部長(1名),国立精神・神経医療研究センターの医学,歯学,薬学または臨床試験に関する専門的知識を有する者(1名),日本精神神経学会倫理委員会からの推薦者(3名)より構成される.
II.「一括した審査」(一研究一審査)への対応
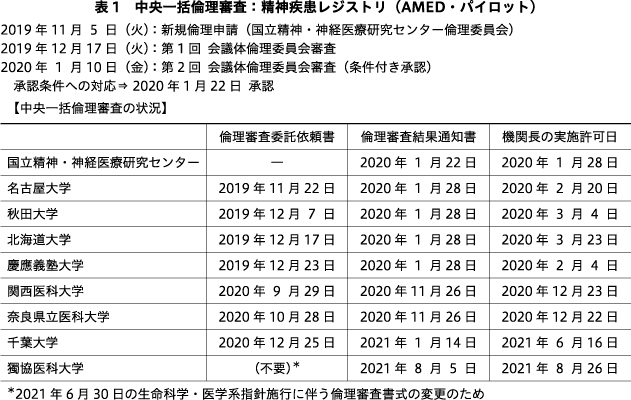
精神疾患レジストリにおける中央一括倫理審査の状況を表1に示す.国立精神・神経医療研究センター倫理委員会では,2019年度日本医療研究開発機構中央治験審査委員会・中央倫理審査委員会基盤整備事業「非介入研究におけるセントラル倫理委員会への基盤整備」に研究開発分担者として参画した経緯から,生命科学・医学系指針の施行前より,中央一括倫理審査に取り組んできた.
精神疾患レジストリの構築にかかわる研究は,国立精神・神経医療研究センター倫理委員会での中央一括倫理審査の第1号であり,2019年11月5日に新規の倫理申請を行い,2回の会議体での倫理審査と「条件付き承認」の審査結果を経て,2020年1月22日に承認条件への対応が確認され承認となった.その後,研究機関の長の実施許可を2020年1月28日に取得した.
初回の倫理審査では,名古屋大学,秋田大学,北海道大学,慶應義塾大学における倫理審査を一括して行い,その後,各研究機関より,実施許可通知書を入手している.また,生命科学・医学系指針の施行後には,それまで各研究機関の長発の文書として提出が求められていた「倫理審査委託依頼書」が廃止され,生命科学・医学系指針に明記された研究代表者からの一括での倫理審査申請の形式となった.
III.「研究協力機関」への対応
生命科学・医学系指針で新たなトラックとして明記された「研究協力機関」の概要を表2に示す.研究協力機関では,新規に試料・情報の取得・提供を行う場合であっても,研究者等/研究機関ではない位置づけが可能となり,研究者等/研究機関に求められる倫理審査申請,研究倫理教育の受講,利益相反(COI)管理などへの対応は不要となる.
QOL調査の追加や少量の追加採血など,生命科学・医学系指針 第2(2)侵襲で定義される「軽微な侵襲」に該当する場合は,研究協力機関としての位置づけにおいて提供が可能である.精神疾患レジストリにおいて,今後,研究協力機関のスキームを活用することで,多くの試料・情報の集約につながることが期待される.なお,『生命科学・医学系指針ガイダンス』には,「例えば,造影剤を用いないMRI撮像を研究目的で行う場合は,それによって研究対象者の身体に生じる傷害および負担が小さいと考えられ,長時間に及ぶ行動の制約等によって研究対象者の身体および精神に負担が生じなければ,『軽微な侵襲』と判断してよい」と明記されており,前向きにMRI撮像を行う場合には,研究対象者への身体または精神的な負担が大きい場合は「軽微な侵襲」に該当しないため,研究協力機関ではなく,研究機関と位置づける必要がある.
なお,研究協力機関の医師は有害事象報告の義務を負うことや,インフォームド・コンセントの取得はできない(同意取得の確認は行う)などの課題もある.精神疾患レジストリにおいて,研究協力機関からの試料・情報を集約する場合の運用では,生命科学・医学系指針で明記された「e-consent(電磁的同意)」を活用し,研究機関と研究協力機関を電気通信回線を通じたテレビ電話でつなぎインフォームド・コンセントを取得するなどの工夫が必要と思われる.
IV.「e-consent(電磁的同意)」への対応
生命科学・医学系指針では「e-consent(電磁的同意)」について明記されたが,非対面の場合の本人確認(身元確認,当人認証)の具体例を表3に示す.精神疾患レジストリでは,図2の試料・情報の管理の資料中にも記載しているとおり,まず,医療機関で研究全体に関するインフォームド・コンセントを文書で取得したうえで,第2層a情報の収集の際にはePROへのデータ入力に関する同意もePRO製品内で取得している.
その具体的な手順は,(i)各医療機関において,研究対象者識別コード(1次ID)とともに,研究対象者のメールアドレスを入力する,(ii)登録した研究対象者のメールアドレスに登録受付のメールが届く,(iii)研究対象者自身がそのメールに記載のURLをタップし,パスワードの入力および「□入力の使用に同意し,精神疾患レジストリにログインする」の□にチェックし,「登録を完了する」をクリック(ePRO製品使用の同意)する,(iv)登録した研究対象者のメールアドレスに登録完了のメールが届く,そのメールに記載のユーザ名(ePRO登録番号;数字6桁)を記録する,(v)研究対象者自身がそのメールに記載のURLをタップして,ユーザ名(数字6桁)と研究対象者自身が設定したパスワードを入力し,「ログイン」をクリックする,(vi)ePRO入力のトップ画面が表示される.回答を行う第2層a情報項目の編集ボタンを押し,回答を行う,となる.
デジタルデバイスを使用したe-consent(電磁的同意)については,さまざまな議論や検討がなされている段階であるが,精神疾患レジストリにおけるePRO製品使用の同意の仕組みは,非対面の場合の本人確認(当人認証)につながる可能性があると思われる.
おわりに
本稿では,精神疾患レジストリの事例を中心に,国立精神・神経医療研究センターにおける生命科学・医学系指針への対応について概説した.生命科学・医学系指針の主な改正点は,(i)「一括した審査」の原則化(一研究一審査),(ii)「研究協力機関」の新設,(iii)「e-consent(電磁的同意)」の新設,であるが,これらは,精神疾患レジストリの構築にかかわる研究のような多機関共同の非介入前向き観察研究や,集約されたデータの二次利用・第三者提供にかかわる研究の推進につながるものと考える.
より多くの国民や患者,研究関係者の理解により,幅広い診断カテゴリーにわたる大規模な患者レジストリを構築し,精神科領域における個別化医療の実現と,精神医療の標準化の促進を通じ,多くの精神疾患患者やその家族の社会参加や幸福感の実現に貢献すること,さらに,均質な集団の病態を解明することで,医薬品や医療機器,再生医療等製品などの新規医療技術の開発につなげることがわれわれの願いである.
編注:本特集は,第117回日本精神神経学会学術総会シンポジウムをもとに栗原千絵子(量子科学技術研究開発機構)を代表として企画された.
なお,本論文に関連して開示すべき利益相反はない.
1) Agency for Healthcare Research and Quality: Registries for Evaluating Patient Outcomes: A User's Guide, 3rd ed. 2014 (https://www.ncbi.nlm.nih.gov/books/NBK208616/) (参照2021-08-01)
2) Joshi, H., Fitzsimons, E.: The Millennium Cohort Study: the making of a multi-purpose resource for social science and policy. Longit Life Course Stud, 7 (4); 409-430, 2016
3) 文部科学省, 厚生労働省, 経済産業省: 人を対象とする生命科学・医学系研究に関する倫理指針. 2021 (https://www.mhlw.go.jp/content/000757566.pdf) (参照2021-08-01)
4) 文部科学省, 厚生労働省, 経済産業省: 人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス(令和3年4月16日). (https://www.mhlw.go.jp/content/000769923.pdf) (参照2021-08-01)
5) 中込和幸: レジストリ研究の倫理. 精神経誌, 121 (11); 850-857, 2019
6) Simons VIP Consortium: Simons Variation in Individuals Project (Simons VIP): a genetics-first approach to studying autism spectrum and related neurodevelopmental disorders. Neuron, 73 (6); 1063-1067, 2012![]()
7) Tamminga, C. A., Pearlson, G., Keshavan, M., et al.: Bipolar and schizophrenia network for intermediate phenotypes: outcomes across the psychosis continuum. Schizophr Bull, 40 (Suppl 2); S131-137, 2014![]()