てんかんは比較的有病率の高い神経疾患であるが,その多様な形態と併存症状の病態生理は知られていない部分も多い.近年の機械学習の進歩により,MRIなどから個人の「脳年齢」を推定することが可能になり,この脳年齢の測定は,個人レベルで応用可能な精神神経疾患の新しいバイオマーカーとして期待されている.著者らは,さまざまな類型のてんかん患者の脳年齢を推定し,①側頭葉てんかんに対する精神病症状の影響,②心因性非てんかん発作の脳年齢による臨床的識別,③若年ミオクロニーてんかんと進行性ミオクローヌスてんかんの識別を検証した.まず,1,196名の健常対照群の構造MRIスキャンを解析し,得られた脳の各部位の灰白質および白質の容積の数値から,各個人の実年齢に適合するような年齢予測計算モデルを機械学習によって構築した.この年齢予測モデルを318名のてんかん患者(または心因性発作)の脳画像データに適用し,各個人の脳画像から予測される年齢と実際の年齢の差(brain-PAD:予測年齢-実年齢)を算出した.結果,ほぼすべてのてんかん類型で脳年齢が平均で4年以上高く,海馬硬化を伴う側頭葉てんかんではそれ以上であった.また,発作間欠期精神病を伴う場合は,伴わない場合に比べてさらに5年程度の脳年齢上昇が認められた.心因性非てんかん性発作群はてんかん群と同程度の脳年齢上昇を呈し,進行性ミオクローヌスてんかんは若年ミオクロニーてんかんに比べ脳年齢が高かった.このような知見は,てんかんにおいて,健常群にみられる脳の加齢と異なった加齢プロセスが存在することを示唆し,海馬硬化や精神病症状との関連も推測された.脳MRIに基づく年齢予測システムは,通常診療で応用可能な個人レベルの画像バイオマーカーとして確立される可能性がある.さらに本稿では,てんかんにおけるその他の画像バイオマーカーの探索などについても議論する.
東京慈恵会医科大学精神医学講座
はじめに
てんかんは人口の約1%弱,世界で5,000万人が罹患する有病率の高い神経疾患であり13),発作の消失しない薬剤抵抗性てんかんの存在に加え,抑うつや精神病といった精神症状や認知機能障害などの合併症を伴いやすいことが問題になる4).このような状況のなかで,てんかんの焦点病変の検出や,種々の合併症などのリスク因子の同定,および病態生理の解明のため,脳画像がバイオマーカーとして果たす役割が期待されている24)(図1).磁気共鳴画像(magnetic resonance imaging:MRI)や陽電子放射断層撮影(positron emission tomography:PET)といった脳画像からは,てんかん焦点病変の可視化が期待できるだけでなく,さまざまな解析技術を用いて,定量的かつ低侵襲に脳の構造や機能を調べることができる.特に近年の機械学習の進歩はめざましく,臨床応用に向けた研究が多数行われている.そのなかで,MRIなどから個人の「脳年齢」を推定する技術が,個人レベルで応用可能な精神神経疾患の新しいバイオマーカーとして期待されている.著者らは,さまざまな類型のてんかん患者の脳年齢推定を行い,臨床的に応用可能な場面を想定していくつかの比較検討を行った.以下に,まず脳年齢推定に関する解説を行い,その後,各てんかん類型における脳年齢異常や精神病症状の有無による差異など今回注目した検討事項とその意義について紹介する.
I.脳画像に基づく脳年齢測定と精神神経疾患
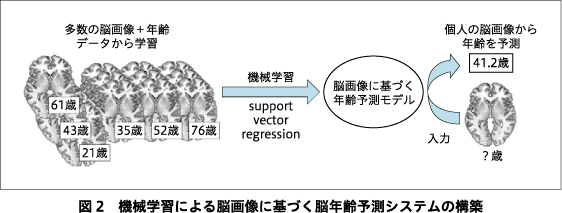
脳は加齢とともに変化し,それは脳機能の変容や時に神経変性疾患などと関連することが知られている.脳の加齢プロセスは生物学的に複雑で個人差も大きいとされており,こういった脳年齢の多様さは,個人のマインドや精神神経疾患の多様さにも寄与するかもしれない.近年の機械学習とその応用の発展はめざましく,構造MRIや機能脳画像を用いてヒトの脳年齢を予測することが可能となった6).この脳画像に基づく脳年齢予測システムでは,多くの健常者の画像データとその実年齢のパターンを学習させ,そこに新たな画像データを入力した際に,学習に基づいてその脳年齢を予測することができる(図2).このシステムにより,おおむね成人では誤差が5年以内,小児・思春期では誤差1年以内という正確性を示すことができる6).
脳の加齢と精神神経疾患の関係を探るため,こういった脳年齢予測システムの精神神経疾患への応用は近年急速に広まりつつある.例えばアルツハイマー病における脳年齢は,軽度認知機能障害から認知症への移行の有無を81%の正確性で鋭敏に予測できるとされ10),近年の著者らの検討でもアルツハイマー病で9年程度の脳年齢上昇を確認し,パーキンソン病(2年前後の上昇)を有意に上回るという結果が得られている2).統合失調症では5.5年の脳年齢上昇が報告され,精神病発症危険状態(at risk mental state:ARMS)でも2年弱の上昇を認めたことから発症前後での脳年齢の加速が推測され12),その後,縦断画像の解析により統合失調症発症直後に脳の加齢が2.5倍加速し,発症5年以降は脳年齢の上昇はあっても加速はみられなくなることが報告された16).さらに脳年齢は,一般人口においても,流動性知能やアロスタティック負荷,死亡率などと関連することが知られている7).てんかんにおいては,薬剤抵抗性の焦点性てんかん全体で4.5年の脳年齢上昇が報告されていたが14),焦点部位ごとの違いや全般てんかんでの数値,あるいは精神症状による影響などは未知であった.
II.各てんかん類型での脳年齢と意義
著者らの報告では22),まず1,196名の健常対照群の構造MRIスキャンを解析し,得られた脳の各部位の灰白質および白質の容積の数値から,各個人の実年齢に適合するような年齢予測計算モデルを,nu-support vector regression(nu-SVR)を用いた機械学習によって構築した.脳年齢予測システムに用いる機械学習アルゴリズムの選択には定まった見解はないが,nu-SVRはほかのepsilon-SVRなどに比べてサポートベクターの数を調整できるという違いがある.この年齢予測モデルを318名のてんかん(または心因性発作)の脳画像データに適用し,各個人の脳画像から予測される年齢と実際の年齢の差〔brain-predicted age difference:brain-PAD(予測年齢-実年齢)〕を算出した.
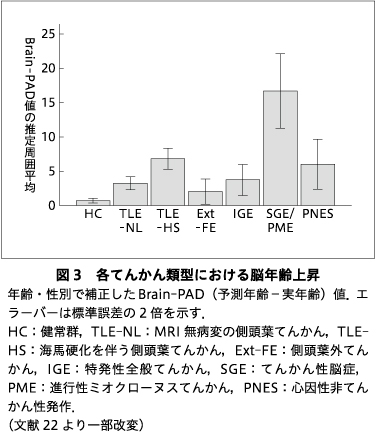
結果として,各てんかん類型でおおむね5年前後の脳年齢上昇が生じていることが示された(図3).これはPardoe, H. R. らの報告14)にも合致する数値であったが,特に海馬硬化を伴う側頭葉てんかんでは,MRI病変所見のない側頭葉てんかんや特発性全般てんかん,側頭葉外てんかんなどに比べて有意な脳年齢上昇を認めた.また,最も重症な群である,てんかん性脳症と進行性ミオクローヌスてんかんの群では15年以上の脳年齢上昇を認めた.てんかん類型によって脳年齢上昇の度合いは異なる一方,おおむねどの類型でも上昇が示唆される点は,神経の異常・過剰興奮による反復性のてんかん発作が脳の加齢を促進する可能性を示し,最近報告された焦点性てんかんにおける進行性の皮質厚減少9)や病理組織でのリン酸化タウの沈着23)といった知見にも合致すると考えられる.一方,興味深いことに,多くが薬剤で発作が抑制される特発性全般てんかんでも有意な脳年齢上昇を認めた.これは特発性全般てんかんにおける遺伝的素因やそれに起因する神経発達の異常,あるいは発作間欠期のてんかん性活動の影響などによる可能性がある.
III.側頭葉てんかんの精神病症状と脳年齢
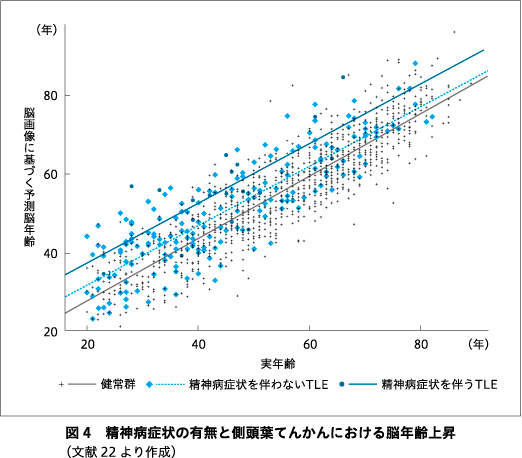
幻覚や妄想といった精神病症状のてんかんにおける合併率は一般人口の7.8倍といわれ5),特に側頭葉てんかんで多くみられることから何らかの神経生物学的な発症機序が推察されているが,いまだはっきりした機序やバイオマーカーは得られていない.著者らは精神病症状を伴う側頭葉てんかんにおける脳ネットワークの異常などを報告してきたが17)21),統合失調症における脳年齢上昇12)16),を考えると,てんかん精神病においても脳年齢が個人レベルでの新たなバイオマーカーとなりうる可能性が考えられた.今回の研究では,21名の発作間欠期精神病を伴う側頭葉てんかん群と,206名の精神病を伴わない側頭葉てんかん群で脳年齢を比較した.結果,精神病を伴わない側頭葉てんかん群では平均5.3年の上昇がみられたのに比し,精神病を伴う群では平均10.9年と有意な上昇を認めた(P<0.001,図4).この結果は海馬硬化の有無で補正しても有意であった(P=0.005).したがってこれは統合失調症と健常者で報告される脳年齢の差が5年程度であることとも矛盾せず,また,側頭葉てんかんと精神病で異常な脳の加齢が起こる機序がそれぞれ独立している可能性を示唆するとも考えられる.一方で,脳年齢を用いた側頭葉てんかんの精神病症状の有無の診断あるいは発症予測などが将来的に期待はされるものの,今回のデータではこれを診断するための受信者動作特性曲線(receiver operatorating characteristic curve:ROC)曲線の曲線下面積(area under the curve:AUC)は0.694で,単独でバイオマーカーとして用いるにはまだ難しい可能性が残された.
IV.心因性非てんかん性発作
心因性非てんかん性発作は,てんかん発作に似るが心因性の機序で起こると考えられている発作症状の一群で,てんかんではないため,抗てんかん薬などで誤った治療を行わないことが重要である11).一方,診断はしばしば難しく,確定診断に長時間ビデオ脳波検査が必要なケースもみられるが,検査できる場所が限られているという課題がある11).著者らは今回の研究22)で,MRI画像に基づくバイオマーカーでこの鑑別ができれば臨床的に有用であると考え,心因性非てんかん性発作群とてんかん群の脳年齢の比較を行った.結果としては,図3に示したように,心因性非てんかん性発作においても,てんかん群と同程度の脳年齢上昇が生じており,両群の間に有意差を認めなかった.てんかんとは機序が異なるはずであるが,心因性非てんかん性発作においても何らかの脳の異常が生じていると考えられた.著者らは他に,心因性非てんかん性発作における白質ネットワークの異常についても,拡散テンソル画像を用いて報告している20).
V.若年ミオクロニーてんかんと進行性ミオクローヌスてんかん
若年ミオクロニーてんかんは,主に15歳前後で発症し,ミオクロニー発作を生じる特発性全般てんかんのなかの一群で,一般的には薬剤への反応性が良好なケースが多く予後は悪くない.一方,進行性ミオクローヌスてんかんは,歯状核赤核淡蒼球ルイ体萎縮症やミトコンドリア病といったさまざまな神経変性疾患の一群で,進行性のミオクローヌス,知的退行,小脳失調を主徴とする.進行性ミオクローヌスてんかんは発症初期では若年ミオクロニーてんかんと症状が類似しているため,しばしば鑑別が困難なことがある1).今回の研究では,脳画像バイオマーカーにより両者を鑑別できる可能性を模索し,両群の脳年齢を比較した.結果として,進行性ミオクローヌスてんかん群で脳年齢の著しい高値を認めたものの,サンプルサイズが小さく,また病初期のデータも限られていたことから,実際に脳年齢をバイオマーカーとして使用するにはさらなる検証が必要と考えられた.
VI.研究の限界点
今回の研究の限界点として,各グループのサンプル数などの違いや,臨床症状の詳細評価の不足に加え,薬剤の影響が挙げられる.特に,統合失調症では抗精神病薬が脳年齢の加速をさらに促進するという報告もあり16),結果に影響した可能性はある.抗てんかん薬については不明であるが,例えば心因性非てんかん性発作では一般的に正しい診断がつくまで平均7年以上かかるとされ15),その間の不要な抗てんかん薬内服が脳年齢上昇を引き起こしたのかもしれない.また,飲酒や喫煙,糖尿病といった要因も脳年齢に影響するため8),これらの要素を加味することで,今後さらに脳年齢の臨床応用の精度を高めることができるかもしれない.
VII.てんかんにおける脳画像バイオマーカーの探索
てんかん診療における治療の根幹は発作の抑制であり,30%程度でみられる薬剤抵抗性てんかんに対して焦点病変の外科的切除がしばしば有効であることから,現段階で脳画像の最も大きな役割は焦点病変の同定である.この点においては,従来のMRIシークエンスで同定不能な病変に対して,新たな撮像方法や解析法,核医学画像,多モダリティを用いた手法など,さまざまなアプローチで焦点病変の可視化・同定が試みられており,著者らもしばしば報告を行ってきた3)18)19).
一方で,てんかんにおける多様な合併症には,認知機能障害や精神・行動の問題,あるいは突然死などが含まれるが,このような問題へも先端的なアプローチが望まれる.こういった合併症に関しては,てんかん臨床的に同じような発症経過,発作症状,抗てんかん薬治療を辿ったにもかかわらず,生じる例とまったく生じない例が混在するのが現状であり,これらの差異は脳のどこにあるのかを解明することが期待される.特に合併する精神症状については,てんかんとの関係は双方向的とされ4),てんかん発症に精神症状が先行することもあるため,てんかんにおける精神症状の仕組みを解明することは,単に患者QOLの改善に貢献しうるだけでなく,てんかんという脳の病態をより詳細に知ることにもつながるといえる.これまでの精神神経医学における貢献を考えれば,脳画像が低侵襲で有用なバイオマーカーとして確立・活用されることは強く期待されるはずであり,さらなる研究が望まれる.
VIII.PsychiatryとNeurology
最後に,精神医学と神経医学についても述べておきたい.両者は歴史的にもさまざまなかかわりがあり,最近では認知症がICD-11の草稿で精神疾患から外されて神経疾患に分類されるという懸念があった.てんかんに至ってはすでに神経疾患に分類され,世界的にはneurologyの分野である.しかし,そもそも精神疾患と神経疾患の違いとは何だろうか.例えば,整形外科と循環器内科が分かれているのは自然が決定したことであり,診ている臓器が異なるのである.一方,精神疾患と多くの神経疾患は,ともに脳という同じ臓器を舞台として起こるにもかかわらず,なぜか人為的な線引きがされており,この線引きは結局のところ学問側の都合で分けられていると著者は考えている.しかし,神経疾患や神経症状の知識は精神科臨床でも重要になるし,脳を侵す神経疾患では必然的に多くの精神症状を呈しうるため,両者がより近づいて相互に通じ合うことで脳に関連した臨床がより発展できると思われる.日本ではてんかん診療に精神科医がかかわってきたというユニークな文化があり,また日本精神神経学会は名前にpsychiatryとneurologyがともに入っている貴重な学会でもある.著者も会員の一人として,これからも両者の間に橋を架けるような仕事を行っていければと考えている.
おわりに
今回の研究では,てんかんの多様な類型・合併症に対し,脳画像に基づく脳年齢予測システムを応用し,各てんかん類型での脳年齢上昇や,発作間欠期精神病による脳年齢への影響などを報告した.今回得られた知見から,てんかんにおける異常な脳加齢プロセスが示唆され,さらに,脳画像に基づく年齢予測システムが,低侵襲で通常診療でも個人レベルで応用可能な画像バイオマーカーとして確立されることも期待される.
なお,本論文に関連して開示すべき利益相反はない.
謝 辞 本研究および関連研究にあたり,国立精神・神経医療研究センターの松田博史先生,佐藤典子先生,木村有喜男先生,太田深秀先生,舞草伯秀先生,イマン・ベヘシティ先生,渡辺雅子先生,ロンドン大学のマティアス・コップ教授をはじめとして,多くの先生方に大変お世話になりました.また,このような名誉ある賞をいただき,大変光栄に感じております.この場を借りて深く感謝申し上げます.
1) Badawy, R. A., Macdonell, R. A., Jackson, G. D., et al.: Can changes in cortical excitability distinguish progressive from juvenile myoclonic epilepsy? Epilepsia, 51 (10); 2084-2088, 2010![]()
2) Beheshti, I., Mishra, S., Sone, D., et al.: T1-weighted MRI-driven brain age estimation in Alzheimer's disease and Parkinson's disease. Aging Dis, 11 (3); 618-628, 2020![]()
3) Beheshti, I., Sone, D., Maikusa, N., et al.: FLAIR-wise machine-learning classification and lateralization of MRI-negative 18F-FDG PET-positive temporal lobe epilepsy. Front Neurol, 11; 580713, 2020![]()
4) Berg, A. T., Altalib, H. H., Devinsky, O.: Psychiatric and behavioral comorbidities in epilepsy: a critical reappraisal. Epilepsia, 58 (7); 1123-1130, 2017![]()
5) Clancy, M. J., Clarke, M. C., Connor, D. J., et al.: The prevalence of psychosis in epilepsy: a systematic review and meta-analysis. BMC Psychiatry, 14; 75, 2014![]()
6) Cole, J. H., Franke, K.: Predicting age using neuroimaging: innovative brain ageing biomarkers. Trends Neurosci, 40 (12); 681-690, 2017![]()
7) Cole, J. H., Ritchie, S. J., Bastin, M. E., et al.: Brain age predicts mortality. Mol Psychiatry, 23 (5); 1385-1392, 2018![]()
8) Franke, K., Gaser, C.: Ten years of BrainAGE as a neuroimaging biomarker of brain aging: what insights have we gained? Front Neurol, 10; 789, 2019![]()
9) Galovic, M., vanDooren, V. Q. H., Postma, T. S., et al.: Progressive cortical thinning in patients with focal epilepsy. JAMA Neurol, 76 (10); 1230-1239, 2019![]()
10) Gaser, C., Franke, K., Klöppel, S., et al.: BrainAGE in mild cognitive impaired patients: predicting the conversion to Alzheimer's disease. PLoS One, 8 (6); e67346, 2013![]()
11) Kanemoto, K., LaFrance, W. C. Jr., Duncan, R., et al.: PNES around the world: where we are now and how we can close the diagnosis and treatment gaps-an ILAE PNES Task Force report. Epilepsia Open, 2 (3); 307-316, 2017![]()
12) Koutsouleris, N., Davatzikos, C., Borgwardt, S., et al.: Accelerated brain aging in schizophrenia and beyond: a neuroanatomical marker of psychiatric disorders. Schizophr Bull, 40 (5); 1140-1153, 2014![]()
13) Leonardi, M., Ustun, T. B.: The global burden of epilepsy. Epilepsia, 43 (Suppl 6); 21-25, 2002![]()
14) Pardoe, H. R., Cole, J. H., Blackmon, K., et al.: Structural brain changes in medically refractory focal epilepsy resemble premature brain aging. Epilepsy Res, 133; 28-32, 2017![]()
15) Reuber, M., Fernández, G., Bauer, J., et al.: Diagnostic delay in psychogenic nonepileptic seizures. Neurology, 58 (3); 493-495, 2002![]()
16) Schnack, H. G., van Haren, N. E. M., Nieuwenhuis, M., et al.: Accelerated brain aging in schizophrenia: a longitudinal pattern recognition study. Am J Psychiatry, 173 (6); 607-616, 2016![]()
17) Sone, D., Matsuda, H., Ota, M., et al.: Graph theoretical analysis of structural neuroimaging in temporal lobe epilepsy with and without psychosis. PLoS One, 11 (7); e0158728, 2016![]()
18) Sone, D., Sato, N., Ota, M., et al.: Abnormal neurite density and orientation dispersion in unilateral temporal lobe epilepsy detected by advanced diffusion imaging. Neuroimage Clin, 20; 772-782, 2018![]()
19) Sone, D., Maikusa, N., Sato, N., et al.: Similar and differing distributions between 18F-FDG-PET and arterial spin labeling imaging in temporal lobe epilepsy. Front Neurol, 10; 318, 2019![]()
20) Sone, D., Sato, N., Ota, M., et al.: Widely impaired white mtter integrity and altered structural brain networks in psychogenic non-epileptic seizures. Neuropsychiatr Dis Treat, 15; 3549-3555, 2019![]()
21) Sone, D., Sato, N., Shigemoto, Y., et al.: Disrupted white matter integrity and structural brain networks in temporal lobe epilepsy with and without interictal psychosis. Front Neurol, 11; 556569, 2020![]()
22) Sone, D., Beheshti, I., Maikusa, N., et al.: Neuroimaging-based brain-age prediction in diverse forms of epilepsy: a signature of psychosis and beyond. Mol Psychiatry, 26 (3); 825-834, 2021![]()
23) Tai, X. Y., Koepp, M., Duncan, J. S., et al.: Hyperphosphorylated tau in patients with refractory epilepsy correlates with cognitive decline: a study of temporal lobe resections. Brain, 139 (Pt 9); 2441-2455, 2016![]()
24) van Vliet, E. A., Dedeurwaerdere, S., Cole, A. J., et al.: WONOEP appraisal: imaging biomarkers in epilepsy. Epilepsia, 58 (3); 315-330, 2017![]()