【目的】われわれはこれまでに,初発統合失調症患者において,視覚オッドボール課題におけるP300とN200の異常と,1年間の追跡調査でP300振幅の進行性の低下を報告してきた.ハイリスク群(CHR)の対象者でもP300の振幅減少と正常なP1/N1が観察されたが,これらの成分が経時的に変化するかどうかは不明である.本研究では,CHRにおける視覚P300,P1,N1,N200を縦断的に評価した.【方法】CHR(n=19)と健常対照群(HC,n=28)を対象に,ベースライン時と1年後のフォローアップ時の2回,視覚事象関連電位(ERP)を記録した.参加者は64チャンネルの脳波を記録しながら,スクリーン上に呈示された標準刺激(‘y’)のうち,頻度の低い標的刺激(‘x’)を無言で数えた.【結果】本研究では,ベースライン時から1年後のフォローアップ時までに統合失調症を発症したCHRはいなかった.両時点でCHRでは,HCと比較して視覚P300振幅が減少し,潜時が有意に遅延していた.さらに,陽性症状のより増悪していたCHR被験者では,両時点で振幅の低下が認められた.P1,N1,N200は群間で差がなかった.【結論】CHRでは視覚刺激に対するP300振幅の低下が認められた.なお,この所見は,1年後のフォローアップ時までには精神病に移行しなかった被験者におけるものである.視覚P300振幅と症状が関連しているということは,視覚P300が,CHRの臨床症状の背景にある病態生理学的障害を反映する重要な指標である可能性を示唆している.
2)九州大学大学院医学研究院精神病態医学
はじめに
統合失調症に関する最近の研究では,特に統合失調症の初発エピソードを経験した患者だけでなく,臨床症状や遺伝的なリスクの高さから統合失調症を発症するリスクが高いと考えられる患者の早期発見に焦点があてられている57).重要なことは,精神病を発症するリスクが高い人は,すでに何らかの精神症状に悩まされており,その症状を緩和するために治療を受けることが多いということである24)25).事象関連電位(event related potential:ERP)の研究は,初期の感覚処理や後期の作業記憶過程を含む,統合失調症の早期段階における神経生理学的変化を評価するために重要だろう.感覚誘発成分であるP1とN1は主に知覚処理の初期段階の指標とされており,統合失調症におけるそれらの異常はP300の異常とは独立してみられる54).視覚N200はタスクに関連した刺激によって惹起され,刺激の確率や分類の指標になるとされている39)48).視覚N200は統合失調症患者では,P300としばしば独立して異常がみられることが報告されている11)18)19)47)62).
P300は,標的刺激の呈示後約300~500 ms後にピークを迎えるが,被験者が頻繁に呈示される標準刺激と稀に呈示される標的刺激を識別するオッドボール・パラダイムで誘発される.聴覚P300は,作業記憶や注意力などの複雑な認知機能を反映していると考えられており46),統合失調症患者では異常がみられることが繰り返し報告されている8).聴覚P300の障害は,ハイリスク群(clinical high risk:CHR)でも報告されている9)14)21)44)59).Fusar-Poli, P. らはCHRを対象に聴覚P300を縦断的に評価したが,P300欠損は経時的に変化しなかった23).聴覚P300は精神病への移行27)38)60)や陰性症状や一般症状の改善の予測因子となりうる34).前者の研究の著者らも18ヵ月後のERPを測定したが,精神病に移行した被験者においてもP300の進行性変化は認められなかった61).
最近では,Hamilton, H. K. らが多施設共同研究で,聴覚P300振幅が小さいほど精神病発症までの時間が短くなることを報告している27).
ほとんどのP300研究は聴覚に焦点をあてているが,視覚刺激に対するP300も研究されている.視覚P300は統合失調症の「state」に対してより敏感であることが示唆されているが,聴覚P300は「trait」に対してより敏感であることが明らかにされている17)36).われわれの先行研究でも,初発エピソードの統合失調症患者では視覚P300振幅が徐々に低下していることが明らかになっている41).CHRでの視覚P300の報告は限定的である35)40).初回エピソードの統合失調症患者では,視覚オッドボール課題でP300とN200の異常が認められ,1年後の追跡調査でP300振幅の低下が進行していることがわかった40)41).さらに,CHRでは,P1とN1の異常はないことに加えて,視覚P300の振幅が減少し,潜時が延びていることが報告されている40).しかし,これらのERP成分がCHRで経時的に変化するかどうかについては,まだ明らかになっていない.以下では,CHRにおける視覚P300,およびP1,N1,N200の経時的評価を1年間の追跡調査で行った結果を報告する.
I.研究の方法および結果
1.対象者
サンプルは,19名のCHRと28名の健常対照者(HC)で構成された.被験者の募集は,Boston CIDAR Study7)の一部として行われた.CHRは臨床医からの紹介,または地元の病院や診療所を通じて,HCは新聞やウェブサイトの広告を通じて募集した.本研究は,ハーバード大学医学部,Beth Israel Deaconess Medical Center,ケンブリッジ病院,Brigham and Women’s Hospital,マサチューセッツ総合病院,および退役軍人局ボストン医療システムの倫理審査委員会によって承認された.すべての研究参加者(18歳未満の場合は法定後見人)は,研究参加前に書面によるインフォームド・コンセントを行い,参加費の支払いを受けた.先行研究41)(n=24)のすべてのHCが本研究に参加し,さらに4名のHCが新たに募集され,ベースラインとフォローアップの両方の評価を受けた.また,先行研究の23名のCHR被験者のうち,15名のCHRが本研究に参加した40).前回の研究から8名のCHRが今回の研究に参加しなかった理由は,①ドロップアウト(n=5),②測定間隔が短すぎる(n=2),③脳波データにおける過剰なアーチファクト/ノイズ(n=1)であった.さらに4名のCHR被験者が新たに募集され,ベースラインとフォローアップの両方の評価を受けた.本研究のCHR被験者13名とHC被験者23名は,われわれの以前の研究にも含まれていることに注意されたい42).すべての被験者の除外基準は次のとおりである:筋障害,難聴,または矯正されていない視覚障害などの感覚運動障害,神経学的障害,神経認知機能を著しく損なう医学的疾患,知的障害の診断,18歳未満の場合は小学5年生未満,18歳以上の場合は中学3年生未満の教育を受けていない,英語が流暢ではない,過去1ヵ月間のDSM-IV物質乱用,過去3ヵ月間のニコチンを除くDSM-IV物質依存症,現在の自殺行為,CHRでは過去5年以内に電気けいれん療法を受けたことがあり,HCでは電気けいれん療法を受けたことがある,および他の家族による試験参加.さらに,測定間隔が6ヵ月未満であり,アーチファクト除去処理後においても脳波上に過剰なアーチファクト/ノイズがみられた被験者(除外された被験者の数については上記を参照)は,以後の解析から除外された.物質使用は,DSM-IV-TRの精神科診断面接マニュアル(Structured Clinical Interview for DSM-IV-TR Axis I Disorders:SCID)の物質使用障害モジュールとわれわれのグループが開発した質問紙を用いて評価した.われわれは,物質使用と前駆症状の時間的関係を調べ,物質使用が原因となっていると思われるかどうかを(他の精神症状と同様に)判断した.
CHRは,Scale of Prodromal Symptoms〔SOPS, Structured Interview for Prodromal Syndromes(SIPS)のなかに含まれる〕で評価された37).CHR群の除外基準は,DSM-IVによる精神病性障害の診断,および物質誘発性またはその他の医学的に誘発された進行性症状の存在とした.参加者のうち1名を除く全員が減弱陽性症状(attenuated positive symptoms:APS)の基準を満たし,1名の参加者が遺伝的リスク(genetic risk and deterioration syndrome:GRD)の基準を満たしていた.APSの基準を満たした被験者のうち,1名の被験者がGRDの基準を,もう1名の被験者がスキゾイドパーソナリティ障害の基準を満たしていた.本研究の対象となった初回脳波測定時から1年以内に統合失調症を発症したCHR被験者はいなかった.CHRには,ベースライン時に大うつ病性障害(n=6),大うつ病性障害と注意欠如・多動性障害(n=1),II型双極性障害(n=3),II型双極性障害と摂食障害(n=1),およびフォローアップ時に以下の診断が追加されていた.大うつ病性障害(n=6),II型双極性障害(n=2),II型双極性障害および摂食障害(n=1),大麻乱用(n=1).HCはCHRと同じ地域から抽出され,年齢,性別,人種および民族性,手の不自由さ,および親の社会経済指標については同等の値を示した.現在の主要なDSM-IV-TR第1軸障害,または精神病,大うつ病(再発),双極性障害,強迫性障害,心的外傷後ストレス障害,または発達障害の既往歴を有するHCは除外された.HCはまた,精神科入院歴,増悪症状,統合失調型パーソナリティ障害または他のクラスターAパーソナリティ障害,精神病の第一度近親者,または現在または過去に抗精神病薬を使用していた場合も除外された.その他の過去の向精神薬の使用は許容されたが,睡眠薬や抗不安薬などの頓服薬を除き,被験者は研究に参加する前に少なくとも6ヵ月間は休薬していなければならなかった.
ベースライン時,CHR 19名中5名が非定型抗精神病薬を投薬されており,クロルプロマジン等価換算量は80.7±106.9 mg(範囲6.7~266.7 mg)であった56)65).他の向精神薬を投与された被験者の数は以下の通りである:気分安定薬=2,抗うつ薬=7,抗不安薬=6.フォローアップ時には,CHRの4/19名が非定型抗精神病薬を投薬されており,クロルプロマジン等価換算量は84.2±123.1 mg(範囲6.7~266.7 mg)であった.他の向精神薬を投与された患者は以下の数であった:気分安定薬=2,抗うつ薬=6,抗不安薬=5.薬物投与量は2つの時点間で差がなかった(t=1.36,P=0.19).
利き手は,Annett Handedness Questionnaireを用いて評価した1).
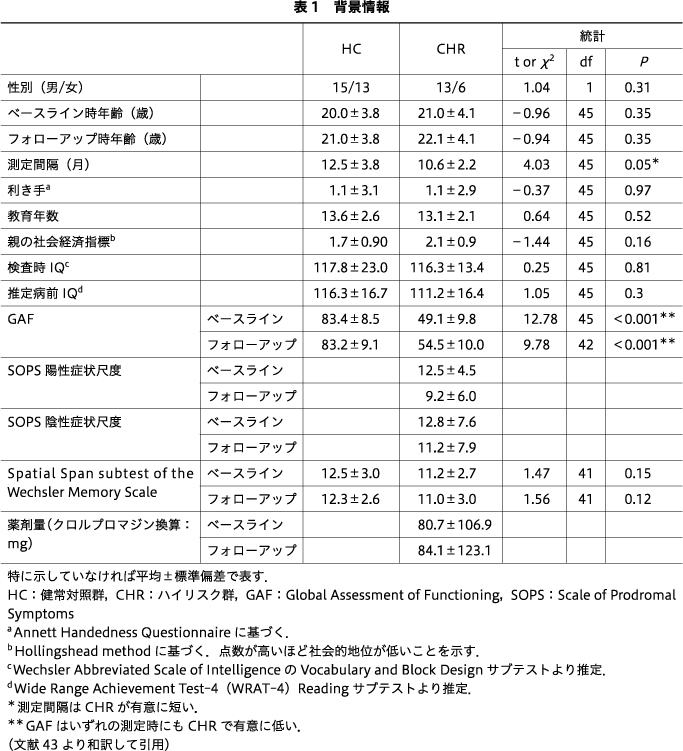
病前の知的能力はWide Range Achievement Test-464)のReadingサブテストを用いて推定し,現在の知的能力はWechsler Abbreviated Scale of IntelligenceのVocabulary and Block Designサブテストを用いて推定した63).親の社会経済指標は,Hollingsheadの2要素指数を用いて評価した30).すべての被験者は,Global Assessment of Functioning Scale(GAF)で評価された.また,行動的視覚的作業記憶検査であるWechsler Memory Scale-IIIのSpatial Spanサブテストも施行した.さらに,CHR症状はSOPSで評価した.すべてのデモグラフィックおよび臨床的データを表1にまとめた.脳波は,ベースライン時とフォローアップ時に同じ実験パラダイムとプロトコルで測定した.
2.実験パラダイム
被験者には,標準刺激(文字‘Y’,1.8×2.0 cm,総数144)に混ざって呈示される,頻度の低い(20%)標的刺激(文字‘X’,1.8×2.0 cm,総数36)を無言で数えるように指示した.文字は白で,被験者の目から約100 cm離れた黒いコンピュータ画面の中央に表示された.刺激時間は82 ms,刺激間隔は976 msであった(SuperLab 4.2,Cedrus Corporation,San Pedro,USA).
3.脳波データの取得と処理
脳波は,64チャンネルのActive-Twoシステム(BIOSEMI B. V.,Amsterdam,オランダ)を用いて,特注の電極キャップを使用して記録した.脳波は,512 Hzのデジタル化速度で取得され,DC-100 Hzのバンドパスで保存された.瞬きおよび眼球運動は,左右の目の外側および左目の上下に配置された電極を介してモニターされた.脳波データは,Brain Vision Analyzerパッケージ(Brain Products,Gilching,ドイツ)を用いてオフラインで処理され,オフラインで左右の乳様突起の平均値をリファレンスとした.刺激の開始100 ms前から開始し,刺激の開始後900 ms後に終了するようにエポックを切り取った.瞬きと眼球運動のアーチファクトは,グラットン,コルズ,およびドンチン法によって補正した26).±100 μV以上の筋電図などの活動を含むエポックは,加算平均の前に取り除いた.加算平均は,刺激前100 msの値でベースライン補正をした後,標的刺激と標準刺激を別々に計算した.P300とN200は標的刺激に対する反応,N1とP1は標準刺激に対する反応から計算をした.P300ピークの振幅および潜時は,350~650 msの間の最も正の値が大きいデータポイントとして,N200は190~380 msの刺激後の間の最も負の値が大きいデータポイントとして同定された.P1ピークは,60~200 msの間の最も正の値が大きいデータポイントとして,N1は,刺激開始後75~260 msの間の最も負の値が大きいデータポイントとして同定された.時間枠の選択は,先の研究41)と同様であり,個々のERP平均とグランド平均データの慎重な目視検査によって決定された.これらのピークは,それらが最大となった電極部位(P300:Cz,Pz;N200:Fz,Cz;P1:PO3/PO4,O1/O2;N1:P7/P8,PO7/PO8)で測定した.
解析に含める被験者の最小試行数は75%(標的刺激:27試行,標準刺激:108試行)とした.すべての被験者がこの基準を満たしていた.個々の平均値を構築するために使用された標的刺激と標準刺激の平均回数は,ベースライン時とフォローアップ時のいずれにおいても群間で有意差はなく(t<1.41,P>0.16),それぞれ約35回と139回であった.
4.統計解析
性別,年齢,利き手,測定間隔,教育年数,親の社会経済指標,推定病前IQ,検査時IQおよびGAF(表1)における群間差を評価するために独立t検定が用いられた.ERPは,Group(HCまたはCHR)を被験者間因子,電極およびTime(ベースラインまたはフォローアップ)を被験者内因子とした反復測定分散分析を用いて分析した.
5.相関分析
以前に,視覚P300振幅とSOPS陽性症状スコアとの間に相関関係があることを見いだしていたため40),ベースライン時とフォローアップ時のCHRのPzにおけるP300振幅とSOPS陽性症状スコアとの相関関係を,スピアマンのρを用いて別々に調べた.
6.結 果
1)デモグラフィック,神経心理学的変数
両群間では,性別,年齢,利き手,教育年数,親の社会経済指標,推定病前IQ,または検査時IQに有意差はなかった.CHRでは,ベースライン時とフォローアップ時の両方において,HCと比較してGAFスコアが統計学的に有意に低かった(表1).HCのなかの1人の測定間隔が比較的長かった(30ヵ月)ため,測定間隔もCHRで有意に短かった.なお,以下に報告する統計結果は,このHCの被験者を除外しても同じであったことに注意されたい.
標的刺激のカウント数については,両時点での両群とも90%以上の精度があり,群間差は認められなかった(t<0.15,P>0.38)ため,以下の結果は,誤って認識された標的を含むエポックの影響を受けている可能性は低いと考えられる.CHRのSOPS陽性症状スコアは時間の経過とともに改善したが(t=2.4,P=0.03),SOPS陰性症状スコアは改善しなかった(t=1.5,P=0.15).
2)ERP変数
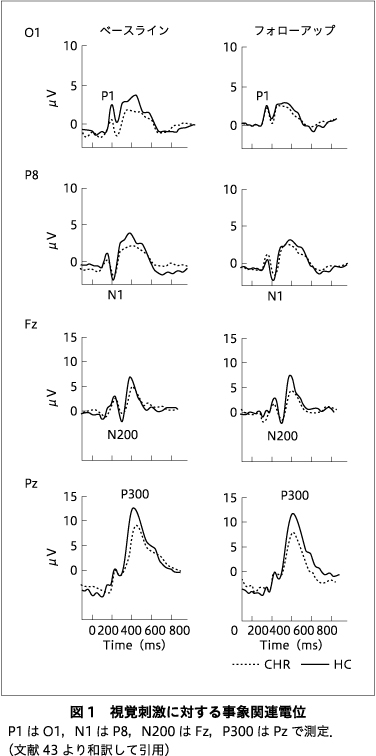
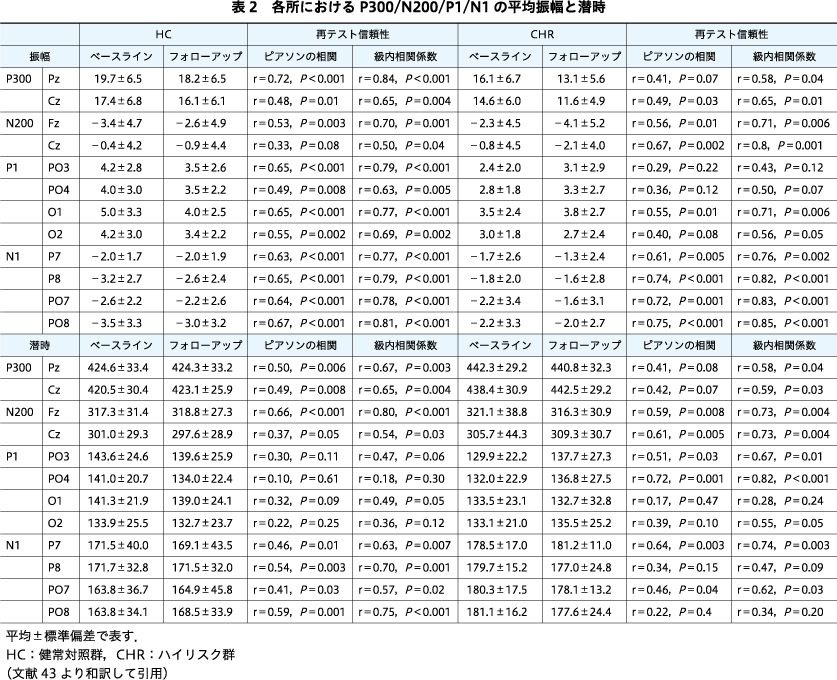
図1は,各グループにおける視覚的なERPのグランドアベレージを示している.各成分の値は表2にまとめた.
3)P300のピーク振幅と潜時
Groupの主効果は,F(1,45)=6.43,P=0.02,η2=0.13であり,両時点でのP300振幅はHCよりCHRのほうが小さかったことを示唆していた.
P300振幅にはTimeの主効果があり,F(1,45)=7.08,P=0.01,η2=0.14であったが,これは両群とも時間の経過とともにP300振幅の減少を示す傾向を反映していた.他の相互作用は有意ではなかった(Fs<0.90,Ps>0.35).
P300ピーク潜時は両時点でCHRでは遅くなっており,F(1,45)=5.70,P=0.02,η2=0.11であった.他に有意な主効果や相互作用は認められなかった(Fs<1.62,Ps>0.21).
4)N200ピーク振幅と潜時
N200振幅は群間で差がなく,F(1,45)=0.18,P=0.67であった.有意な相互作用は認められなかった(Fs<3.43,Ps>0.07).
N200潜時は,両群とも前頭部よりも中心部のほうが有意に短かったが〔F(1,45)=38.77,P<0.001〕,群間差はなかった〔F(1,45)=0.30,P=0.59〕.他の有意な主効果または相互作用は認められなかった(Fs<3.58,Ps>0.07).
5)P1ピーク振幅と潜時
P1の振幅および潜時は,群間で差がなかった(Fs<2.17,Ps<0.15).有意な相互作用は認められなかった(Fs<2.39,Ps>0.13).
6)N1ピーク振幅と潜時
N1の振幅と潜時は群間で差がなかった(Fs<2.56,P<0.12).有意な相互作用は認められなかった(Fs<0.94,Ps>0.42).
7)各時点におけるP300と臨床変数との相関関係
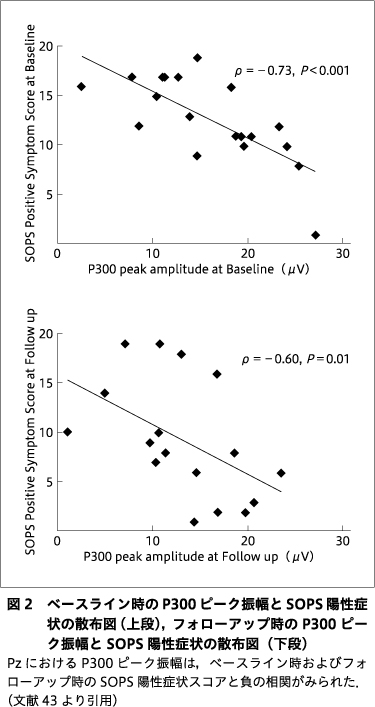
ベースライン時のP300ピーク振幅とSOPS陽性症状スコアとの間には有意な負の相関が認められた(ρ=-0.73,P<0.001,図2上段).P300振幅変化スコア(ベースライン時―フォローアップ時)は,SOPS陽性症状スコア変化スコア(ベースライン時―フォローアップ時)と負の相関を示したが,有意にはならなかった(ρ=-0.46,P=0.07).探索的解析では,P300値とSPAN合計スコアとの相関を調べたが,有意な相関は認められなかった(-0.12<ρ<0.11,0.62<P<0.66).
すべてのCHR症例(-0.28<ρ<0.12,0.15<P<0.79)で計算した場合も,薬を投与された被験者のみ(-0.08<ρ<0.03,0.87<P<0.98)で計算した場合も,いずれの時点でも,P300値とクロルプロマジン等価換算量との間に有意な相関はみられなかった.
II.考察
CHRとHCの視覚オッドボール課題におけるP300 ERP成分を縦断的に調査し,CHRではP300と症状との相関を調べた.CHRではHCに比べて両時点でP300振幅が小さく,P300潜時が延長していた.われわれの先行研究で報告した時間の経過とともにP300振幅の漸進的な減少を示した初発統合失調症患者とは異なり,CHRではHCと比較して進行性の変化はみられなかった.
CHRに焦点をあてた研究では,精神病の発症が予測できるかどうかという問題が大きな注目を集めている.いくつかの神経生理学的指標のなかで,ミスマッチ陰性電位(mismatch negativity:MMN)が最も研究され,CHRではMMNの異常が報告されており2)5)13)29)31)45)50)51),特に持続時間のずれに対するMMNは転帰の予測因子の1つと考えられている6).P300はCHRでも障害されることが報告されており,その多くは聴覚刺激に対してであるが9)21)44)59),視覚刺激に対しても障害されることが報告されている35).例えば,Fusar-Poliらは,ベースラインから28ヵ月後に聴覚P300を縦断的に評価したところ,CHRでは一貫してP300振幅の低下が認められたが,ベースラインとフォローアップの間に差は認められなかったと報告している23).van Tricht, M. J. らは,CHRではすでに聴覚オッドボール課題に対するP300振幅が減少しており,後に精神病に移行した被験者群では,移行しなかった被験者群に比べて振幅が小さくなっていたと報告している60).これらのサンプルでは進行性の減少は縦断的には観察されなかったが,van Trichtらは,聴覚P300が精神病への移行と移行までの時間を予測できることを示しており,ベースライン予測バイオマーカーとしての潜在的な役割を示唆している23)61).われわれの知る限りでは,発症の予測因子として視覚P300を調査した研究はなく,今回の研究では発症者は含まれていなかったので,視覚P300の減少が精神病に移行する者とそうでない者を区別するかどうかを決定するためには,さらなる調査が必要である.
われわれの先行研究では,初回エピソードの統合失調症患者ではSPAN合計スコアが低下し,視覚P300振幅はスコアと正の相関を示した41).
今回の研究では,CHR対象者はSPAN合計スコアの低下を示さなかったため,有意な相関がないことは驚くに値しない.一方,P300振幅の低下は,フォローアップ時に症状が改善していても,SOPS陽性症状尺度で評価される症状の重症度と相関していた.さらに,P300変化スコアは,トレンドレベルでの陽性症状変化スコアと負の相関を示した.
この研究では,両群ともP300振幅は時間の経過とともに減少したが,潜時は変化しなかった.これは,視覚P300振幅は加齢とともに減少するが,潜時は変化しないというStige, S. らの報告にあるように55),視覚P300の正常な発達を反映している可能性がある.被験者の年齢や測定間隔を共変量として加えても,結果はほぼ同じであったが,時間の主効果のみが有意ではなかった.このように,P300振幅の変化とSOPS陽性症状の経時変化とのトレンドレベルの相関は,発達性の変化と陽性症状との間の複雑で間接的な関係を反映している可能性があり,臨床的に改善した被験者は経時的にP300振幅の減少が小さくなったことを示唆していると考えられる.
CHRでは両時点でP300潜時が有意に延長しており,経時的には有意な変化は認められなかった.拡散テンソルイメージング研究では,CHRでのフラクショナル異方性(fractional anisotropy:FA)値が小さいことが報告されている4)32)33)49).さらに,Domen, P. らは,統合失調症患者の兄弟の全脳平均FA値が3年間のフォローアップ期間を通じて有意に低下することを示した15).Begré, S. らの報告によると,統合失調症患者ではFA値がP300潜時と相関していたことから3),今回の研究でP300潜時が遅れることは,白質障害として現れる可能性のある病態生理学的変化が神経細胞の処理を遅らせ,CHRではすでに存在しているが,少なくとも本研究の観察期間中には進行していないことを示唆しているのかもしれない.Lee, S. Y. らは,CHRでは視覚P300潜時は正常であると報告しているが35),CHRにおける視覚P300を調査した唯一の先行研究であることを考えると,CHRでP300潜時が延長しているかどうかはまだ明らかにされていない.
早期成分については,ある研究では聴覚ダブルクリックパラダイムでのN100抑制障害が報告され10),別の研究ではCHRで正弦波音に対するN100振幅の低下が報告されたが,他の研究では聴覚オッドボール課題でのN100は正常であると報告された9)60).後者の研究サンプルでは,CHRでは精神病への移行を通じてN100振幅が減少したことに留意する必要がある61).われわれの知る限りでは,われわれの先行研究以外に,CHRにおける視覚刺激の初期要素を調査した研究はない.今回の研究では,ベースラインでもフォローアップでも異常は認められなかった.P1については,統合失調症では大細胞経路に特化した刺激(低コントラスト・空間周波数)を用いた研究で振幅の低下が一貫して報告されているが16)20),小細胞経路に偏った刺激(高コントラスト・空間周波数)や単純な視覚オッドボール課題を用いた研究では振幅の低下は認められなかった12)58).CHRにおけるP1に選択的に焦点をあてるためには,大細胞経路を介して処理されるタスクを選択することが不可欠である.この初期の視覚成分に焦点をあてた神経生理学的研究がないため,CHRでP1が異常であるかどうかのエビデンスが不足している.
視覚N200は刺激分類の指標と考えられており53)54),統合失調症患者ではP300とはほとんど無関係に低下することが報告されている11)18)19)47)62).この研究でのN200はCHRとHCで有意差はなかったが,CHRで視覚N200を調査した報告がほかにないことを考えると,この被験者群でN200が正常であるという確固たる結論を出すのは早いだろう.
表2に要約されているように,各成分の振幅および潜時は,各群のベースラインとフォローアップの間で高い相関を示しており,われわれのデータの信頼性を強化している.しかしながら,初期成分のいくつか(HCではPO4およびO2でのP1,CHRではO1でのP1およびPO8でのN1)の潜時は,2つの時点間で相関しなかった.これは,これらの初期の小成分がアーチファクトの影響を受けやすいためであろう.ピーク付近の平均値または時間窓内の平均値を使用することで,テスト―再試験の信頼性がある程度高まるかもしれないが,先行研究との比較可能性から,ピーク振幅の値を採用した.
今回の研究を要約すると,精神病に移行しなかったCHRの1年間のフォローアップ期間を通じて,持続的な視覚P300振幅の低下と潜時の延長が認められた.症状がより陽性であった被験者では,両時点で振幅の減少がより顕著であった.しかし,P300は統合失調症の進行に敏感であるという証拠はあるものの,このサンプルには精神病発症者がいなかったため,視覚P300の異常がその後精神病に移行する被験者を検出できるかどうかという疑問については不明である.視覚P300は,前駆症状のバイオマーカーになる可能性がある.しかし,現段階では,このERP成分が精神病発症の有無にかかわらず臨床的にハイリスク者に存在する神経認知障害の指標となるのか,あるいは視覚P300異常が統合失調症発症の予測因子となるのかは不明である.精神病の発症の生物学的マーカーとしての視覚P300の問題については,精神病症状を発症するものを含む今後の研究が必要である.一方で,精神病のリスクが高い人が呈する臨床症状は,たとえ精神病に移行しなくても,減弱精神病症候群を構成していることがわかってきており,正式な精神疾患として認められるようになってきている.このように,視覚刺激に対するP300は,この臨床状態の背景にある病態生理的変化を反映する重要な指標となりうると思われる.
おわりに
今回の研究43)は,統合失調症の発症や進行を多角的,縦断的に評価するために行われたBoston CIDAR Studyによって集積された脳波データのうち,ハイリスク群における視覚オッドボール課題のデータを解析したものである.よく知られているように,at risk mental state,ultra high riskなどと抽出された群のなかで,3年以内に約20~30%が統合失調症などの精神疾患を発症するとされており,ハイリスクと判断された段階で発症を予測する指標が求められている.脳波によって得られる事象関連電位は,精神疾患では数少ない客観的な指標の1つであり,今後の活用が期待される.なかでもP300は聴覚刺激,視覚刺激のいずれの場合でも,異常がある場合は精神病の発症までの期間が短いことや,異常がない場合は将来的に症状が緩和することが予測できると報告されている27)28).MMNについても,振幅が小さいほど,発症までの期間が短いという報告がある22)45).本稿にあるように,今回のデータ群では観察期間中に(幸いにして)統合失調症を発症した参加者はいなかった.このことの要因には観察期間の短さなどもあると思うが,このような大規模研究に参加し,心理士などを含めて手厚くフォローされること自体が発症を防いだ可能性もあるかもしれない.
いずれにしても,有病率が人口の1%といわれる統合失調症の患者のうち,事前にハイリスク群としてとらえられるのはごく一部であり,前駆症状が問題とならずに発症に至るケースが大半である.P300やMMNは簡易に測定できるため,前駆症状の有無にかかわらず,ある程度大規模な10代の若者の集団などで測定して経過をフォローできれば,興味深い知見が得られるかもしれない.
なお,本論文に関連して開示すべき利益相反はない.
本論文はPCN誌に掲載された最新の研究論文43)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
1) Annett, M.: A classification of hand preference by association analysis. Br J Psychol, 61 (3); 303-321, 1970![]()
2) Atkinson, R. J., Michie, P. T., Schall, U.: Duration mismatch negativity and P3a in first-episode psychosis and individuals at ultra-high risk of psychosis. Biol Psychiatry, 71 (2); 98-104, 2012![]()
3) Begré, S., Kleinlogel, H., Kiefer, C., et al.: White matter anisotropy related to electrophysiology of first episode schizophrenia during NoGo inhibition. Neurobiol Dis, 30 (2); 270-280, 2008![]()
4) Bloemen, O. J. N., de Koning, M. B., Schmitz, N., et al.: White-matter markers for psychosis in a prospective ultra-high-risk cohort. Psychol Med, 40 (8); 1297-1304, 2010![]()
5) Bodatsch, M., Ruhrmann, S., Wagner, M., et al.: Prediction of psychosis by mismatch negativity. Biol Psychiatry, 69 (10); 959-966, 2011![]()
6) Bodatsch, M., Brockhaus-Dumke, A., Klosterkötter, J., et al.: Forecasting psychosis by event-related potentials-systematic review and specific meta-analysis. Biol Psychiatry, 77 (11); 951-958, 2015![]()
7) Boston CIDAR Study. (https://bricweb.bidmc.harvard.edu/bostoncidar) (参照2021-08-31)
8) Bramon, E., Rabe-Hesketh, S., Sham, P., et al.: Meta-analysis of the P300 and P50 waveforms in schizophrenia. Schizophr Res, 70 (2-3); 315-329, 2004![]()
9) Bramon, E., Shaikh, M., Broome, M., et al.: Abnormal P300 in people with high risk of developing psychosis. Neuroimage, 41 (2); 553-560, 2008![]()
10) Brockhaus-Dumke, A., Schultze-Lutter, F., Mueller, R., et al.: Sensory gating in schizophrenia: P50 and N100 gating in antipsychotic-free subjects at risk, first-episode, and chronic patients. Biol Psychiatry, 64 (5); 376-384, 2008![]()
11) Bruder, G., Kayser, J., Tenke, C., et al.: The time course of visuospatial processing deficits in schizophrenia: an event-related brain potential study. J Abnorm Psychol, 107 (3); 399-411, 1998![]()
12) Butler, P. D., Martinez, A., Foxe, J. J., et al.: Subcortical visual dysfunction in schizophrenia drives secondary cortical impairments. Brain, 130 (Pt 2); 417-430, 2007![]()
13) Carrión, R. E., Cornblatt, B. A., McLaughlin, D., et al.: Contributions of early cortical processing and reading ability to functional status in individuals at clinical high risk for psychosis. Schizophr Res, 164 (1-3); 1-7, 2015![]()
14) del Re, E. C., Spencer, K. M., Oribe, N., et al.: Clinical high risk and first episode schizophrenia: auditory event-related potentials. Psychiatry Res, 231 (2); 126-133, 2015![]()
15) Domen, P., Peeters, S., Michielse, S., et al.: Differential time course of microstructural white matter in patients with psychotic disorder and individuals at risk: a 3-year follow-up study. Schizophr Bull, 43 (1); 160-170, 2017![]()
16) Doniger, G. M., Foxe, J. J., Murray, M. M., et al.: Impaired visual object recognition and dorsal/ventral stream interaction in schizophrenia. Arch Gen Psychiatry, 59 (11); 1011-1020, 2002![]()
17) Duncan, C. C.: Event-related brain potentials: a window on information processing in schizophrenia. Schizophr Bull, 14 (2); 199-203, 1988![]()
18) Egan, M. F., Duncan, C. C., Suddath, R. L., et al.: Event-related potential abnormalities correlate with structural brain alterations and clinical features in patients with chronic schizophrenia. Schizophr Res, 11 (3); 259-271, 1994![]()
19) Ford, J. M., White, P. M., Csernansky, J. G., et al.: ERPs in schizophrenia: effects of antipsychotic medication. Biol Psychiatry, 36 (3); 153-170, 1994![]()
20) Foxe, J. J., Doniger, G. M., Javitt, D. C.: Early visual processing deficits in schizophrenia: impaired P1 generation revealed by high-density electrical mapping. Neuroreport, 12 (17); 3815-3820, 2001![]()
21) Frommann, I., Brinkmeyer, J., Ruhrmann, S., et al.: Auditory P300 in individuals clinically at risk for psychosis. Int J Psychophysiol, 70 (3); 192-205, 2008![]()
22) Fryer, S. L., Roach, B. J., Hamilton, H. K., et al.: Deficits in auditory predictive coding in individuals with the psychosis risk syndrome: prediction of conversion to psychosis. J Abnorm Psychol, 129 (6); 599-611, 2020![]()
23) Fusar-Poli, P., Crossley, N., Woolley, J., et al.: Gray matter alterations related to P300 abnormalities in subjects at high risk for psychosis: longitudinal MRI-EEG study. Neuroimage, 55 (1); 320-328, 2011![]()
24) Fusar-Poli, P., Borgwardt, S., Bechdolf, A., et al.: The psychosis high-risk state: a comprehensive state-of-the-art review. JAMA Psychiatry, 70 (1); 107-120, 2013![]()
25) Fusar-Poli, P., Carpenter, W. T., Woods, S. W., et al.: Attenuated psychosis syndrome: ready for DSM-5.1? Annu Rev Clin Psychol, 10; 155-192, 2014![]()
26) Gratton, G., Coles, M. G., Donchin, E.: A new method for off-line removal of ocular artifact. Electroencephalogr Clin Neurophysiol, 55 (4); 468-484, 1983![]()
27) Hamilton, H. K., Roach, B. J., Bachman, P. M., et al.: Association between P300 responses to auditory oddball stimuli and clinical outcomes in the psychosis risk syndrome. JAMA Psychiatry, 76 (11); 1187-1197, 2019![]()
28) Hamilton, H. K., Woods, S. W., Roach, B. J., et al.: Auditory and visual oddball stimulus processing deficits in schizophrenia and the psychosis risk syndrome: forecasting psychosis risk with P300. Schizophr Bull, 45 (5); 1068-1080, 2019![]()
29) Higuchi, Y., Sumiyoshi, T., Seo, T., et al.: Mismatch negativity and cognitive performance for the prediction of psychosis in subjects with at-risk mental state. PLoS One, 8 (1); e54080, 2013![]()
30) Hollingshead, A. B.: Two Factor Index of Social Position. Yale University Press, New Haven, 1957
31) Hsieh, M. H., Shan, J. C., Huang, W. L., et al.: Auditory event-related potential of subjects with suspected pre-psychotic state and first-episode psychosis. Schizophr Res, 140 (1-3); 243-249, 2012![]()
32) Karlsgodt, K. H., Niendam, T. A., Bearden, C. E., et al.: White matter integrity and prediction of social and role functioning in subjects at ultra-high risk for psychosis. Biol Psychiatry, 66 (6); 562-569, 2009![]()
33) Katagiri, N., Pantelis, C., Nemoto, T., et al.: A longitudinal study investigating sub-threshold symptoms and white matter changes in individuals with an 'at risk mental state' (ARMS). Schizophr Res, 162 (1-3); 7-13, 2015![]()
34) Kim, M., Lee, T. Y., Lee, S., et al.: Auditory P300 as a predictor of short-term prognosis in subjects at clinical high risk for psychosis. Schizophr Res, 165 (2-3); 138-144, 2015![]()
35) Lee, S. Y., Namkoong, K., Cho, H. H., et al.: Reduced visual P300 amplitudes in individuals at ultra-high risk for psychosis and first-episode schizophrenia. Neurosci Lett, 486 (3); 156-160, 2010![]()
36) Mathalon, D. H., Ford, J. M., Pfefferbaum, A.: Trait and state aspects of P300 amplitude reduction in schizophrenia: a retrospective longitudinal study. Biol Psychiatry, 47 (5); 434-449, 2000![]()
37) Miller, T. J., McGlashan, T. H., Woods, S. W., et al.: Symptom assessment in schizophrenic prodromal states. Psychiatr Q, 70 (4); 273-287, 1999![]()
38) Nieman, D. H., Ruhrmann, S., Dragt, S., et al.: Psychosis prediction: stratification of risk estimation with information-processing and premorbid functioning variables. Schizophr Bull, 40 (6); 1482-1490, 2014![]()
39) Novak, G. P., Ritter, W., Vaughan, H. G. Jr., et al.: Differentiation of negative event-related potentials in an auditory discrimination task. Electroencephalogr Clin Neurophysiol, 75 (4); 255-275, 1990![]()
40) Oribe, N., Hirano, Y., Kanba, S., et al.: Early and late stages of visual processing in individuals in prodromal state and first episode schizophrenia: an ERP study. Schizophr Res, 146 (1-3); 95-102, 2013![]()
41) Oribe, N., Hirano, Y., Kanba, S., et al.: Progressive reduction of visual P300 amplitude in patients with first-episode schizophrenia: an ERP study. Schizophr Bull, 41 (2); 460-470, 2015![]()
42) Oribe, N., Hirano, Y., De lRe, E., et al.: Progressive reduction of auditory evoked gamma in first episode schizophrenia but not clinical high risk individuals. Schizophr Res, 208; 145-152, 2019![]()
43) Oribe, N., Hirano, Y., Del Re, E., et al.: Longitudinal evaluation of visual P300 amplitude in clinical high-risk subjects: an event-related potential study. Psychiatry Clin Neurosci, 74 (10); 527-534, 2020![]()
44) Ozgürdal, S., Gudlowski, Y., Witthaus, H., et al.: Reduction of auditory event-related P300 amplitude in subjects with at-risk mental state for schizophrenia. Schizophr Res, 105 (1-3); 272-278, 2008![]()
45) Perez, V. B., Woods, S. W., Roach, B. J., et al.: Automatic auditory processing deficits in schizophrenia and clinical high-risk patients: forecasting psychosis risk with mismatch negativity. Biol Psychiatry, 75 (6); 459-469, 2014![]()
46) Polich, J.: Updating P300: an integrative theory of P3a and P3b. Clin Neurophysiol, 118 (10); 2128-2148, 2007![]()
47) Potts, G. F., O'Donnell, B. F., Hirayasu, Y., et al.: Disruption of neural systems of visual attention in schizophrenia. Arch Gen Psychiatry, 59 (5); 418-424, 2002![]()
48) Ritter, W., Simson, R., Vaughan, H. G. Jr., et al.: A brain event related to the making of a sensory discrimination. Science, 203 (4387); 1358-1361, 1979![]()
49) Saito, J., Hori, M., Nemoto, T., et al.: Longitudinal study examining abnormal white matter integrity using a tract-specific analysis in individuals with a high risk for psychosis. Psychiatry Clin Neurosci, 71 (8); 530-541, 2017![]()
50) Shaikh, M., Valmaggia, L., Broome, M. R., et al.: Reduced mismatch negativity predates the onset of psychosis. Schizophr Res, 134 (1); 42-48, 2012![]()
51) Shin, K. S., Kim, J. S., Kang, D. H., et al.: Pre-attentive auditory processing in ultra-high-risk for schizophrenia with magnetoencephalography. Biol Psychiatry, 65 (12); 1071-1078, 2009![]()
52) Simson, R., Vaughn, H. G. Jr., Ritter, W.: The scalp topography of potentials in auditory and visual discrimination tasks. Electroencephalogr Clin Neurophysiol, 42 (4); 528-535, 1977![]()
53) Soltani, M., Knight, R. T.: Neural origins of the P300. Crit Rev Neurobiol, 14 (3-4); 199-224, 2000![]()
54) Sponheim, S. R., McGuire, K. A., Stanwyck, J. J.: Neural anomalies during sustained attention in first-degree biological relatives of schizophrenia patients. Biol Psychiatry, 60 (3); 242-252, 2006![]()
55) Stige, S., Fjell, A. M., Smith, L., et al.: The development of visual P3a and P3b. Dev Neuropsychol, 32 (1); 563-584, 2007![]()
56) Stoll, A. L.: The Psychopharmacology Reference Card. McLean Hospital, Belmont, 2001
57) Takahashi, T., Suzuki, M.: Brain morphologic changes in early stages of psychosis: implications for clinical application and early intervention. Psychiatry Clin Neurosci, 72 (8); 556-571, 2018![]()
58) van der Stelt, O., Frye, J., Lieberman, J. A., et al.: Impaired P3 generation reflects high-level and progressive neurocognitive dysfunction in schizophrenia. Arch Gen Psychiatry, 61 (3); 237-248, 2004![]()
59) vanderStelt, O., Lieberman, J. A., Belger, A.: Auditory P300 in high-risk, recent-onset and chronic schizophrenia. Schizophr Res, 77 (2-3); 309-320, 2005![]()
60) van Tricht, M. J., Nieman, D. H., Koelman, J. H. T. M., et al.: Reduced parietal P300 amplitude is associated with an increased risk for a first psychotic episode. Biol Psychiatry, 68 (7); 642-648, 2010![]()
61) vanTricht, M. J., Nieman, D. H., Koelman, J. H. T. M., et al.: Auditory ERP components before and after transition to a first psychotic episode. Biol Psychol, 87 (3); 350-357, 2011![]()
62) Vohs, J. L., Hetrick, W. P., Kieffaber, P. D., et al.: Visual event-related potentials in schizotypal personality disorder and schizophrenia. J Abnorm Psychol, 117 (1); 119-131, 2008![]()
63) Wechsler, D.: Wechsler Abbreviated Scale of Intelligence. 1999
64) Wilkinson, G. S., Robertson, G. J.: WRAT 4: Wide Range Achievement Test, 4th ed: professional manual. Psychological Assessment Resources, Lutz, p.494, 2006
65) Woods, S. W.: Chlorpromazine equivalent doses for the newer atypical antipsychotics. J Clin Psychiatry, 64 (6); 663-667, 2003![]()