近年,多彩な精神症状や,ジスキネジア,けいれん発作,自律神経症状や中枢性の呼吸抑制,意識障害などの症状を呈する抗NMDAR(N-methyl-D-aspartate受容体)抗体に関連した脳炎(抗NMDAR脳炎)の存在が話題になっている.抗NMDAR脳炎は若年女性に多く,卵巣奇形腫を伴う頻度が比較的高い.抗NMDAR脳炎はDalmau, J. らが2007年に初めて報告したが,脳炎症状が前面に出る症例以外にも,精神症状が前面に出て非定型あるいは緊張病型の統合失調症の初発を想起させる症例が相次いで報告された.本邦でも2012年,Tsutsui, K., Kanbayashi, T. らが,抗NMDAR脳炎の個々の症例を詳細に報告し,その病像を類型化した.統合失調症全体からすれば,抗NMDAR脳炎の関与が疑われる症例は一部かもしれないが,いわゆる内因性精神病の異種性と,その原因を考えるうえで,統合失調症の診断・治療を受けた患者の一部に自己免疫性脳炎が関与した症例があるということは非常に重要な発見である.著者は睡眠研究に携わっているが,長年の研究対象であるナルコレプシーも,自己免疫異常によりオレキシン(ハイポクレチン)の神経脱落が後天的,特異的に生じ発症することが判明した.本総説では,ナルコレプシーおよび精神医学・睡眠医学領域における自己免疫性脳炎・脳症に関する研究の歴史と進展を追いながら,私感も交えて考察を加えた.著者は免疫学が専門ではないので,個々の発見の詳細を読み取るというよりも,研究の一連の流れとそのバックグラウンドを知る資料として捉えていただきたい.
はじめに
著者は,1982年大阪医科大学卒業後,同大学精神科教室で堺俊明主任教授のもとで2年間の研修を受け,その後大学院へ進学した.1987年,大学院4年時にスタンフォード大学精神科・睡眠研究所に留学する機会を得,2019年の現在まで31年間睡眠研究に従事している.
留学当初から,原発性過眠症であるナルコレプシーの研究に従事し,とりわけ,家族性(単一遺伝子による常染色体劣性遺伝)で発症するイヌのナルコレプシーのモデルを用いてヒトのナルコレプシーの原因・病態生理の解明に力をそそいできた35)38)40).イヌのナルコレプシーは,レム睡眠の発見者の一人であり1963年にスタンフォード睡眠研究所を設立したDement, W. C. により1973年に見出され,ナルコレプシーの原因究明のためにナルコレプシーモデル犬がスタンフォード大学で飼育繁殖されていた35)38).
ナルコレプシーは,約160年前にフランスで報告された原因不明の過眠症である.日中の著しい眠気が最も基本的な症状であるが,それ以外にも笑う,喜ぶなどの情動刺激で惹起される全身の脱力(カタプレキシーあるいは情動脱力発作),入眠時幻覚,睡眠麻痺を呈し,これらはナルコレプシーの四徴と呼ばれる35)40).過眠症は種々の原因で生じ,その鑑別は容易ではないが,ナルコレプシーの過眠では,短い仮眠をとると覚醒時に眠気が軽減する,睡眠発作の最中でも覚醒させることが容易であるといった特徴がある35)40).ナルコレプシーの原因・病態生理は近年まで不明であり,解離性障害でもみられるような情動刺激による全身の脱力も生じるため,心因性と疑われた時期もあり,長らく精神疾患に分類されていた.
I.レム睡眠の発見とナルコレプシーの病態
ナルコレプシー研究の転機となったのは,1950年代のレム睡眠の発見である5)11).睡眠は覚醒中に蓄積する眠気(睡眠圧)の放出と,体に休息を与えることが目的の受動的な意識状態で,感覚遮断,例えば,部屋を暗く,無音状態にすると自然に入眠すると考えられており,睡眠研究は自然科学の研究対象として魅力に乏しかった.
1940年代に米国の生理学者のMoruzzi, G. とMagoun, H. W. が,動物を用いた実験により,知覚の入力の切断などを行っても動物は自然に入眠することがなく,むしろ脳幹部を破壊することにより睡眠に似た状態を引き起こすことを観察した.彼らは,睡眠・覚醒は脳の自発的な活動により引き起こされ,覚醒維持には脳幹を中心とする脳部位の神経活動が必須で,その神経活動の減弱により睡眠が誘発される,すなわち上行性網様体賦活系の概念を提唱した32)33).
1950年代にはレム睡眠が発見された.脳波が高振幅徐波を示す睡眠(徐波睡眠)とは別の睡眠ステージがあり,レム睡眠中には大脳皮質が覚醒時と同様に活性化(非同期速波)され,夢を見ていることが多いということが報告され,当時とすれば衝撃的な発見であり11),この発見を契機に,多くの神経科学者が睡眠を研究対象に選ぶようになった.これがいわゆる近代睡眠研究の幕開けである.
レム睡眠の発見自体は生理現象の発見であり,レム睡眠と同様の現象を東京大学のTokizane, T.,フランス・リヨンのJouvet, M. らがほぼ同時期に報告している22)53).米国でのレム睡眠の最初の報告は,シカゴ大学の生理学教室教授Kleitman, N. と当時大学院生であったAserinsky, E. の2名の論文によるものであるが5),当時シカゴ大学の学生であったDementもレム睡眠の発見に立ち会い,その後10数年にわたり精力的にヒトと動物でレム睡眠の生理学的意義の研究に没頭したので11),今日の米国では,レム睡眠の発見をKleitman,Aserinsky,Dementの3人の業績として捉えられることが多い.
レム睡眠の発見を契機に,就寝中,終夜のポリグラフが行われるようになり,ナルコレプシーにおいても,その病態生理の理解に役立つ所見が得られた.すなわち,通常では入眠後90~100分して現れるレム睡眠が,ナルコレプシー患者では入眠直後に出現することが多い.この所見はsleep onset REM period(SOREMP)と呼ばれ,異常所見と考えられている45).レム睡眠時には,生理的に抗重力筋が麻痺をしており,例えば走っているような夢見体験があった際,大脳皮質の運動野では錐体路細胞(pyramidal tract neuron)が盛んに活動していると思われるが,橋の背側部より強い抑制がかかり,夢見体験に応じて体は動くことがない.ナルコレプシー患者では,日中の反復睡眠検査(Multiple Sleep Latency Test:MSLT)の折にも頻回にSOREMPが出現することから,情動脱力発作,睡眠麻痺,入眠時幻覚は,レム睡眠の要素(夢見体験や筋緊張の低下)が,睡眠とは解離して入眠時(睡眠麻痺,入眠時幻覚)に,極端な場合は覚醒時(カタプレキシー)に出現すると理解され,ナルコレプシーは,レム睡眠の異常を伴う原発性過眠症(中枢神経に一時的な原因がある過眠症)と位置づけられた35)40).ただ当時においてもナルコレプシーの原因はまったく不明で,われわれも含め多くの研究者はナルコレプシーの責任病巣はレム睡眠の発現中枢である脳幹部にあると推測していた.
カタプレキシーを呈する症例がナルコレプシーの典型例(Type 1)であるが,現在の診断基準では,カタプレキシーのない患者でも,レム睡眠の異常,すなわちMSLTで,2回以上のSOREMPが認められた場合もナルコレプシーの診断(Type 2)が下される3).
II.ナルコレプシーでのHLAとの関連と自己免疫
ナルコレプシーの病態に関して,日本人がなした重要な発見がある.東京大学のJuji, T. とHonda, Y. らが,1984年にナルコレプシー患者の白血球の抗原型(human leukocyte antigen:HLA)を調べ,HLAクラスII,HLA DRと非常に高い関連があるということを報告した19).この発見は,即日全世界で報じられた.この血清学的なHLA多型は,その後遺伝子レベルでも確認され,HLA-DQB1*0602/DQA*0102との関連が判明し,第6染色体に位置するHLA領域にHLA以外の候補遺伝子があるのではなく,HLAそのものがナルコレプシーの発症に関与していることが明らかになった29).すなわち,抗原提示細胞であるHLAがT細胞に抗原を提示することにより,免疫反応が惹起され,ナルコレプシーを発症する可能性が示されたのである.
HLAを含む免疫応答遺伝子はスタンフォード大学のMcDevitt, H. O. とハーバード大学のBenacerraf, B. らにより1960年代に発見されたが,ナルコレプシーとHLAの関連のニュースを聞いたMcDevittは,Dementに電話をかけ,「ナルコレプシーの原因は解明された」と興奮気味に伝えたとのことである.しかし皮肉なことに,30年以上経った現在でもその原因は完全には解明されていない.ナルコレプシーが自己免疫疾患であることはほぼ間違いないが,果たして抗原が何であるかに関しても紆余曲折があり,現在でも確定されたわけではない7)13)26).また後述のように,ヒト・ナルコレプシーではオレキシン神経細胞が後天的に脱落することを2000年にわれわれが見出したが,神経脱落に自己免疫がどのようにかかわっているかもいまだ解明されていない.
III.ナルコレプシーの病態・病因解明―オレキシン神経伝達欠如による,覚醒維持障害とレム睡眠の異常―
このナルコレプシーの病態・病因の解明に貢献したのが,スタンフォード大学で飼育繁殖されていた前述の家族性ナルコレプシー犬である.ヒトのナルコレプシーは有病率が約0.05%の疾患で,思春期に発症することが多く,その95%が孤発例である.家族性(約5%)に発症することもあるが,ヒトではその遺伝形式は判然としない場合が多い35).1970年初期にDementが地域の神経学会でナルコレプシーの講義を行ったとき,聴衆の一人が,ヒトでのカタプレキシーとよく似た脱力発作を示すイヌがいることをDementに伝えた.最初に見つかったナルコレプシー犬は,ミニチュアプードルなどの小型犬で,他の小型犬でも同様の発作を示す症例が見つかったので,Dementはこれらナルコレプシー犬の交配を行った38).しかし両親がともに発症しているイヌを掛け合わせても,発作を示す子イヌは生まれなかった.またこの子どもと,ナルコレプシーを発症している親とを掛け合わせ,戻し交配も行ったが,それでも発作を示すイヌは認めらなかった.すなわち,これらのイヌのナルコレプシーでは,浸透率の高い単一遺伝子による遺伝性疾患の可能性は否定された38).ところが,1976年にドーベルマンとラブラドールで常染色劣性遺伝する家族性ナルコレプシー犬が見つかり,これらのイヌも直ちにスタンフォード大学に移送し飼育繁殖された35)38).これらの家族性ナルコレプシー犬では,単一遺伝子の変異で,情動脱力発作とともに傾眠傾向,睡眠・覚醒の分断化,レム潜時の短縮がみられた.すなわち,ヒトのナルコレプシーの表現型がすべて発現していた.また,2対の遺伝子が変異(ホモ接合型)をもつイヌは,ほぼ100%ナルコレプシーを発症した(100%の浸透率).
著者がスタンフォード大学に留学した翌年の1988年より,1986年からスタンフォード大学に留学していたフランスの精神科医で精神薬理の学位をもつMignot, E. が中心となり,米国国立衛生研究所の研究資金を獲得し,このイヌのナルコレプシー遺伝子を同定するプロジェクトが始まった.遺伝子の連鎖研究・ポジショナルクローニングは地道な作業で,足かけ10年の歳月を経て,1999年に,ついにこの遺伝子が同定された.ナルコレプシーのドーベルマンとラブラドールでは,オレキシンの受容体に変異(受容体2のnull mutation)があり,オレキシンの神経伝達が行われないことによりナルコレプシーを発症することが明らかになった27).これらの仕事は,裏方も含めての壮大なチームワークの結果で,10年にわたり延べ40人近くの研究者,実験助手の継続する努力の賜物であった.
オレキシン(ハイポクレチン)は睡眠や摂食にかかわる神経ペプチドで,1998年に異なる2つのグループにより個別に発見された.テキサス大学サウスウェスタンメディカルセンターのSakurai, T.,Yanagisawa, M. らはオレキシン48),サンディエゴのスクリプス研究所のde Lecea, L.,Sutcliffe, J. G. らはハイポクレチンと命名した10).現在でもオレキシン・ハイポクレチンの名称は両方とも使用されているが,日本ではオレキシンと呼称されることが多いため,本稿ではオレキシンの名称を使用する.オレキシン神経細胞は視床下部に存在する.
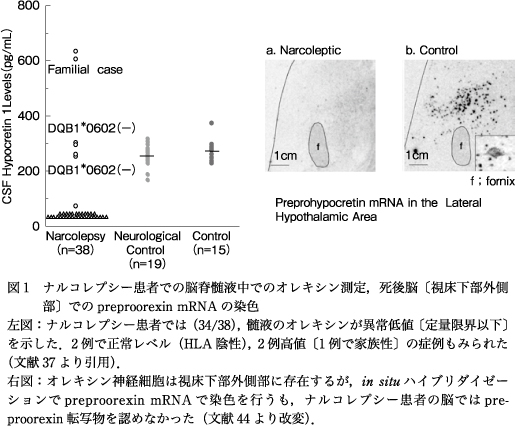
イヌでの遺伝の発見と時を同じくして,オレキシンの発見者であるYanagisawaらのグループが,オレキシンを産生できないマウス(プレプロオレキシンノックアウトマウス)を作製し,それらのマウスがナルコレプシーを発症することを報告した6).さらに,われわれはその翌年の2000年に,ヒト・ナルコレプシーでは,視床下部外側部に存在するオレキシン神経細胞が選択的に脱落していることにより,オレキシンが産生できないことを見出した(図1)36)44).オレキシンは覚醒の維持にかかわりレム睡眠を抑制する.オレキシン欠乏によるオレキシンの神経伝達の障害が,ナルコレプシーの過眠やカタプレキシーなどのレム睡眠関連症状を引き起こすと考えられる.一方,臨床的には髄液での定量でオレキシン欠乏を判定できることも見出し30)36)37),髄液での定量によるオレキシン欠乏はナルコレプシーの2007年国際診断基準(ICSD-2)に陽性診断として採用された2).さらには2014年改訂の国際診断基準(ICSD-3)では,過眠症状に加えカタプレキシーあるいはオレキシン欠乏の認められるナルコレプシーをType 1,オレキシン欠乏もカタプレキシーも認められないが,反復睡眠検査でSOREMPが4回中2回以上出現する症例をType 2と定義し,オレキシン欠乏性ナルコレプシー(Type 1)は疾患単位として確立するに至った3).
ナルコレプシーではすべての症状が一度に出現しないことが多く,発症から数年たって初めて確定診断が下される症例も多い.ナルコレプシーは勉学や社会的インタラクションの重要な思春期に好発するため,診断,治療の遅れは深刻な問題であった.そのため髄液のオレキシン測定によりナルコレプシー陽性診断が可能になったことの恩恵は大きい.またヒトでは家族性のイヌとは異なり,受容体の機能の消失ではなくリガンド(オレキシンペプチド)の欠乏なので,リガンドの補充療法に期待できる.オレキシンペプチドは分子量が大きく,全身投与しても血液脳関門を通過できず脳に移行しないため低分子の受容体刺激薬の開発が急務であるが,補充療法が有効であれば,将来的にはiPS細胞などを用いてオレキシン産生細胞の移植療法などで根治できる可能性もある51).
IV.von Economoの嗜眠性脳炎と自己免疫性脳炎
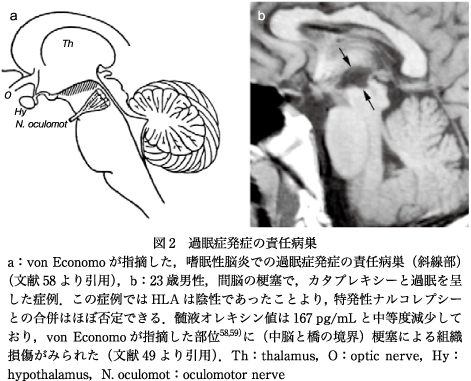
ナルコレプシーの病態・病因を考えるうえで,脳病理学者が行った1900年初期の重要な報告がある.ウィーンの病理学者であった,von Economo, C. は,第一次世界大戦の頃にヨーロッパで流行したインフルエンザ(俗にスペインかぜと呼ばれる)に伴って発症した嗜眠性脳炎(いわゆる症候性過眠症)で多くの死者が出た際,その詳細な病理解剖所見をシリーズで報告した58)59).von Economoは,視床下部後部に脳炎病変が限局すると過眠症状が出ると報告し,特発性のナルコレプシーにおいても視床下部後部の関与を示唆した.その典型例として,後部視床下部,中脳に脳炎病変があり,動眼神経麻痺を呈する症例を挙げている(図2).また,基底核も障害されることがあり,後遺症としてパーキンソン症候群が認められた症例も多い58)59).
先にvon Economoがナルコレプシーにおいても視床下部後部の関与を示唆したと述べたが,嗜眠性脳炎に関して,興味深い所見がある.嗜眠性脳炎が流行った時期にインフルエンザがヨーロッパで蔓延したので,嗜眠性脳炎はインフルエンザウイルスが脳に侵入し引き起こされた脳炎ではないかとまず考えられた.インフルエンザにかかった患者,主として幼児に,けいれん,意識障害,異常行動などの急速に進行する神経症状がみられ,さらに,血管病変が生じて多臓器不全などで生命予後にもかかわる重篤な疾患をインフルエンザ脳炎・脳症という14).一般的に,脳内に直接ウイルスが浸入して炎症を起こす場合は脳炎,脳内にウイルスが検出されず過剰な免疫反応がみられる場合は脳症(あるいは二次性脳炎)と診断される.脳炎・脳症とも症状は似ているが,より重症な疾患は脳症であると考えられている.インフルエンザ脳症は,A香港型でよくみられるが,A(H1N1)2009やB型でもみられる.ただし,脳内にウイルスの侵入の認められないインフルエンザ脳症においても自己免疫介在性脳炎が引き起こされている可能性が高い.
ヨーロッパで流行した嗜眠性脳炎では多くの患者が命を落とし(500万人が感染し,死者の総数は50万人ともいわれる),病理解剖が行われたので,現在でも死亡した患者の脳や組織が保存されている.脳や肺などの組織でウイルスの検索が行われたが報告所見には相違があり,異論はあるものの,脳ではウイルスの検出頻度は低く,死亡例の多くはいわゆるインフルエンザ脳症と考えたほうがよいという報告が一般的である.すなわち,過眠,神経症状を呈し重篤な転帰をたどる疾患は,インフルエンザ感染で惹起される自己免疫性脳炎の可能性が高い.しかも当時流行したインフルエンザウイルスは,最近再流行し,またそのワクチン接種でナルコレプシーの発症が増加したインフルエンザウイルスと同型のH1N1であったとことも判明している28).
V.H1N1ブタインフルエンザワクチン接種によるナルコレプシー発症
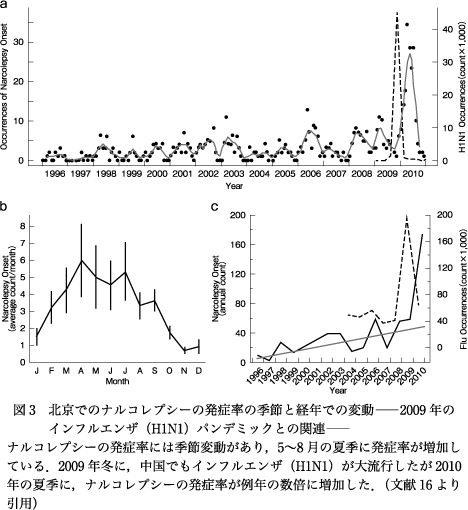
2010年にヨーロッパやカナダで小児を脅かすような出来事が起こった.2009年に北米で始まった新型/ブタ由来H1N1インフルエンザウイルスのパンデミックの最中,インフルエンザのワクチンがナルコレプシーを誘発しているのではないかという疑惑が持ち上がった.ヨーロッパとカナダでインフルエンザワクチン(GlaxoSmithKlineによるPandemrix)の予防接種を受けた子どもで,ナルコレプシーの発症率が数倍にも増えたのである41)43)55).患者は情動脱力発作などの典型的な症状を呈し,HLA陽性で,髄液のオレキシンも異常低値を示した.すなわち,特発性のナルコレプシーと区別できないナルコレプシーがインフルエンザワクチン接種で引き起こされたのだ43)55).さらには,中国でインフルエンザワクチンを接種されていない地域においてナルコレプシーの発症に季節差があり,発症が5~9月の夏季に多くみられた16).また中国でも2009年冬にはブタインフルエンザが流行したが,その翌年の2010年夏季にはナルコレプシーの発症率が前年の4倍程度に増加したことも報告された(図3)16).したがって,この時期に発症率が増加したナルコレプシーはワクチン摂取のみならず,インフルエンザウイルスそのものが自己免疫反応を引き起こし,脳に存在するオレキシン神経細胞を選択的に脱落させた可能性が高く,その発症機序は特発性ナルコレプシーの発症機序と重複すると考えられた.
一方,米国ではワクチン接種でナルコレプシーの発症増加は認められなかったことより,インフルエンザワクチン接種後のナルコレプシー発症は,ヨーロッパ,カナダで用いられたPandemrixのアジュバントの種類が免疫反応をブーストした可能性が指摘された41).ちなみに日本で用いられたワクチンにはアジュバントは使用されておらず,わが国ではワクチン接種後のナルコレプシー発症も散発的で,例年に比べ発症率が増加したというエビデンスはない.ワクチンにも存在するインフルエンザウイルスの構成蛋白が脳組織,特にオレキシン神経細胞に交差耐性を示し,自己免疫性の脳炎(ここでは選択的な神経脱落)が引き起こされた可能性が高い.またこの反応は特定のアジュバントで促進された可能性が高い.
VI.症候性ナルコレプシーとオレキシン欠乏
神経疾患に併発してナルコレプシーが発症することがあり“症候性ナルコレプシー”と呼ばれる.われわれが行った過去40年における報告例のメタアナリシスにおいても,百数十症例認められるのみで,その数は決して多くない39).神経疾患に併発する過眠症で,カタプレキシーやレム睡眠の異常を示さない症例,すなわち“症候性過眠症”の存在も古くから指摘されている.こういった症候性過眠症は,症候性ナルコレプシーに比較し非常に頻度が高い可能性がある.例えば,米国に数百万人存在するといわれる慢性の頭部外傷患者の約75%で睡眠障害が認められ,その半数が不眠症,残り半数が過眠症であるという報告もある56).救命医療の進歩により交通事故や戦争における受傷者の救命率が上がり,このような症例が近年増加している可能性もある.このような症候性過眠症の多くでも,後述のようにオレキシン欠乏が関与している可能性も高い.
カタプレキシーやレム睡眠の異常が認められた症候性ナルコレプシーの基礎疾患は,筋強直性ジストロフィーやプラダー―ウィリー症候群などの遺伝性疾患,脳出血,脳梗塞など脳血管障害,脳腫瘍,脱髄性疾患,変性疾患,白血病性脳症などで,こういった疾患に伴う症候性ナルコレプシーでは中等度から重度の髄液オレキシン値の低下がみられることが多い39).なかでも非常に興味深い症例として,23歳男性,間脳の梗塞で,カタプレキシーと過眠を呈したケースがある49).この症例においてHLAは陰性であったことより,特発性ナルコレプシーとの合併はほぼ否定できる.この症例では,オレキシンが167 pg/mLと中等度減少しており,中脳と橋の境界に梗塞による組織損傷がみられた.まさにvon Economoが過眠に関与する責任病巣であると報告した視床下部後部の部位である(図2)49).この症例ではオレキシンの減少は中程度だが(オレキシン神経細胞の局在は損傷部位の吻側部に位置する),この脳部位の損傷では,オレキシン神経細胞の下行投射が広範に障害されると考えられ,オレキシンの神経伝達が重度に障害されたと考えられる.
1900年初頭の嗜眠性脳炎の流行以降,同様の脳炎の流行は報告されていないが,嗜眠性脳炎の症状に近い症例のケースレポートは時折みられる.本邦でもYoshikawa, S. らが,発熱の後,けいれんが生じ,その後,過眠が発症した7歳のacute disseminated encephalomyelitis(ADEM)の症例を報告したが,経過中,動眼神経麻痺も出現し,臨床症状はvon Economoの嗜眠性脳炎に近いと思われる61).CTでは,両側視床下部,基底核,大脳皮質に散在する病巣がみられた.この症例では髄液オレキシン値が146 pg/mLと低下していた.ADEMで過眠を認め,オレキシン低値を示したケースは久保田ら25)をはじめ,他に4症例報告されている39).
VII.視神経脊髄炎(NMO)とオレキシン欠乏性過眠症
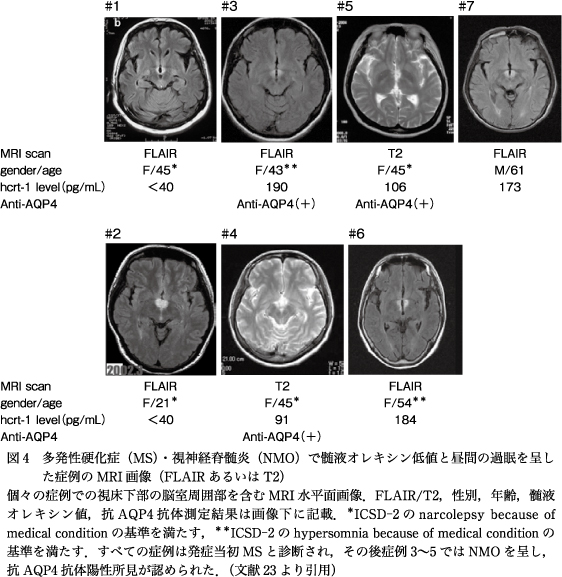
われわれの症候性ナルコレプシーのメタアナリシスで脱髄疾患のうち,多発性硬化症(multiple sclerosis:MS)の症例が10例認められた.これらは約30年前の古いケースで,全例でカタプレキシーも認められた.一方,近年発症のMSでのナルコレプシー・カタプレキシーの報告はない.これに関して,2009年,Kanbayashi, T. らは,MSとナルコレプシーに関して興味深い論文を発表した.過眠症を呈し発症当初MSと診断された7例の症例が,髄液オレキシン検査の目的で秋田大学に紹介された.過眠症を呈した症例では,MRI画像で第3脳室周辺に両側性の円形病巣を呈し,髄液のオレキシン低値を示した23)(図4).発症当初はすべての症例がMSと診断されたが,症例3~5では,その後,視神経脊髄炎(neuromyelitis optica:NMO)の症状を呈し,抗AQP(アクアポリン)4抗体陽性所見が認められた.AQP4はアストロサイトに存在する水チャンネルで,NMOはAQP4を標的抗原とする中枢神経の炎症性自己免疫疾患である.特異的な診断バイオマーカー抗AQP4抗体の発見により,古典的症候である視神経炎と脊髄炎をもつ確実例にとどまらず,両者の症候がそろわず空間的に限局した症例や,他の中枢神経病変をもつ症例“NMO spectrum disorders(NMOSD)”の診断が可能となった60).
Kanbayashiらの症例では,カタプレキシーは全例で認められなかったが,4例で髄液オレキシンの異常低値が認められ,このうちMSLTを行った2例でSOREMPも認められ,症候性ナルコレプシーの診断が下された.ナルコレプシーの基準を満たさない他の3例のうち,1例はステロイドパルス療法により過眠症状が3ヵ月以内に改善し髄液オレキシン値も正常に戻ったので,この症例以外の2例がhypersomnia because of medical conditionの基準(3ヵ月以上持続する過眠が必須)を満たした23).他の症例もステロイドに対する反応がよく,比較的短期に過眠症状が消失した.7例中3例で抗AQP4抗体が陽性であったが,すべての症例で病相期に血液が採取できていたわけではないので,陽性率はより高率である可能性もある.
これらの症例は,非常にユニークな臨床症状と画像所見を示し,NMOでオレキシン低値と過眠を呈する新しい症候群であるといえるが23),すべてのNMOで過眠症状や第3脳室周辺の病巣を示すわけではないので,その発生機序を突き止めることは睡眠医学,神経学的に意義があると思われる.約30年前の症例でカタプレキシーを示したMSの症例のことを先に述べたが,こういったMS/NMOの症例で免疫療法を行わない場合,不可逆なオレキシン神経細胞損傷を引き起こし,経過中に,カタプレキシーが生じた可能性もあり,近年のMRI/CTを用いての迅速な診断や,免疫療法の確立が,カタプレキシー症例がみられない理由かもしれない.われわれのNMOの症例のように,免疫療法により,過眠が3ヵ月以内に改善するケースもみられるので,現在の過眠症の国際診断基準の改訂も考慮する必要がある3).
VIII.Ma2抗体陽性傍腫瘍性神経症候群と症候性過眠症
フィラデルフィア大学のDalmau, J. らは,以前より,精巣腫瘍や肺がんなどに伴って発症する傍腫瘍性神経症候群(paraneoplastic neurological syndrome:PNS)で発癌遺伝子である抗Ma2抗体が陽性の症例に,過眠が出現することを報告していた47).自己免疫性脳炎は,その病態に自己免疫学的な機序が介在する脳炎・脳症であるが,時に腫瘍を合併し(腫瘍随伴性),その遠隔効果,すなわちPNSの一病型として発症することが知られている9).PNSとは,腫瘍に関連する神経筋障害のうち,腫瘍の直接浸潤や転移,栄養・代謝・凝固障害,化学療法や放射線治療の副作用,日和見感染によらず,免疫介在性の機序によるものをいう.傍腫瘍性免疫介在性の病態としては,神経抗原を異所性に発現した腫瘍に対する液性免疫反応(自己抗体)と細胞性免疫反応(細胞傷害性T細胞)が自己の神経組織を傷害するという仮説が一般的である.
われわれは,Dalmauより抗Ma2抗体陽性のPNSの症例で,脳脊髄液の提供を受けて,オレキシンの測定を行った.患者の総数は6例で,そのうち4例で過眠症状を呈していたが,驚くことに,過眠症状のみられた4例すべてで髄液オレキシン値が定量限界まで低下していた42)(表1).測定はもちろん症状を伏せて行ったので,実際に測定したわれわれも,髄液を送付したDalmauらも,この結果に非常に驚いた.ちなみに,偶然ですべての過眠症の患者を言いあてる確率は64分の1である.これらの症例では剖検が行われていないので,脳組織でオレキシン神経細胞が脱落しているかどうかは不明であるが,髄液オレキシン低値はオレキシン神経細胞の傷害によるオレキシンの産生障害を反映し,オレキシンの伝達障害が過眠を引き起こしたと考えられる.これらの症例では,終夜ポリグラフは施行されておらず,過眠に加えてレム睡眠の異常が認められたかは不明であるが42),前述のNMOの症例でも一部でレム睡眠の異常が認められたので,症候性ナルコレプシーの症例が含まれている可能性もある.
その後,71歳男性46),55歳男性の症例でナルコレプシー(過眠とSOREMP)とレム睡眠行動障害(RBD)1)を呈した抗Ma2抗体関連辺縁系脳炎の症例報告があるが,いずれもカタプレキシーは認められなかった.
ところが,秋田大学の今西,神林らが過眠と抗Ma2抗体関連辺縁系脳炎の症例で,過眠とカタプレキシーで発症し,特発性ナルコレプシーと臨床症状では区別がつかない症候性ナルコレプシーが発症することを報告した21).患者は,52歳男性で,四肢の脱力,日中の眠気,易怒性,体重減少が出現したので精査目的で入院した.MSLTで4回中4回のSOREMPを認め,カタプレキシーを認め,髄液オレキシン低値であり,ナルコレプシーType 1の診断が下された.高齢発症でHLAも陰性であったため症候性ナルコレプシーが疑われ,検査の結果抗Ma2抗体陽性が判明した.その後の全身検索で,精巣に腫瘤(seminoma)を認め精巣摘出術を受けた.術後体重減少は改善したが他の症状は改善をみなかった21).この症例では主治医の洞察により,腫瘍が見つかり,転移前に摘出できた可能性がある.
抗Ma2抗体陽性のPNSは稀な疾患で,日本国内では合計10例の報告があり,5例では過眠が認められるも精査はされていない25).なぜこの疾患で,オレキシン欠乏を示す過眠症が高率に認められるのか,その機序は依然として不明であるが,精巣腫瘍が原疾患のことが多く,神経組織に発達する外胚葉性の組織に対する抗体も生じ,神経系の組織,特にオレキシン神経細胞やその周辺の組織と交差反応を起こした可能性がある.
IX.抗NMDAR脳炎における統合失調様症状
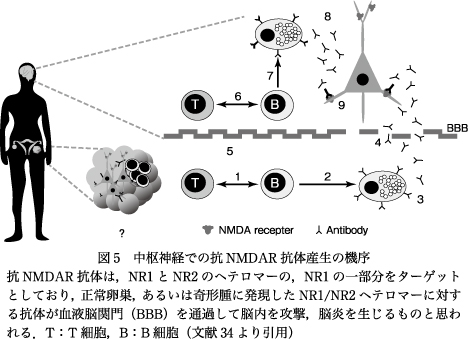
われわれはPNSに伴う自己免疫性脳炎での症候性過眠症に注目し,Dalmauらと共同研究を行ったが,Dalmauらの一連の自己免疫性脳炎の研究が,後に統合失調症の研究にも発展するとは当時は夢想だにしなかった.2005年,Dalmauらの研究グループは,精神症状,けいれん,記憶障害,遷延性意識障害,中枢性低換気を特徴とする急性脳炎を発症し,卵巣奇形腫を合併していた若年女性4例の血液および髄液中に新規の神経細胞膜抗原に対する抗体が存在することを報告した57).さらに2007年,Dalmauらはその抗体の認識部位は細胞膜上に発現しているNR1/NR2ヘテロマー上に存在する細胞外立体的エピトープであることを示し,抗N-methyl-D-aspartate受容体(NMDAR)脳炎の名称で12例の症例を報告した8).抗NMDAR脳炎は,卵巣奇形腫関連傍腫瘍性脳炎であり,NMDARのNR1/NR2ヘテロマーに対する抗NMDAR抗体を介して生じる自己免疫性脳炎である8)20)34)(図5).
患者100例を検討した報告によると,そのうち91例が女性であり,平均年齢は23歳(5~76歳の範囲)であった52).腫瘍学的スクリーニングを受けた98例の患者のうち58例は腫瘍をもっており,主に卵巣奇形腫であった.
抗NMDAR脳炎では急性精神病様の多彩な精神症状も出現するので,統合失調症の患者でも抗NMDAR抗体の陽性率が調べられたが,0~6.5%と初期の研究では結果は一致しなかった12)18).
2012年には,Tsutsui, K.,Kanbayashiらは本邦で初めて,急性発症の統合失調様症状を呈する患者で抗NMDAR抗体陽性例を報告し,わが国でも精神科領域で話題になった54).彼らは,合計10例の抗NMDAR脳炎を経験したが,臨床症状をもとに3群に分類した.3例は比較的典型的な抗NMDAR脳炎の経過をたどり,免疫療法が奏効した.典型例ではけいれん発作や意識レベルの低下,自律神経症状や呼吸不全などを生じて,神経内科やICUに転科となり強力な免疫療法を施行され改善に至ることが多い.他の7例のうち3例はオレキシン欠損型のナルコレプシーに難治性の精神症状を合併しており,抗精神病薬を使用されていた.興味深いことに,残り4例(51例の統合失調症の患者中4例で抗NMDAR抗体陽性7.8%)に関しては,身体症状はほとんど目立たず,ほぼ精神症状のみを呈しており,急性発症の興奮や妄想様の言動を認め,昏迷を呈することもあった.そのため,その多くは急性精神病とみなされていた.非定型あるいは薬剤抵抗性の統合失調症と診断され,m-ECTが奏効した症例も含まれる.女性の症例で卵巣奇形腫を伴う例もあり,奇形腫の切除による精神症状の軽快例もみられた54).この報告は精神科臨床の立場から考察されており,非常に興味深い.すなわち,統合失調症の一部の症例にみられる,急性発症の精神錯乱を呈す症例の発症に,自己抗体介在型の自己免疫性脳炎が関与する可能性を指摘したのである.さらには,抗NMDAR脳炎により,オレキシン神経系の障害も引き起こされ,精神症状を伴った症候性ナルコレプシーの発症に関与する可能性も示唆される54).その後,わが国でも,Ando, Y. らは初発および再燃の急性精神病の59例中で6例(10.2%)が抗NMDAR抗体陽性であったと報告している4).
筒井,神林らはさらに症例を増やし病像に関する検討を加え,緊張型では14例中で6例,緊張病型以外では,いわゆる非定型精神病の概念にあてはまる症例が多く,135例中の10例で抗NMDAR抗体が陽性であった24).ただし,前述のAndoらの報告では病像との相関は判然としなかった4).
欧米では,Zandi, M. S.62)らとSteiner, J.50)らも多数例での検討を行い,統合失調症の患者のうちの6.6~9.9%で抗NMDAR抗体が陽性であることを報告している.ただ注意が必要なのは,抗体陽性が統合失調症患者に特異性があるかという点で,健常者での陽性率が統合失調症群と同等に高いという報告も多い15)50).
しかしながら,典型例では,やはり抗NMDAR脳炎による自己免疫性脳炎で,主として精神症状のみが存在し,しかも抗NMDAR脳炎による自己免疫性脳炎が急性精神症状の原因であると判断せざるを得ない症例が存在することは事実で54),今後疾患特異性に関してさらに検討を加える必要があると思われる.また,精神症状の発症機序に検討を加えることも重要である.
奇形腫には外胚葉由来の組織も含まれるため,外胚葉由来の腫瘍抗原の提示により中枢神経に対する抗体が生じ,自己免疫性脳症が引き起こされ,多彩な精神症状を呈したと考えられる.しかし,卵巣腫瘍を認めない症例での陽性例や男性での陽性例も認められるので,NMDARの抗原性が強い可能性もある.また正常卵巣にもNMDARが発現していると報告されている.一方,統合失調症の精神症状は,NMDAR機能低下説で説明されることもあり,NMDAR機能が抗体により抑制されることにより,グルタミン酸作動性ニューロンやドパミン作動性ニューロンの脱抑制状態が惹起されるのではないかと推測されている20).
急性精神病患者に抗NMDAR脳炎の特徴がみられた場合には,積極的に腫瘍性疾患の検査や,本疾患の抗体価の測定を行い,免疫療法の施行も考慮することが本疾患の診断,治療および臨床研究に寄与するものであると考えられる.一般に脳炎にm-ECTは相対的禁忌であるが,m-ECTが有効であったケースも報告されている54).しかしその機序は不明である.一方,抗精神病薬の治療では,鎮静効果はあるが,精神症状への有効性は不十分と考えられる.
おわりに
抗NMDAR脳炎の疾患概念は最近確立されたものであるが,疾患自体は古来より存在したと思われる.悪性緊張病や非定型精神病に含まれたであろう.かつて致死性緊張病として不幸な転帰をたどった症例のなかには本脳炎が含まれていた可能性もある.ここでは特に満田久敏の非定型精神病について言及したい.
大阪医科大学の初代精神科教授であった満田は,急性一過性に情動障害や活発な病的体験を伴った錯乱や昏迷状態,意識変容状態など多彩な症状を示し,時には死に至ることもある,典型的な統合失調症とは異なる症状や経過をたどる非定型群を見出した17)31).発病が急激であり,多くは位相性ないしは周期性の経過を示し予後はよい.妄想も浮動的,非系統的でいずれも人格とは異質的なものが多い.比較的若い女性に多く,発病に際して,精神的あるいは身体的動機が認められることが多く脳波異常を認める頻度が高い.m-ECTの有効性は比較的高い.非定型精神病は概して予後はよいが,なかには器質疾患を思わせる欠陥状態におちいる患者もいる(表2には満田の定義に,著者が入局した頃,当時大阪医科大学精神科医局で提唱されていた特徴も加えた).
それらの患者群を典型的な統合失調症の症状を示す定型群と比較したところ,非定型群の家族内負因として統合失調症のほかに双極性障害とてんかんがみられたのに対し,定型群では家族歴に双極性障害とてんかんがほとんどみられなかった.そのことから,定型群と非定型群は遺伝学的に異種の疾患であるとし,非定型群を統合失調症から分離した.そして,新たな疾患概念として非定型精神病を提唱した(表2).ただし,この概念は,DSM-IIIが出版され,英語でのatypicalという言葉が災いして,くずかご的な呼称となり,DSM-IV,DSM-5ではatypical psychosisそのものが診断カテゴリーから消失した.
統合失調症には当然異種性が存在し,その原因が多数存在しても不思議ではない.特有の症状を呈し,一定の経過や予後を示す症例を精神科領域では疾患とみなすが,かならずしも単一の疾患(疾患単位)を意味するものではない.もちろん非定型精神病にも異種性は存在する.満田が提唱した,非定型精神病の症例の一部に抗NMDAR脳炎の症例が含まれていても不思議ではないと思われる.満田は,統合失調症は脳の疾患であるが非定型精神病は身体に原因のある疾患だとも述べており31),抗NMDAR脳炎が卵巣奇形腫に由来する抗体が原因である場合が多いことを考えると,その本態を見抜いていたことになる.
著者が駆け出しの精神科医であった頃,生物学的精神医学が隆興し,私もその流れに押され,生物学的精神医学に興味を持ち出した.ドイツのグリージンガーの「精神病は脳の病である」ではないが,いわゆる原因不明の内因性精神病のなかに,器質的原因が見つかるものもあると信じてやまなかった.その後,米国に渡り睡眠研究に没頭することになったのであるが,再びこの命題に戻ることができたのは,運命でもあり,幸運なことだと感じている.渡米前,われわれ若手の研究者の間でも,統合失調症の中核群の器質的な要因を同定することは容易ではないと考えられていた.ただ辺縁群で,医学の進歩により,明確な器質的な機序が見つかるものもあるはずで,大きな塊の薄皮を一枚一枚剝がすように辺縁群を取り除いていき,中核群に迫る必要がある.今振り返ると,抗NMDAR脳炎の発見により大きな薄皮が剝がれたようにも思える.詳細な発症機序は不明でも,診断や治療が可能になったのだ.
第114回日本精神神経学会学術総会=会期:2018年6月21~23日,会場=神戸国際会議場,神戸国際展示場,神戸ポートピアホテル
総会基本テーマ:精神医学・医療の普遍性と独自性―医学・医療の変革のなかで―
特別講演:精神科領域における自己免疫性脳炎の今昔 座長:松村 人志(大阪薬科大学)
なお,本論文に関連して開示すべき利益相反はない.
謝 辞 本稿は,第114回日本精神神経学会学術総会での特別講演をもとに書き起こしたものである.講演の機会をいただいた,学術総会会長の米田博教授(大阪医科大学精神神経科主任教授)に心より感謝申し上げます.また資料提供と助言をいただいた秋田大学神林崇先生(現・筑波大学教授),意見をいただいた千葉悠平先生(横浜舞岡病院)と小野太輔先生(スタンフォード大学睡眠生体リズム研究所)に深く感謝いたします.
1) Adams, C., McKeon, A., Silber, M. H., et al.: Narcolepsy, REM sleep behavior disorder, and supranuclear gaze palsy associated with Ma1 and Ma2 antibodies and tonsillar carcinoma. Arch Neurol, 68 (4); 521-524, 2011![]()
2) American Academy of Sleep Medicine: ICSD-2-International Classification of Sleep Disorders, 2nd ed, Diagnostic and Coding Manual. American Academy of Sleep Medicine, Westchester, 2005
3) American Academy of Sleep Medicine: International Classification of Sleep Disorders, 3rd ed. American Academy of Sleep Medicine, Rochester, 2014
4) Ando, Y., Shimazaki, H., Shiota, K., et al.: Prevalence of elevated serum anti-N-methyl-D-aspartate receptor antibody titers in patients presenting exclusively with psychiatric symptoms: a comparative follow-up study. BMC Psychiatry, 16; 226, 2016![]()
5) Aserinsky, E., Kleitman, N.: Regularly occuring periods of eye motility, and concomitant phenomena, during sleep. Science, 118 (3062); 273-274, 1953![]()
6) Chemelli, R. M., Willie, J. T., Sinton, C. M., et al.: Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation. Cell, 98 (4); 437-451, 1999![]()
7) Cvetkovic-Lopes, V., Bayer, L., Dorsaz, S., et al.: Elevated Tribbles homolog 2-specific antibody levels in narcolepsy patients. J Clin Invest, 120 (3); 713-719, 2010![]()
8) Dalmau, J., Tüzün, E., Wu, H. Y., et al.: Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Ann Neurol, 61 (1); 25-36, 2007![]()
9) Darnell, R. B., Posner, J. B.: Paraneoplastic syndromes involving the nervous system. N Engl J Med, 349 (16); 1543-1554, 2003![]()
10) de Lecea, L., Kilduff, T. S., Peyron, C., et al.: The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity. Proc Natl Acad Sci U S A, 95 (1); 322-327, 1998![]()
11) Dement, W. C.: History of sleep medicine. Neurol Clin, 23 (4); 945-965, v, 2005![]()
12) Eastwood, M. A., Mitchell, W. D., Pritchard, J. L.: The effect of bran on the excretion of faecal cations [proceedings]. Proc Nutr Soc, 35 (2); 78-79A, 1976![]()
13) Giannoccaro, M. P., Waters, P., Pizza, F., et al.: Antibodies against hypocretin receptor 2 are rare in narcolepsy. Sleep, 40 (2); 2017 doi: 10.1093/sleep/zsw056.![]()
14) Gu, Y., Shimada, T., Yasui, Y., et al.: National surveillance of influenza-associated encephalopathy in Japan over six years, before and during the 2009-2010 influenza pandemic. PLoS One, 8 (1); e54786, 2013![]()
15) Hammer, C., Stepniak, B., Schneider, A., et al.: Neuropsychiatric disease relevance of circulating anti-NMDA receptor autoantibodies depends on blood-brain barrier integrity. Mol Psychiatry, 19 (10); 1143-1149, 2014![]()
16) Han, F., Lin, L., Warby, S. C., et al.: Narcolepsy onset is seasonal and increased following the 2009 H1N1 pandemic in China. Ann Neurol, 70 (3); 410-417, 2011![]()
17) Hatotani, N.: The concept of 'atypical psychoses' : special reference to its development in Japan. Psychiatry Clin Neurosci, 50 (1); 1-10, 1996![]()
18) Haussleiter, I. S., Emons, B., Schaub, M., et al.: Investigation of antibodies against synaptic proteins in a cross-sectional cohort of psychotic patients. Schizophr Res, 140 (1-3); 258-259, 2012![]()
19) Honda, Y., Doi, Y., Juji, T., et al.: Narcolepsy and HLA: positive DR2 as a prerequisite for the development of narcolepsy. Folia Psychiatr Neurol Jpn, 38; 360, 1984
20) 飯塚高浩, 坂井文彦: 抗NMDA受容体脳炎―臨床徴候とその病態生理―. BRAIN and NERVE, 60 (9); 1047-1060, 2008
21) 今西 彩, 成田恵理子, 池田祐介ほか: 抗Ma2抗体陽性であり, 精巣腫瘍を認めた症候性ナルコレプシー患者の一例. 睡眠医療, 12 (1); 85-89, 2018
22) Jouvet, M.: The paradoxical phase of sleep. Int J Neurol, 5 (2); 131-150, 1965![]()
23) Kanbayashi, T., Shimohata, T., Nakashima, I., et al.: Symptomatic narcolepsy in patients with neuromyelitis optica and multiple sclerosis: new neurochemical and immunological implications. Arch Neurol, 66 (12); 1563-1566, 2009![]()
24) 神林 崇, 清水徹男, 筒井 幸ほか: 精神科におけるanti-NMDAR脳炎: 悪性緊張病と非定型精神病と電気治療. 臨床神経学, 54 (12); 1103-1106, 2014
25) 久保田昭洋, 田島孝士, 成川真也ほか: 短期記憶障害を呈し抗Ma2抗体, 抗NMDAR抗体, 抗GluRε2抗体陽性で, 後に精巣腫瘍をみとめた傍腫瘍性辺縁系脳炎の1例. 臨床神経学, 52 (9); 666-671, 2012
26) Latorre, D., Kallweit, U., Armentani, E., et al.: T cells in patients with narcolepsy target self-antigens of hypocretin neurons. Nature, 562 (7725); 63-68, 2018![]()
27) Lin, L., Faraco, J., Li, R., et al.: The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin(orexin)receptor 2 gene. Cell, 98 (3); 365-376, 1999![]()
28) McCall, S., Vilensky, J. A., Gilman, S., et al.: The relationship between encephalitis lethargica and influenza: a critical analysis. J Neurovirol, 14 (3); 177-185, 2008![]()
29) Mignot, E., Hayduk, R., Black, J., et al.: HLA DQB1*0602 is associated with cataplexy in 509 narcoleptic patients. Sleep, 20 (11); 1012-1020, 1997![]()
30) Mignot, E., Lammers, G. J., Ripley, B., et al.: The role of cerebrospinal fluid hypocretin measurement in the diagnosis of narcolepsy and other hypersomnias. Arch Neurol, 59 (10); 1553-1562, 2002![]()
31) 満田久敏: 「非定型精神病の概念と臨床」に対する付議. 精神経誌, 64 (1); 23-26, 1962
32) Moruzzi, G.: The functional significance of the ascending reticular system. Arch Ital Biol, 96; 17-28, 1958
33) Moruzzi, G., Magoun, H. W.: Brain stem reticular formation and activation of the EEG. 1949. J Neuropsychiatry Clin Neurosci, 7 (2); 251-267, 1995![]()
34) Moscato, E. H., Jain, A., Peng, X., et al.: Mechanisms underlying autoimmune synaptic encephalitis leading to disorders of memory, behavior and cognition: insights from molecular, cellular and synaptic studies. Eur J Neurosci, 32 (2); 298-309, 2010![]()
35) Nishino, S., Mignot, E.: Pharmacological aspects of human and canine narcolepsy. Prog Neurobiol, 52 (1); 27-78, 1997![]()
36) Nishino, S., Ripley, B., Overeem, S., et al.: Hypocrexub (orexin) deficiency in human narcolepsy. Lancet, 355 (9197); 39-40, 2000![]()
37) Nishino, S., Ripley, B., Overeem, S., et al.: Low cerebrospinal fluid hypocretin (orexin) and altered energy homeostasis in human narcolepsy. Ann Neurol, 50 (3); 381-388, 2001![]()
38) Nishino, S.: Canine narcolepsy. The Orexin/Hypocretin System, Physiology and Pathophysiology (ed by Nishino, S., Sakurai, T.). Humana Press, Totowa, p.233-253, 2005
39) Nishino, S., Kanbayashi, T.: Symptomatic narcolepsy, cataplexy and hypersomnia, and their implications in the hypothalamic hypocretin/orexin system. Sleep Med Rev, 9 (4); 269-310, 2005![]()
40) Nishino, S.: Clinical and neurobiological aspects of narcolepsy. Sleep Med, 8 (4); 373-399, 2007![]()
41) Nohynek, H., Jokinen, J., Partinen, M., et al.: AS03 adjuvanted AH1N1 vaccine associated with an abrupt increase in the incidence of childhood narcolepsy in Finland. PLoS One, 7 (3); e33536, 2012![]()
42) Overeem, S., Dalmau, J., Bataller, L., et al.: Hypocretin-1 CSF levels in anti-Ma2 associated encephalitis. Neurology, 62 (1); 138-140, 2004![]()
43) Partinen, M., Saarenpää-Heikkilä, O., Ilveskoski, I., et al.: Increased incidence and clinical picture of childhood narcolepsy following the 2009 H1N1 pandemic vaccination campaign in Finland. PLoS One, 7 (3); e33723, 2012![]()
44) Peyron, C., Faraco, J., Rogers, W., et al.: A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains. Nat Med, 6 (9); 991-997, 2000![]()
45) Rechtschaffen, A., Wolpert, E. A., Dement, W. C., et al.: Nocturnal sleep of narcoleptics. Electroencephalogr Clin Neurophysiol, 15; 599-609, 1963![]()
46) Rojas-Marcos, I., Graus, F., Sanz, G., et al.: Hypersomnia as presenting symptom of anti-Ma2-associated encephalitis: case study. Neuro Oncol, 9 (1); 75-77, 2007![]()
47) Rosenfeld, M. R., Eichen, J. G., Wade, D. F., et al.: Molecular and clinical diversity in paraneoplastic immunity to Ma proteins. Ann Neurol, 50 (3); 339-348, 2001![]()
48) Sakurai, T., Amemiya, A., Ishii, M., et al.: Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell, 92 (4); 573-585, 1998![]()
49) Scammell, T. E., Nishino, S., Mignot, E., et al.: Narcolepsy and low CSF orexin (hypocretin) concentration after a diencephalic stroke. Neurology, 56 (12); 1751-1753, 2001![]()
50) Steiner, J., Walter, M., Glanz, W., et al.: Increased prevalence of diverse N-methyl-D-aspartate glutamate receptor antibodies in patients with an initial diagnosis of schizophrenia: specific relevance of IgG NR1a antibodies for distinction from N-methyl-D-aspartate glutamate receptor encephalitis. JAMA Psychiatry, 70 (3); 271-278, 2013![]()
51) Takenoshita, S., Sakai, N., Chiba, Y., et al.: An overview of hypocretin based therapy in narcolepsy. Expert Opin Investig Drugs, 27 (4); 389-406, 2018![]()
52) Titulaer, M. J., McCracken, L., Gabilondo, I., et al.: Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol, 12 (2); 157-165, 2013![]()
53) Tokizane, T.: Studies on the paradoxical phase of sleep in the cat. Prog Brain Res, 21; 230-268, 1966![]()
54) Tsutsui, K., Kanbayashi, T., Tanaka, K., et al.: Anti-NMDA-receptor antibody detected in encephalitis, schizophrenia, and narcolepsy with psychotic features. BMC Psychiatry, 12; 37, 2012![]()
55) Vaarala, O., Vuorela, A., Partinen, M., et al.: Antigenic differences between AS03 adjuvanted influenza A (H1N1) pandemic vaccines: implications for pandemrix-associated narcolepsy risk. PLoS One, 9 (12); e114361, 2014![]()
56) Verma, A., Anand, V., Verma, N. P.: Sleep disorders in chronic traumatic brain injury. J Clin Sleep Med, 3 (4); 357-362, 2007![]()
57) Vitaliani, R., Mason, W., Ances, B., et al.: Paraneoplastic encephalitis, psychiatric symptoms, and hypoventilation in ovarian teratoma. Ann Neurol, 58 (4); 594-604, 2005![]()
58) von Economo, C.: Sleep as a problem of localization. J Nerv Ment Dis, 71 (3); 249-259, 1930
59) von Economo, C.: Encephalitis Lethargica: Its Sequelae and Treatment. Oxford University Press, London, 1931
60) Wingerchuk, D. M., Banwell, B., Bennett, J. L., et al.: International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology, 85 (2); 177-189, 2015![]()
61) Yoshikawa, S., Suzuki, S., Kanbayashi, T., et al.: Hypersomnia and low cerebrospinal fluid hypocretin levels in acute disseminated encephalomyelitis. Pediatr Neurol, 31 (5); 367-370, 2004![]()
62) Zandi, M. S., Irani, S. R., Lang, B., et al.: Disease-relevant autoantibodies in first episode schizophrenia. J Neurol, 258 (4); 686-688, 2011![]()