【目的】近赤外分光法(NIRS)は簡便な脳機能画像法として注目されているが,抑うつ症状と前頭前野所見との関連を縦断的に検討したものは少ない.本研究では,精神科外来に通院するうつ病患者を対象にNIRS測定を縦断的に行い,治療転帰と前頭前野機能の変化との関連を検討することを目的とした.【方法】精神科外来に通院するうつ病患者を対象に,約2ヵ月の間隔を空けた前後の時点(Time 1,Time 2)でNIRS測定,抑うつ症状および心理社会的機能の評価を縦断的に行った.賦活課題には言語流暢性課題を用いた.前頭前野の関心領域を右側部・前頭極部・左側部とし,Time 1で抑うつ状態を呈していた全対象者のうち,Time 2の抑うつ状態の程度により非寛解群,部分寛解群に分け検討した.【結果】非寛解群においてTime 1からTime 2にかけて前頭極部領域における有意な平均賦活量の増加(P<0.05),および左側部領域における平均賦活量の低減の傾向がみられた(P<0.10).一方で,部分寛解群においてはTime 1からTime 2にかけての平均賦活量の有意な変化はみられなかった.さらに,非寛解群においてTime 1からTime 2にかけての抑うつ症状の変化と前頭極部領域における平均賦活量の変化に有意な正の相関(r=0.48,P<0.05),および左側部領域における平均賦活量の変化に有意傾向の負の相関がみられた(r=-0.45,P<0.10).一方で,部分寛解群においてはTime 1からTime 2にかけての抑うつ症状の変化と平均賦活量の変化に有意な相関はみられなかった.【考察】縦断研究の結果,抑うつ症状の遷延に関連する前頭前野機能の変化をNIRS測定により評価できる可能性が示唆された.今後は選別基準を厳格にし,関連変数も統制したうえでより詳細な検討を行うことが求められる.
2)立教大学現代心理学部
3)青山渋谷メディカルクリニック
受理日:2018年11月29日
はじめに
近年,うつ病(以下,大うつ病性障害を指すものとする)対策の必要性が高まってきている.うつ病は自殺リスクを高めることが知られており,自殺およびうつ病による経済的損失は2.7兆円にもなるとされ16),うつ病対策を行うことは社会的要請となっている.
うつ病の適切な治療と対策のためには病態メカニズムの解明が必要であると考えられるが,最近では陽電子放出断層法(positron emission tomography:PET)や磁気共鳴機能画像法(functional magnetic resonance imaging:fMRI)といった脳機能画像法の発展により,うつ病の病態メカニズムの解明が進んでいる.脳機能画像法のレビュー6)によれば,うつ病においては感情を司る扁桃体(amygdala)の過活動と,扁桃体を制御する前頭前野機能の低下といった扁桃体-前頭前野の機能異常が明らかとなっている.しかしながら,PETやfMRIは測定機器が高額のために実施できる施設が限られ,測定も臥位状態で行う必要があるなど,簡便性は必ずしも高いとはいえない.また,PETは放射性同位体の投与も行う必要があるなど侵襲性の問題もある.そこで最近では,より簡便性が高く非侵襲な脳機能画像法として近赤外分光法(near-infrared spectroscopy:NIRS)に注目が集まっている.NIRSは血液中のヘモグロビン(Hb)に吸収される近赤外光を頭部に照射し,その吸収率によって大脳皮質の脳血流変化を測定し,間接的に脳活動を測定する方法である.
NIRSはPETやfMRIと異なり,空間分解能が低く脳深部まで測定できないという短所はあるものの,①近赤外光を用いるため完全に非侵襲である,②装置が小型で移動可能であるためベッドサイドなど場所を選ばずに検査を行うことができる,③座位や立位など自然な姿勢で発声や運動を行いながら検査が可能である,などの長所があり臨床的応用が期待されている8).実際の臨床的応用としては,中等症以上の抑うつ症状を呈するうつ病,双極性障害,統合失調症の鑑別診断補助としての利用可能性が主に検討され,2014年4月には「抑うつ症状の鑑別診断の補助に使用するもの」として保険適用されるなど,ますますその臨床的応用に期待が高まっている.
精神疾患を対象とする場合,NIRSにおいてもPETやfMRIと同様に前頭前野が関心領域となることが多く,前頭前野機能検査として言語流暢性課題(verbal fluency task:VFT)を実施した際に,うつ病患者は他の精神疾患に比べ前頭前野の脳血流変化が乏しいこと30)が確認されている.また,うつ病患者は健常群に比べて,VFTを実施した際に左前頭前野の脳血流変化が乏しいこと18)29)が繰り返し報告されている.こうした,左前頭前野機能の低下はfMRIなどの他の脳機能画像法でも確認されているが,これはVFTが他の前頭前野機能検査と比べて,左背外側前頭前野(dorsolateral prefrontal cortex:DLPFC)の機能低下と特に関連するためと考えられている26).また,このようにうつ病において左前頭前野機能低下がみられることは,抑うつ症状のうち,興味関心の喪失や,特に精神運動制止の症状を反映しているためと考えられている33).一方で,うつ病に関するNIRS研究においては,左前頭前野だけでなく右前頭前野における機能低下を示唆する報告10)20)もある.このように,NIRSを用いて前頭前野全般の機能低下が確認できることは,最近のメタ分析35)でも確認されている.
しかしながら,うつ病におけるNIRSの縦断研究は少なく,VFTを賦活課題に用いて抗うつ薬による治療前後の前頭前野機能を比較したいくつかの報告14)24)31)に限られている.また,これらはいずれも未治療患者を対象とした抗うつ薬の治療反応性に関する研究であり,その他には薬物療法中の患者を対象とした研究21)で,心理社会的機能の改善と前頭前野機能の関連が報告されているのみである.
したがって,本研究では精神科外来に通院する,薬物療法中のうつ病患者を対象に,NIRSを用いて縦断的測定を行い,治療転帰と前頭前野機能との関連を検討し,抑うつ症状とNIRS所見に関する知見を集積することを目的とする.
I.方法
1.調査対象者
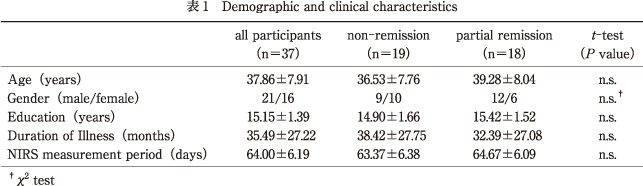
関東圏A精神科外来において,DSM-IV-TR2)の診断基準に基づいて大うつ病性障害と診断され治療を受けている通院患者を対象に,抑うつ症状測定およびNIRS測定をそれぞれ2回縦断的に行った.1回目の調査時点で日本語版簡易抑うつ症状尺度(Quick Inventory of Depressive Symptomatology:QIDS-J)7)でカットオフの6点以上を示し,頭部外傷および身体・神経疾患の病歴,躁的エピソード,不安障害の併存,アルコール・物質乱用歴のある者を除外した37名(男性21名,女性16名)を対象に調査を行った.
調査1回目(Time 1)と調査2回目(Time 2)の間は平均64.00日間(SD=6.19,範囲56~77)であった.約2ヵ月の調査間隔については,DSM-IV-TR2)において症状が最低2ヵ月間みられない場合を寛解としていることや,先行研究14)24)31)における調査間隔を参考に設定した.調査対象者の年齢は平均37.86歳(SD=7.91,範囲23~57)で,教育歴は平均15.15年(SD=1.39,範囲11~18),罹病期間は平均35.49ヵ月(SD=27.22,範囲6~84),すべて右利きであった(表1).
調査対象者のほとんどはparoxetine(20~50 mg/日),sertraline(25~100 mg/日),duloxetine(20~60 mg/日),milnacipran(50 mg/日),mirtazapine(15~30 mg/日),fluvoxamine(100 mg/日),escitalopram(10~20 mg/日)のうち,いずれか単剤による薬物療法を受けていたが,paroxetineのほかにsulpiride(100~150 mg/日)を併用していた者が1名,duloxetineとmirtazapineを併用していた者が1名いた.内服量はimipramine換算11)により等価換算された.
調査実施前に,筆頭著者が口頭と書面にて説明と同意の手続きを十分に行い,同意が得られた者を対象に調査を行った.なお,本研究は立教大学現代心理学部倫理委員会,および同大学ライフサイエンス委員会の承認を得ている(承認番号:LS12016A,LS13025A).
2.評価尺度
1)抑うつ症状
抑うつ症状を測定するため外来において症状評価尺度として定期的に実施している,DSM-IV-TR2)の大うつ病性障害の診断基準と合致するQIDS-J7)を用いた.QIDS-Jは16項目からなる自己記入式評価尺度で,過去1週間の状態について,①抑うつ気分,②集中困難,③自責感,④自殺念慮,⑤興味と喜びの消失,⑥エネルギーの低下/易疲労感,⑦睡眠障害(入眠困難,中途覚醒,早朝覚醒,過眠),⑧食欲/体重の増加または減少,⑨精神運動性興奮または緩慢,について4件法で回答する.各項目は症状ごとに得点化され,合計点は0~27点の範囲をとる.得点が高いほど抑うつ症状の重症度が高く,カットオフの6点以上が臨床群と判断される27).QIDS-Jは自己記入式評価尺度であるものの,抑うつ症状の代表的な他者評価尺度であるハミルトンうつ病評価尺度17項目および21項目(Hamilton Rating Scale for Depression:HAMD-17/21)9)と高い相関を示すだけでなく,寛解/非寛解の判別に関しても十分な判別力を有しているとされる7).したがって,QIDS-Jは自記式の抑うつ症状評価尺度のなかで比較的客観性が保たれているだけでなく,本研究の目的である治療転帰を判定するうえで適した尺度であると考えられる.
QIDS-Jによる症状測定はTime 1とTime 2の2時点で行われ,Time 2時点でカットオフの6点未満を示した群を部分寛解群とした.調査期間中の抑うつ症状の変化と前頭前野機能の変化との関連を検討するため,部分寛解群に対してTime 2時点でカットオフの6点以上を示した群を非寛解群とし,両群で年齢,性別,教育歴,罹病期間,調査間隔を一致させたうえで最終的な分析対象とした(表1).
2)心理社会的機能
患者の心理社会的機能を測定するため,DSM-IV-TR2)の全体的機能評価(Global Assessment of Functioning:GAF)を用いた.GAFは心理社会的,職業的な機能について0~100点で観察者により評価された.得点が高いほど,心理社会的機能が高いことを意味する.GAFによる評定もTime 1とTime 2の2時点で行われた.
3.NIRS測定
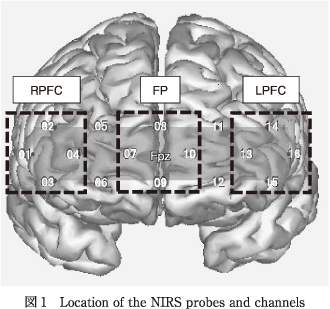
株式会社スペクトラテックのOEG-16を用い,Time 1とTime 2の2時点で前頭前野機能を測定した.OEG-16は16チャンネル(ch)からなるNIRS装置で,前額部のみに測定プローブを装着する簡易型装置である.計測部位は国際10-20法に基づき,測定プローブの中心をFpzに位置させた(図1;画像はビー・アール・システムズ株式会社のBRainView Ver. 1.00を用いて作成した).測定範囲はFp1,Fpz,Fp2,F7,F8,およびF3とF4よりやや低い領域を含む.Fp1,Fp2は左右の上前頭回,F7とF8は左右の下前頭回,F3とF4の下部はそれぞれDLPFCに対応する22).
4.賦活課題
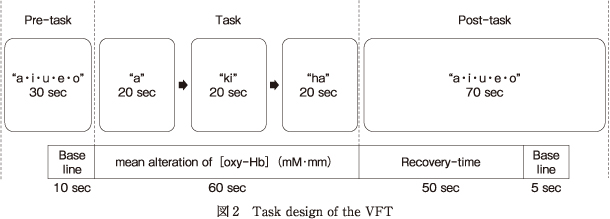
先行研究30)と同様に,賦活課題としてVFTを実施した.課題は全部で160秒間行われ,課題開始から30秒間のPre-task区間,その後60秒間のTask区間,最後の70秒間をPost-task区間とした.Task区間ではひらがな50音のなかから指定された1語で始まる単語をできるだけ多く発語するよう求めた.Task区間60秒間のうち,20秒ごとに呈示する1語を変えた.本研究では,Time 1では「あ」「き」「は」を,Time 2では「と」「せ」「お」のひらがなを用いた.Task区間前後のPre-task区間,およびPost-task区間では,「あ・い・う・え・お」を単純に繰り返すベースライン課題を行った(図2).課題の教示はすべてノート型PCのモニターにて呈示した.
5.分析方法
先行研究30)と同様に,Pre-task区間末の10秒間をベースラインとして,Task区間で上昇した脳血流変化がPost-task区間の最初の50秒間で減衰し,その後の5秒間で再びベースラインに戻ると仮定し,ベースライン補正を行った.その後,高速フーリエ変換を用いたローパスフィルター(0.05 Hz)を用いて微細な体動の影響を取り除いた.また,得られた血流変化成分から頭皮の血流変化成分を差し引き,脳活動の信号成分を推定するため血流動態分離法34)を用いた.賦活指標には,VFT 60秒間中の酸素化ヘモグロビン([oxy-Hb])の平均賦活量(mM・mm)を用いた(図2).
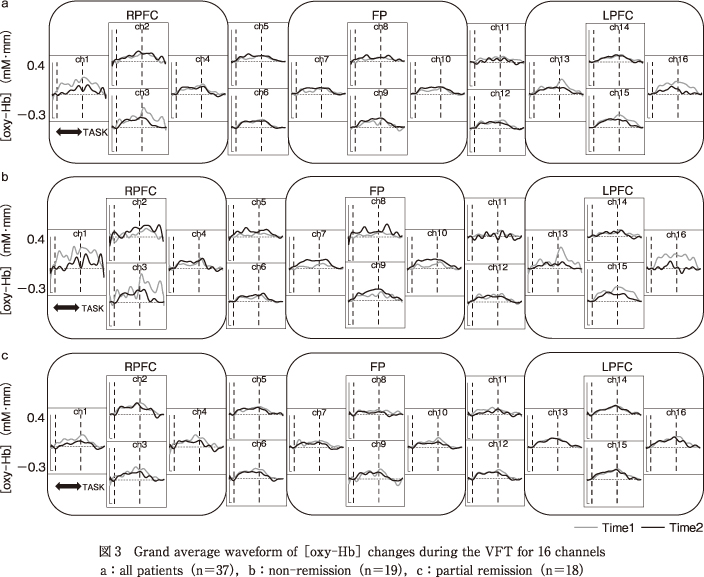
さらに,先行研究13)17)を参考にch1~4を前頭前野右側部(right prefrontal cortex:RPFC)・ch13~16を前頭前野左側部(left prefrontal cortex:LPFC)とし,加えてch7~10を前頭極部(frontal pole:FP)として関心領域に設定した(図1).全調査対象者および非寛解群,部分寛解群ごとの全16 chのNIRS波形を図3に,関心領域ごとのNIRS波形を図4にそれぞれ示す.
まず,非寛解群と部分寛解群の2群間で,Time 1からTime 2にかけてのVFTの語産出数,GAF,投薬量,QIDS-J合計得点の縦断的変化を群間比較するため,時期(対応あり:2水準)×群(対応なし:2水準)の反復測定デザインによる2要因分散分析(ANOVA)を行った.さらに,2群間でTime 1からTime 2にかけてのQIDS-J症状別得点および関心領域別平均賦活量の縦断的変化を群間比較するため,時期(対応あり:2水準)×群(対応なし:2水準)の反復測定デザインによる2要因多変量分散分析(MANOVA)を用いて比較を行った.いずれの分析においても,多重検定の修正にはBonferroni法を用いた.また,Time 1からTime 2にかけてのQIDS-J合計得点および関心領域別平均賦活量の縦断的変化の関連を検討するため,Time 2からTime 1を引いた値をそれぞれQIDS-J変化量,関心領域別平均賦活変化量としてPearsonの積率相関分析を群ごとに行った.有意水準はすべてP<0.05とした.分析にはSPSS Statistics 24を用いた.
II.結果
1.語産出数,GAF,投薬量,QIDS-J合計および症状別得点の縦断的変化の比較
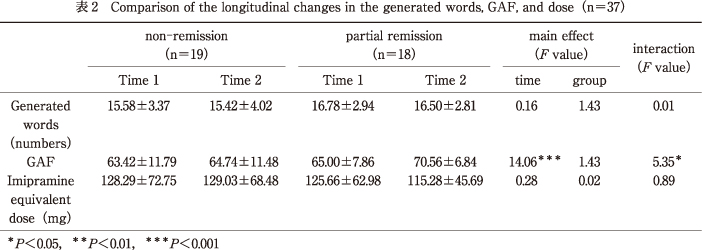
時期(対応あり:2水準)×群(対応なし:2水準)の反復測定デザインによる2要因分散分析(ANOVA)および多変量分散分析(MANOVA)の結果を表2, 表3に示す.語産出数および投薬量においては,主効果・交互作用ともに有意ではなかった.一方で,GAFおよびQIDS-J合計得点においてはそれぞれ交互作用が有意であった〔F(1,35)=5.35,P<0.05;F(1,35)=44.90,P<0.001〕.
単純主効果検定を行ったところ,GAFについては部分寛解群においてのみ有意傾向ではあったが時期の単純主効果がみられた〔F(1,35)=3.48,P<0.10〕.したがって,部分寛解群のみTime 1からTime 2にかけて心理社会的機能が改善しており,非寛解群は心理社会的機能に変化はなかった.また,QIDS-J合計得点については部分寛解群においてのみ時期の単純主効果が有意であった〔F(1,35)=41.84,P<0.001〕.したがって,部分寛解群のみTime 1からTime 2にかけて抑うつ症状が低減しており,非寛解群は抑うつ症状に変化はなかった.
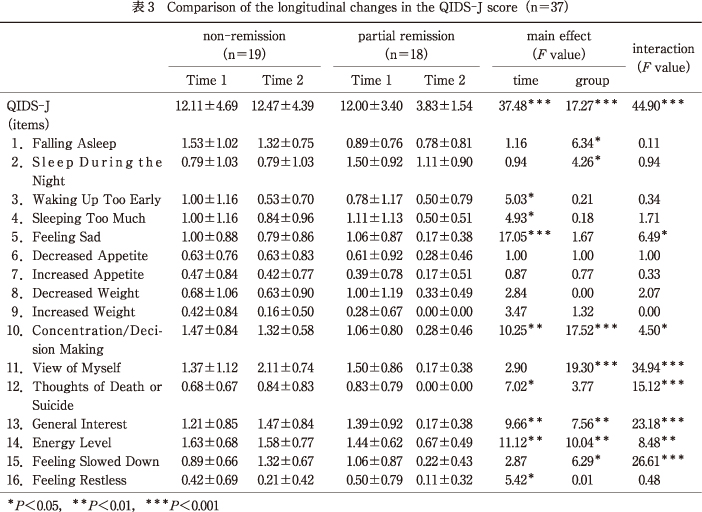
QIDS-J症状別得点のうち,交互作用が有意であったのは,項目5「悲しい気分」〔F(1,35)=6.49,P<0.05〕,項目10「集中力/決断」〔F(1,35)=4.50,P<0.05〕,項目11「自分についての見方」〔F(1,35)=34.94,P<0.001〕,項目12「死や自殺についての考え」〔F(1,35)=15.12,P<0.001〕,項目13「一般的な興味」〔F(1,35)=23.18,P<0.001〕,項目14「エネルギーのレベル」〔F(1,35)=8.48,P<0.01〕,項目15「動きが遅くなった気がする」〔F(1,35)=26.61,P<0.001〕であった.
単純主効果検定を行ったところ,項目5「悲しい気分」〔F(1,35)=20.53,P<0.05〕,項目10「集中力/決断」〔F(1,35)=10.82,P<0.01〕,項目12「死や自殺についての考え」〔F(1,35)=20.24,P<0.001〕,項目13「一般的な興味」〔F(1,35)=23.91,P<0.001〕,項目14「エネルギーのレベル」〔F(1,35)=20.32,P<0.001〕については,部分寛解群のみ時期の単純主効果がそれぞれ有意であった.したがって,Time 1からTime 2にかけて部分寛解群においてのみこれらの得点が有意に低減していた.
項目11「自分についての見方」,項目15「動きが遅くなった気がする」については非寛解群〔F(1,35)=7.84,P<0.05;F(1,35)=7.02,P<0.05〕,部分寛解群〔F(1,35)=34.00,P<0.001;F(1,35)=20.24,P<0.001〕それぞれにおいて時期の単純主効果が有意であった.したがって,Time 1からTime 2にかけて非寛解群においてこれらの得点が有意に上昇しており,一方で部分寛解群では有意に低減していた.
また,項目1「寝付き」〔F(1,35)=6.34,P<0.05〕,項目2「夜間の睡眠」〔F(1,35)=4.26,P<0.05〕ではそれぞれ群の主効果が有意であり,Time 1,Time 2を通して非寛解群では項目1「寝付き」の得点が有意に高く,部分寛解群では項目2「夜間の睡眠」の得点が有意に高かった.さらに,項目3「早く目が覚めすぎる」〔F(1,35)=5.03,P<0.05〕,項目4「眠りすぎる」〔F(1,35)=4.93,P<0.05〕,項目16「落ち着かない」〔F(1,35)=5.42,P<0.05〕では,それぞれ時期の主効果が有意であり,非寛解群,部分寛解群ともに有意に低減していた.
2.領域別平均賦活量の縦断的変化の比較
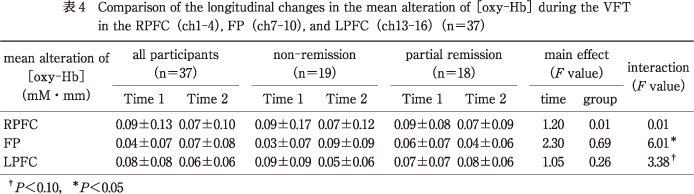
時期(対応あり:2水準)×群(対応なし:2水準)の反復測定デザインによる2要因多変量分散分析(MANOVA)の結果を表4に示す.RPFCについては,主効果・交互作用ともに有意ではなかった.一方で,FPについて交互作用が有意であった〔F(1,35)=6.01,P<0.05〕.また,LPFCにおいて有意傾向ではあったが交互作用がみられた〔F(1,35)=3.38,P<0.10〕.
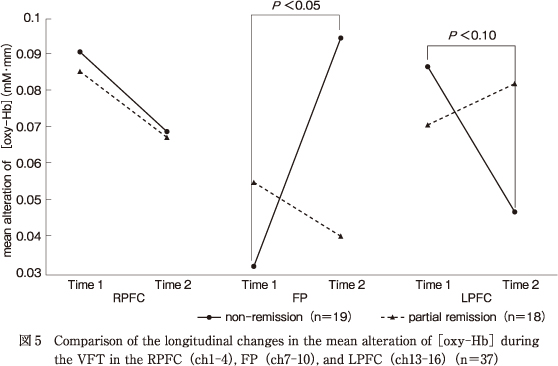
単純主効果検定を行ったところ,FPについては非寛解群のみ時期の単純主効果が有意であった〔F(1,35)=6.28,P<0.05〕.したがって,非寛解群のみTime 1からTime 2にかけてのFP領域における平均賦活量が有意に増加しており,部分寛解群では変化は有意ではなかった.また,LPFCについても有意傾向ではあったが非寛解群のみ時期の単純主効果がみられた〔F(1,35)=3.26,P<0.10〕.したがって,非寛解群のみTime 1からTime 2にかけてのLPFC領域における平均賦活量が有意に低下しており,部分寛解群では変化は有意ではなかった(図5).
3.QIDS-J変化量と関心領域別平均賦活変化量との関連
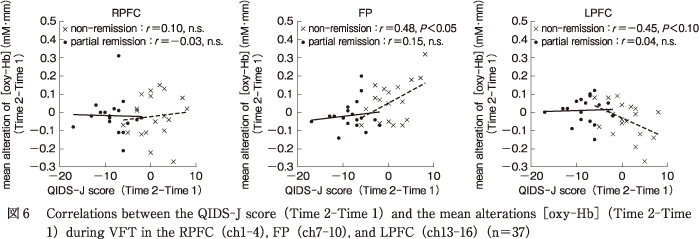
群ごとに行った相関分析の結果,非寛解群ではQIDS-J変化量とFP領域の平均賦活変化量の間に有意な正の相関(r=0.48,P<0.05)が,LPFC領域の平均賦活変化量との間に有意傾向ではあるが負の相関(r=-0.45,P<0.10)がそれぞれみられた.RPFC領域との間には有意な相関はみられなかった(r=0.10,n. s.).一方で,部分寛解群ではQIDS-J変化量と関心領域別平均賦活変化量との間に有意な相関はみられなかった(RPFC:r=-0.03,n. s.;FP:r=0.15,n. s.;LPFC:r=0.04,n. s.)(図6).
III.考察
本研究の目的は,精神科外来に通院する治療中のうつ病患者を対象に,NIRSによる縦断的な測定を行い,治療転帰と前頭前野機能の変化との関連を検討することであった.調査対象者を抑うつ症状得点に基づき非寛解群と部分寛解群に分け,治療転帰と前頭前野の平均賦活量の縦断的変化を検討した結果,非寛解群においてTime 1からTime 2にかけてFP領域における平均賦活量の増加およびLPFC領域における平均賦活量の低減がみられた.また,Time 1からTime 2にかけての抑うつ症状の変化と領域別平均賦活量の変化の関連を検討したところ,非寛解群において抑うつ症状の増悪とFP領域の平均賦活量の増加およびLPFC領域の平均賦活量の低減との関連がそれぞれみられた.
まず,非寛解群におけるFP領域の平均賦活量の増加については,本研究と同様にVFTを賦活課題に用いて抗うつ薬治療前のFP領域の亢進と予後不良との関連を示唆した先行研究14)と一致する.ここで,うつ病に関する脳機能画像法の最近のレビュー5)を参照すると,FP領域も含む内側前頭前野(medial prefrontal cortex:MPFC)の亢進はネガティブな自己参照や反すうなどと関連することが明らかとなっている.特に,反すうは抑うつ症状の持続と関連すること19)がすでに示唆されている.
本研究においても,実際に非寛解群においてはTime 1からTime 2にかけて自己否定感に関する項目11の有意な上昇が確認されていることから,非寛解群においてみられたFP領域の平均賦活量の増加は,ネガティブな認知が活性化し症状が遷延したことを反映している可能性が考えられる.
その根拠の1つとして,NIRS信号には皮質領域しか反映されないといわれているものの,安静時のNIRS-fMRIの同時測定研究28)では,MPFCも含むデフォルト・モード・ネットワーク(default mode network:DMN)の活動がNIRS信号にも反映されることが示唆されている.
さらに,他者評価式のHAMD-17と抑うつ的認知に関する項目の多い自記式のベック抑うつ質問票(Beck Depression Inventory-Second Edition:BDI-II)3)の双方で抑うつ症状を測定したNIRS研究1)では,BDI-II合計スコアと本研究におけるFP領域に相当する部位のVFT中の平均賦活量との間に正の相関がみられたことが報告されている.この研究においてMPFCと関連する否定的認知の項目が多いBDI-IIのみ平均賦活量と関連がみられたことから,本研究におけるFP領域の活動に関しても,MPFCの機能を反映する可能性があると考えられる.
また,情動を喚起させる画像刺激後にn-back課題を実施したNIRS研究23)では,中性画像呈示後よりもネガティブ画像呈示後において,n-back課題中にMPFCに相当する部位の平均賦活量が上昇していたことが報告されている.この研究では,NIRSデータにはMPFCの全領域は含まれないものの,画像刺激によって喚起されたネガティブな情動反応を制御するMPFCの活動の一部が反映される可能性が示唆されている.
以上の点から,NIRSデータには部分的にではあるもののMPFCの活動が反映される可能性があると考えられる.しかしながら,以上で述べた先行研究のなかには賦活課題が異なっている研究もあることや,VFT中の平均賦活量とネガティブな自動思考との関連を検討したNIRS研究15)では,右上側頭回(right superior temporal gyrus)に該当する領域の平均賦活量の上昇とネガティブな自動思考との関連が指摘されているなど異なる知見も存在している.したがって,今回の非寛解群における結果の解釈については慎重に検討していく必要がある.
次に,非寛解群におけるLPFC領域の平均賦活量の低減であるが,うつ病に関する脳機能画像法の最近のレビュー4)を参照すると,LPFC領域に該当すると思われる左前頭前野機能の低下は,ネガティブな感情刺激と関連した扁桃体の過活動に対するトップダウンの抑制機能の不調と関連することが明らかとなっている.
したがって,非寛解群においてみられたLPFC領域の平均賦活量の低減は,左前頭前野からのトップダウンによる抑制がうまく機能せず,症状が遷延したことを反映した結果ではないかと考えられる.実際,非寛解群においてはTime 1からTime 2にかけて左前頭前野の機能低下と関連する精神運動制止に関する項目15の有意な上昇がみられた.ただし,これはVFTを賦活課題に用いて抗うつ薬による治療前の右前頭前野における賦活と治療反応性との関連を示唆した先行研究31)と一致しなかった.
一方で,本研究において部分寛解群ではTime 1からTime 2にかけての前頭前野機能の変化はみられなかった.これは,VFTを賦活課題に用いて抗うつ薬治療前後で縦断的にNIRS測定を行った研究31)の結果と一致する.しかしながら,本研究と同様にVFTを賦活課題に用いて薬物療法中の前頭前野機能の変化を縦断的に検討した研究21)では,右前頭前野機能の改善と心理社会的機能の改善が関連していた.ただし,この研究では本研究と異なり測定間隔が5.20±1.32ヵ月と長いことから,心理社会的機能の改善がNIRSデータに反映されたものと思われる.
以上のように,本研究と先行研究の知見は一部相反する結果となった.これは,調査対象者の属性の違い以外にも,未治療患者を対象にした抗うつ薬の治療反応性に関する検討を目的とした先行研究と,治療転帰との関連を検討した本研究との目的の違いによるものと考えられる.
おわりに―限界と展望―
本研究では,精神科外来に通院し治療を受けているうつ病患者を対象に,約2ヵ月の間隔をおいて縦断的にNIRSによる前頭前野機能測定を行った.非寛解群と部分寛解群との治療転帰を比較することで,抑うつ症状の遷延と関連する前頭前野機能の変化をNIRSによって測定できる可能性が示唆された.しかしながら,本研究はいくつかの点で限界がある.
第1に,NIRSは皮質領域しか測定できず空間分解能も低いとされるため,本研究で示唆された脳機能との関連についてはより詳細な検討が必要である.前述の通りNIRS-fMRIの同時測定研究28)において,反すうや自己参照と関連するDMNの活動がNIRSデータに反映されるという知見はあるものの,この研究は安静時の脳機能を測定したものである.したがって,本研究で示唆されたVFTを賦活課題に用いたFP領域の活動がMPFCの機能を反映しているかについては慎重に検討していく必要がある.
第2に,本研究の調査対象者は少なく,また選別基準も厳格ではなかったため,本研究で得られた結果を一般化することはできない.特に性差については,非寛解群と部分寛解群では統計的には有意ではないものの部分寛解群において若干男性の比率が高くなっていた.健常群を対象にした研究12)では,VFT中の[oxy-Hb]の平均賦活量は女性に比べ男性のほうが大きいという指摘もある.しかしながら,本研究においては非寛解群と部分寛解群で,Time 1の平均賦活量には有意差がなかった.また,男性の比率が高かった部分寛解群ではTime 1からTime 2にかけての平均賦活量には変化がみられなかった.したがって,部分寛解群におけるTime 1からTime 2にかけてのFP領域の平均賦活量の有意な増加に関しては,性差による交絡の影響は少ないものと考えられる.
その他,非メランコリー親和型に対してメランコリー親和型では平均賦活量が有意に小さい32)ことも報告されている.本研究では,メランコリー親和型か否かの特定を行っておらず,サブタイプごとの違いを十分に検討できていない.
第3に,本研究の調査対象者はすべて抗うつ薬による治療をすでに受けていた.そのため,本研究は厳密には観察研究であり,薬剤は統制されておらず,抗うつ薬による影響は十分に検討されているとはいえない.しかしながら,非寛解群と部分寛解群の2群間でimipramine換算による抗うつ薬の投与量に差はみられなかったため,抗うつ薬の投与量に関する影響は小さいものと考えられる.
第4に,本研究ではTime 2における抑うつ症状がカットオフ未満の群を寛解の基準としたが,一定期間基準を満たしていたかどうかまでは確認していない.また,本研究では健常対照群を設けておらず,本研究で示唆された治療転帰に伴う前頭前野機能の変化について,健常群の水準と比較して正常化したのかについてまで検討することはできなかった.
ここで,多施設共同研究30)における健常対照群のデータ35)を参照すると,本研究における非寛解群および部分寛解群の前頭前野各領域の平均賦活量はTime 1・Time 2いずれも健常対照群よりも低かった.したがって,部分寛解群はTime 1からTime 2にかけて抑うつ症状が症状別にみても低減しているにもかかわらず,前頭前野機能は寛解水準まで達していないことが推測される.うつ病においては,寛解状態でも認知機能障害が残存することが最近のレビュー25)でも示唆されている.本研究では寛解状態の維持を確認しておらず,測定期間も約2ヵ月間と短かったことから,認知機能の改善がNIRSデータに反映されなかったものと考えられる.
第5に,本研究では賦活課題としてVFTを用いたため,非寛解群においてみられたFP領域の亢進が否定的認知の活性化によるものか十分な検討ができていない.今後は,否定的認知を活性化させるような認知課題を用いて,NIRSデータに反映される脳機能について詳細に検討していくことが必要であると考えられる.
以上のように,本研究には限界があるものの,NIRSによる縦断的研究が限られているなかで,抑うつ症状の遷延と関連する前頭前野機能の変化について一定の示唆が得られたことは意義があると思われる.今後は調査対象者の選別基準をより厳格にし,薬剤などの影響やサブタイプなど関連する変数を可能な限り統制したうえで,治療転帰と前頭前野機能の変化との関連を縦断的に検討していくことが求められる.
なお,本論文に関連する利益相反に関して,共著者の片山信吾がMeiji Seikaファルマ株式会社のアドバイザリーとなっている.その他の著者について,本論文に関連して開示すべき利益相反はない.
1) Akashi, H., Tsujii, N., Mikawa, W., et al.: Prefrontal cortex activation is associated with a discrepancy between self- and observer-rated depression severities of major depressive disorder: a multichannel near-infrared spectroscopy study. J Affect Disord, 174; 165-172, 2015![]()
2) American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 4th ed, Text Revision (DSM-IV-TR). American Psychiatric Association, Washington, D. C., 2000 (髙橋三郎, 大野 裕, 染矢俊幸訳: DSM-IV-TR精神疾患の診断・統計マニュアル. 医学書院, 東京, 2002)
3) Beck, A. T., Steer, R. A., Ball, R., et al.: Comparison of Beck Depression Inventories-IA and-II in psychiatric outpatients. J Pers Assess, 67 (3); 588-597, 1996![]()
4) Bruder, G. E., Stewart, J. W., McGrath, P. J.: Right brain, left brain in depressive disorders: clinical and theoretical implications of behavioral, electrophysiological and neuroimaging findings. Neurosci Biobehav Rev, 78; 178-191, 2017![]()
5) Disner, S. G., Beevers, C. G., Haigh, E. A., et al.: Neural mechanisms of the cognitive model of depression. Nat Rev Neurosci, 12 (8); 467-477, 2011![]()
6) Drevets, W. C., Price, J. L., Furey, M. L.: Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression. Brain Struct Funct, 213 (1-2); 93-118, 2008![]()
7) 藤澤大介, 中川敦夫, 田島美幸ほか: 日本語版自己記入式簡易抑うつ尺度(日本語版QIDS-SR)の開発. ストレス科学, 25 (1); 43-52, 2010
8) 福田正人, 須田真史, 亀山正樹ほか: 精神疾患におけるNIRSの意義. 精神疾患とNIRS―光トポグラフィー検査による脳機能イメージング― (福田正人編). 中山書店, 東京, p.40-51, 2009
9) Hamilton, M.: A rating scale for depression. J Neurol Neurosurg Psychiatry, 23; 56-62, 1960![]()
10) Herrmann, M. J., Ehlis, A. C., Fallgatter, A. J.: Bilaterally reduced frontal activation during a verbal fluency task in depressed patients as measured by near-infrared spectroscopy. J Neuropsychiatry Clin Neurosci, 16 (2); 170-175, 2004![]()
11) 稲垣 中, 稲田俊也: 抗うつ薬の等価換算. 臨床精神神経薬理学テキスト改訂第3版 (日本臨床精神神経薬理学会専門医制度委員会編). 星和書店, 東京, p.492, 2014
12) Kameyama, M., Fukuda, M., Uehara, T., et al.: Sex and age dependencies of cerebral blood volume changes during cognitive activation: a multichannel near-infrared spectroscopy study. Neuroimage, 22 (4); 1715-1721, 2004![]()
13) Kita, Y., Gunji, A., Inoue, Y., et al.: Self-face recognition in children with autism spectrum disorders: a near-infrared spectroscopy study. Brain Dev, 33 (6); 494-503, 2011![]()
14) 小久保羊介, 山縣 文, 太田晴久ほか: うつ病の薬物治療反応性と近赤外線スペクトロスコピー所見―反応良好群と反応不良群との比較―. 昭和医学会雑誌, 69 (2); 182-189, 2009
15) Koseki, S., Noda, T., Yokoyama, S., et al.: The relationship between positive and negative automatic thought and activity in the prefrontal and temporal cortices: a multi-channel near-infrared spectroscopy (NIRS) study. J Affect Disord, 151 (1); 352-359, 2013![]()
16) 厚生労働省: 自殺・うつ対策の経済的便益(自殺やうつによる社会的損失). 2010 (http://www.mhlw.go.jp/stf/houdou/2r9852000000qvsy.html)(参照2017-10-10)
17) Makizako, H., Doi, T., Shimada, H., et al.: Relationship between going outdoors daily and activation of the prefrontal cortex during verbal fluency tasks (VFTs) among older adults:a near-infrared spectroscopy study. Arch Gerontol Geriatr, 56 (1); 118-123, 2013![]()
18) Matsuo, K., Onodera, Y., Hamamoto, T., et al.: Hypofrontality and microvascular dysregulation in remitted late-onset depression assessed by functional near-infrared spectroscopy. Neuroimage, 26 (1); 234-242, 2005![]()
19) Nolen-Hoeksema, S.: The role of rumination in depressive disorders and mixed anxiety/depressive symptoms. J Abnorm Psychol, 109 (3); 504-511, 2000![]()
20) Ohta, H., Yamagata, B., Tomioka, H., et al.: Hypofrontality in panic disorder and major depressive disorder assessed by multi-channel near-infrared spectroscopy. Depress Anxiety, 25 (12); 1053-1059, 2008![]()
21) Ohtani, T., Nishimura, Y., Takahashi, K., et al.: Association between longitudinal changes in prefrontal hemodynamic responses and social adaptation in patients with bipolar disorder and major depressive disorder. J Affect Disord, 176; 78-86, 2015![]()
22) Okamoto, M., Dan, H., Sakamoto, K., et al.: Three-dimensional probabilistic anatomical cranio-cerebral correlation via the international 10-20 system oriented for transcranial functional brain mapping. Neuroimage, 21 (1); 99-111, 2004![]()
23) Ozawa, S., Matsuda, G., Hiraki, K.: Negative emotion modulates prefrontal cortex activity during a working memory task: a NIRS study. Front Hum Neurosci, 8; 46, 2014![]()
24) Pu, S., Nakagome, K., Yamada, T., et al.: Prefrontal activation predicts social functioning improvement after initial treatment in late-onset depression. J Psychiatr Res, 62; 62-70, 2015![]()
25) Rock, P. L., Roiser, J. P., Riedel, W. J., et al.: Cognitive impairment in depression: a systematic review and meta-analysis. Psychol Med, 44 (10); 2029-2040, 2014![]()
26) Rogers, M. A., Kasai, K., Koji, M., et al.: Executive and prefrontal dysfunction in unipolar depression: a review of neuropsychological and imaging evidence. Neurosci Res, 50 (1); 1-11, 2004![]()
27) Rush, A. J., Trivedi, M. H., Ibrahim, H. M., et al.: The 16-Item Quick Inventory of Depressive Symptomatology (QIDS), clinician rating (QIDS-C), and self-report (QIDS-SR): a psychometric evaluation in patients with chronic major depression. Biol Psychiatry, 54 (5); 573-583, 2003![]()
28) Sasai, S., Homae, F., Watanabe, H., et al.: A NIRS-fMRI study of resting state network. Neuroimage, 63 (1); 179-193, 2012![]()
29) Suto, T., Fukuda, M., Ito, M., et al.: Multichannel near-infrared spectroscopy in depression and schizophrenia: cognitive brain activation study. Biol Psychiatry, 55 (5); 501-511, 2004![]()
30) Takizawa, R., Fukuda, M., Kawasaki, S., et al.: Neuroimaging-aided differential diagnosis of the depressive state. Neuroimage, 85 Pt 1; 498-507, 2014![]()
31) Tomioka, H., Yamagata, B., Kawasaki, S., et al.: A longitudinal functional neuroimaging study in medication-naïve depression after antidepressant treatment. PLoS One, 10 (3); e0120828, 2015![]()
32) Tsujii, N., Mikawa, W., Tsujimoto, E., et al.: Relationship between prefrontal hemodynamic responses and quality of life differs between melancholia and non-melancholic depression. Psychiatry Res Neuroimaging, 253; 26-35, 2016![]()
33) Videbech, P., Ravnkilde, B., Pedersen, T.H., et al.: The Danish PET/depression project: clinical symptoms and cerebral blood flow. A regions-of-interest analysis. Acta Psychiatr Scand, 106 (1); 35-44, 2002![]()
34) Yamada, T., Umeyama, S., Matsuda, K.: Separation of fNIRS signals into functional and systemic components based on differences in hemodynamic modalities. PLoS One, 7 (11); e50271, 2012![]()
35) Zhang, H., Dong, W., Dang, W., et al.: Near-infrared spectroscopy for examination of prefrontal activation during cognitive tasks in patients with major depressive disorder: a meta-analysis of observational studies. Psychiatry Clin Neurosci, 69 (1); 22-33, 2015![]()