気分障害の発症・病態機序はいまだ不明であるが,遺伝的要因に加えてストレスなどの環境要因がその発症を促すと想定されている.近年の脳画像研究や死後脳解析から,一部のうつ病患者脳における機能的変化ならびに神経細胞の形態的変化の存在が示唆され,うつ病の病態における神経可塑性異常が注目されている.神経可塑性には脳における適切な遺伝子発現が重要である.うつ病患者死後脳ではさまざまな遺伝子の発現異常が報告されていることから,うつ病患者では遺伝的要因と環境要因(ストレス)の相互作用によって,脳内遺伝子発現プログラムが変化することで神経可塑性異常を引き起こし,その結果うつ状態に陥る,といったうつ病における神経可塑性異常仮説が提唱されている.遺伝情報は「DNA→(転写)→mRNA→(翻訳)→蛋白質」の順に伝達される(セントラルドグマ).したがって,遺伝情報をmRNAに写し取る役割を担う転写調節因子の神経可塑性やストレス反応性に対する役割の解析が行われてきた.しかし最近,蛋白質をコードしていない非コードRNAの1種であるマイクロRNAが,標的mRNAの蛋白質への翻訳を制御することで神経細胞の構造的可塑性やシナプス可塑性さらには高次脳機能に対して重要な役割を担っていることが明らかとなり注目されている.本稿では,マイクロRNAによる遺伝子発現調節機構とうつ病との関連について,これまでの主要な研究成果を紹介したい.
はじめに
ヒトゲノムプロジェクトの成果から,ヒトの遺伝子数は当初の予測より少なく,下等な生物と比較しても大きな違いがないことが明らかとなった.これは,高等動物における高次脳機能・精神機能の制御において,遺伝子の数よりも遺伝子発現制御機構の高度化・複雑化が重要であることを示唆している.ヒトゲノム中で蛋白質情報をコードしている領域はわずか2%であるのに対して,70%以上の領域が蛋白質をコードしていないRNA(非コードRNA)として転写されている.非コードRNAは,遺伝子発現のオン・オフのスイッチとしての役割が明らかとなり,DNAからメッセンジャーRNA(mRNA)への転写やmRNAから蛋白質への翻訳といったさまざまな階層での遺伝子発現制御に対して積極的にかかわっている.このような非コードRNAの発見は,生命科学に大きな転換点をもたらしつつあり,「RNA新大陸」と称されるに至っている.事実,ゲノムのなかに隠されていた非コードRNAによる新しい生体制御プログラムを理解すること,そしてそのプログラムの破綻によって引き起こされる疾患発症メカニズムの解明をめざした研究が世界中で展開されている.
精神疾患の病態の1つに神経可塑性異常が想定されている.「遺伝的要因ならびに環境要因との相互作用による神経細胞の機能的・構造的異常が病態の一端を担っている」という神経可塑性異常仮説である.神経可塑性には脳内の遺伝子発現調節が重要な役割を担っている.したがって,高等動物における高次脳機能制御や精神活動に対する非コードRNAの関与が推測される.本論では,非コードRNAの高次脳機能制御に対する役割の解析例について先行研究論文を紹介するとともに,精神疾患,とりわけ気分障害の発症・病態機序に対する非コードRNAの役割について概説したい.
I.気分障害における神経可塑性異常
気分障害の発症メカニズムの1つに,脳神経細胞の機能的・構造的可塑性異常によって正常な脳内ネットワークが構築されずに脳機能低下を引き起こすといった,神経可塑性障害仮説が提唱されている.実際,一部のうつ病患者の脳に,機能的変化のみならず形態的変化が生じていることが報告されている.代表例として,海馬の萎縮,前頭前野の神経細胞の縮小・減少などが挙げられる13)17)22)23)27).また,動物実験においては,慢性ストレスを負荷したうつ状態の動物における海馬神経細胞樹状突起のスパイン密度低下や神経新生の低下などが報告されている1)6)10)16)34).このような知見から,気分障害の病態にはストレスによる脳細胞の構造的・形態的変化を伴う神経可塑性異常が密接に関与していることが推測される.
神経可塑性には脳内の遺伝子発現調節が重要な役割を担っている.事実,うつ病患者死後脳において,遺伝子発現のオン・オフのスイッチとしての役割を担っている転写調節因子群の発現・機能異常が認められている15)29).また,ストレス負荷動物や抗うつ薬投与動物においても,さまざまな遺伝子の発現変動が観察されている29-31).このような知見から,気分障害の病態には遺伝子発現調節異常による神経可塑性障害が関与していることが示唆される19).
最近,蛋白質をコードしていない低分子の非コードRNA(マイクロRNA)が標的mRNAの蛋白質への翻訳を阻害することでさまざまな細胞機能に影響を及ぼしていることが明らかとなりつつある.興味深いことに,ストレス負荷や抗うつ薬によって発現が変動するマイクロRNAが存在する11).さらに気分障害患者死後脳や末梢白血球において発現変動を示すマイクロRNAも報告されている12).このように,気分障害の発症機序ならびに向精神薬の作用機序に対するマイクロRNAの役割が注目されている.本稿では,マイクロRNAを介した遺伝子発現調節機構と神経可塑性との関連,ならびにうつ病との関連を中心に紹介したい.
II.非コードRNAの役割
2004年,国際ヒトゲノムコンソーシアムは,ゲノム配列情報から遺伝子数を約22,000個と予測した.これはゲノム全体の約2%にすぎず,ヒトの生命に役立つのはゲノムのわずか2%で,それ以外は不必要ながらくたRNAと思われた.ところがその後,全ゲノムの約70%以上がRNAに転写されていることが発見され4),これまでがらくたと考えられていたRNAに何らかの重要な働きのある可能性が想定された.事実,がらくたRNAの50%を超えるRNAが蛋白質をつくらず,独自に機能を果たしている非コードRNAであることが判明した.非コードRNAはlong non-coding RNA(長鎖RNA),mRNA-like non-coding RNA(mRNA型ncRNA),small nuclear RNA(低分子核RNA),small nucleolar RNA(核小体RNA),microRNA(マイクロRNA)などさまざまな種類に分類され,その機能も多様である.
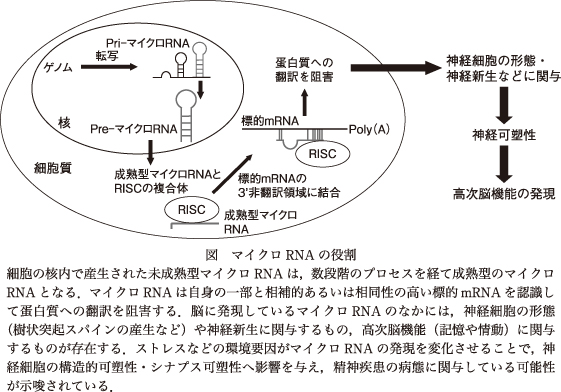
非コードRNAのなかでも脳におけるその役割の解析が比較的進んでいるのがマイクロRNAである.マイクロRNAは19~23塩基程度の低分子RNAで,自身の一部と相補的な配列を有する標的mRNAの3’非翻訳領域に結合することでmRNAを分解,あるいは蛋白質への翻訳を阻害する(図).ヒトの蛋白質をコードしている遺伝子の約30%がマイクロRNAによって発現制御を受けていると推測されている28).
マイクロRNAの神経可塑性に対する役割に関するランドマーク的論文がある.2006年にSchratt, G. M. らは,初代培養神経細胞を用いて脳特異的に発現しているマイクロRNA-134が神経細胞樹状突起スパインの産生を負に制御していることをNature誌に報告した26).この発見を皮切りに,マイクロRNAの神経系における役割の解析研究が注目され,神経細胞の分化・発達やスパイン産生,神経新生にかかわるマイクロRNAが相次いで発見されるようになった.さらに2010年には,動物個体でのマイクロRNA-134の役割が明らかとなり,海馬におけるマイクロRNA-134がシナプス可塑性ならびに記憶形成に必須の因子であることが明らかとなった8).このように,脳におけるマイクロRNAの同定と神経可塑性や高次脳機能に対する役割が明らかとなりつつある.
III.モデル動物を用いたマイクロRNAと神経可塑性・うつ様行動との関連
気分障害や不安障害の発症脆弱性に対する生物学的基盤の1つとして,グルココルチコイド受容体(GR)を介した視床下部-下垂体-副腎系(HPA系)のフィードバック機能異常が知られている.実際,HPA系の機能制御に障害のある気分障害患者が存在すること5),うつ病患者死後脳におけるGRの発現低下21)が報告されている.また,虐待を受けた経験のある自殺者の海馬GR mRNA発現量は,虐待を受けた経験のない自殺者に比べて有意に減少していたとの研究結果も報告されている18).さらに,動物実験においても,GRとストレス脆弱性・うつ・不安との関連が示唆されている3)35).したがって,GRの機能異常が気分障害の病態の一端を担っていることが推測されている.これまでに,ストレス脆弱性やうつ病との関連が示唆されているGRの発現を制御するマイクロRNAが同定されている32)33).軽度な慢性ストレス曝露に対してアンヘドニアや興味の低下を認めるストレス脆弱性ラットでは,視床下部室傍核におけるGRの蛋白量が,ストレス耐性を有するラットに比して有意に減少していた.一方,GR mRNA発現量に差は認められなかったことから,マイクロRNAによる翻訳制御異常の可能性が予想された.実際,ストレス脆弱性ラットの視床下部室傍核におけるマイクロRNA-18の発現量は,ストレス耐性ラットに比べて有意に増加していた.分子生物学的解析により,マイクロRNA-18がGR mRNAの3'非翻訳領域に結合することでその翻訳を抑制することが確認された.その後,他のグループからもマイクロRNA-18によるGRの翻訳抑制が報告された33).このように,マイクロRNAを介したGRの発現抑制がストレス脆弱性の形成に関与していることが示唆され,マイクロRNAが気分障害の病態の一端を担っていることが推測される.
ストレス脆弱性の形成にかかわるマイクロRNAの存在に加え,ストレス負荷による神経可塑性異常とうつ様行動にかかわるマイクロRNAの存在も示唆されている.慢性ストレス負荷マウスの海馬においてマイクロRNA-124の発現が低下し,この発現低下は慢性抗うつ薬投与によって回復していた10).海馬特異的にマイクロRNA-124を過剰発現させたマウスでは,慢性ストレス負荷後のうつ様行動の消失,すなわちレジリエンスが形成されていた.さらに,慢性ストレス負荷マウスにおける海馬歯状回神経細胞のスパイン密度の低下は,マイクロRNA-124の過剰発現により消失した.これらの結果は,マイクロRNA-124がストレス負荷後の神経可塑性ならびにストレス対処行動に対して重要な役割を担っていることを示唆している.
IV.気分障害とマイクロRNAとの関連
1.大うつ病性障害
モデル動物を用いた解析により,マイクロRNAのストレス脆弱性やうつ様行動との関連がうかがい知れるが,大うつ病性障害患者においてもマイクロRNAの発現・機能異常が報告されている.先述のマイクロRNA-124に関して,大うつ病性障害患者末梢血における発現異常は,寛解後では健常者と同レベルに回復することが報告されている9).また,米国の研究グループは,未治療の大うつ病性障害患者死後脳における21種類のマイクロRNAの発現変動を報告している7).さらに,1,088名の大うつ病性障害患者の遺伝子解析から,マイクロRNA-30e上の一塩基多型が疾患と有意な相関を示すことを見出している36).また,359名の大うつ病性障害患者の遺伝子解析においては,マイクロRNA-182上の一塩基多型が疾患と有意な相関を示すこと,このマイクロRNAの標的遺伝子が気分障害との関連が示唆されているサーカディアンリズム制御因子CLOCKであることを報告している25).これらの知見から,大うつ病性障害の病因・病態機序におけるマイクロRNAの関連が推測されるが,エビデンスはまだ乏しく,今後の大規模サンプルを用いた検討が待たれる.
最近,マイクロRNA-135aとうつ病との関連が注目されている.大うつ病性障害患者末梢血ならびに自殺者死後脳縫線核におけるマイクロRNA-135a発現量が減少していたこと,一方,選択的セロトニン再取り込み阻害薬(SSRI)投与マウスにおけるマイクロRNA-135aの発現量増加が報告された12).さらに,マイクロRNA-135aの標的遺伝子としてセロトニン1A受容体とセロトニントランスポーターが同定された.すなわち,うつ病患者の縫線核では,マイクロRNA-135aの発現低下によってセロトニン神経伝達の障害が生じるといった分子ルートの存在が示唆された.
抗うつ薬の作用機序に対するマイクロRNAの重要性も示唆されている2).マイクロRNA-16は青斑核ノルアドレナリン作動性神経細胞に高発現し,セロトニントランスポーターの発現を抑制している.しかし,SSRI投与によってノルアドレナリン作動性神経細胞におけるマイクロRNA-16の発現が低下すると,セロトニントランスポーターが高発現し,セロトニンの再取り込みという機能を新たに獲得する.一方,縫線核セロトニン作動性神経細胞では,SSRIによってマイクロRNA-16の発現が増加し,セロトニントランスポーターの発現が抑制される.すなわち,マイクロRNA-16によるセロトニントランスポーターの発現調節が抗うつ薬の作用機序の一端を担っている可能性を示唆している.このように,蛋白質に翻訳されないRNA分子によって,特定の細胞が本来有していない新たな機能を獲得することは驚きであり,さらに抗うつ薬がこのようなマイクロRNAを介した新規機能の獲得に寄与していることは,うつ病の病態や抗うつ薬の作用機序に対するマイクロRNAの関与を強く示唆している.
2.双極性障害
双極性障害とマイクロRNAとの関連性についても,いくつかの文献からうかがい知れる.双極性障害患者死後脳解析の結果,15種類のマイクロRNAの発現が健常者に比して有意に変化していたことが報告されている14).また,未治療の双極性障害患者末梢血を用いた解析においては,血漿中マイクロRNA-134レベルの有意な低下を認め,この変化は4週間の薬物治療により健常者レベル近くまでに回復していた24).この結果は,マイクロRNAの病態形成への関与のみならず生物学的マーカーとしての有用性も示唆している.動物実験において,リチウムやバルプロ酸投与後のラット脳海馬におけるマイクロRNA発現量を解析したところ,リチウム投与により37種類,バルプロ酸投与により31種類のマイクロRNAの発現量が変化していた37).興味深い点は,リチウムとバルプロ酸に共通して発現変動した9種類のマイクロRNAの標的遺伝子には,PKC,MAP kinase,Wnt/β-cateninといった,神経可塑性との関連ならびに双極性障害の病態や気分安定薬の作用機序との関連がすでに示唆されている因子が含まれていることである.このような知見は,マイクロRNAを介した遺伝子発現制御機構が双極性障害の病態や薬物反応に関与していることを示唆している.しかし,双極性障害の病態とマイクロRNAの発現異常との因果関係は不明である.また,双極性障害患者において認められたマイクロRNAの発現異常がこの疾患に特有のものであるのか,すなわち疾患特異性が存在するのかについても不明である.
おわりに
脳内マイクロRNAを介した遺伝子発現プログラム異常が,気分障害の病因・病態形成機序の一端を担っている可能性を示唆する知見が蓄積されつつある.しかし,マイクロRNAを含む非コードRNAの脳機能に対する役割,特に気分障害の病態に対する役割の解析はいまだ不明な部分が多く,死後脳や動物モデル,細胞レベルでのさらなる解析が必要である.マイクロRNAが神経細胞の形態変化を伴うシナプス可塑性を制御しているという事実は,精神疾患の病態と密接な関連があることが推測できる.マイクロRNAは数百種類という多数の遺伝子を標的としていると考えられている.また,それら標的遺伝子は組織や細胞特異性が存在することも知られている.これは,マイクロRNAの発現・機能異常が脳部位特有のさまざまな遺伝子群の発現調節にかかわっている可能性を秘めているが,現時点ではこれを支持するエビデンスは十分ではない.また,マイクロRNAがエクソソームによって他の標的組織・細胞へ運搬されることで機能を発揮している可能性が示唆されており,このようなマイクロRNAによる細胞機能の遠隔操作と高次脳機能に対する役割や精神疾患との関連性は興味深い.本論ではマイクロRNAを中心に概説したが,最近,長鎖RNAと精神疾患との関連も報告されている20).マイクロRNAのみならず長鎖RNAを含む非コードRNAの高次脳機能ならびに精神疾患の病態に対する役割の解析は始まったばかりであり,今後の詳細な検討が待たれる.
なお,本論文に関連して開示すべき利益相反はない.
1) Abe-Higuchi, N., Uchida, S., Yamagata, H., et al.: Hippocampal sirtuin 1 signaling mediates depression-like behavior. Biol Psychiatry, 80; 815-826, 2016![]()
2) Baudry, A., Mouillet-Richard, S., Schneider, B., et al.: miR-16 targets the serotonin transporter: a new facet for adaptive responses to antidepressants. Science, 329; 1537-1541, 2010![]()
3) Boyle, M. P., Brewer, J. A., Funatsu, M., et al.: Acquired deficit of forebrain glucocorticoid receptor produces depression-like changes in adrenal axis regulation and behavior. Proc Natl Acad Sci U S A, 102; 473-478, 2005![]()
4) Carninci, P., Kasukawa, T., Katayama, S., et al.: The transcriptional landscape of the mammalian genome. Science, 309; 1559-1563, 2005![]()
5) de Kloet, E. R., Joëls, M., Holsboer, F.: Stress and the brain: from adaptation to disease. Nat Rev Neurosci, 6; 463-475, 2005![]()
6) Duman, R. S., Aghajanian, G. K.: Synaptic dysfunction in depression:potential therapeutic targets. Science, 338; 68-72, 2012![]()
7) Dwivedi, Y.: Evidence demonstrating role of microRNAs in the etiopathology of major depression. J Chem Neuroanat, 42; 142-156, 2011![]()
8) Gao, J., Wang, W. Y., Mao, Y. W., et al.: A novel pathway regulates memory and plasticity via SIRT1 and miR-134. Nature, 466; 1105-1109, 2010![]()
9) He, S., Liu, X., Jiang, K., et al.: Alterations of microRNA-124 expression in peripheral blood mononuclear cells in pre- and post-treatment patients with major depressive disorder. J Psychiatr Res, 78; 65-71, 2016![]()
10) Higuchi, F., Uchida, S., Yamagata, H., et al.: Hippocampal microRNA-124 enhances chronic stress resilience in mice. J Neurosci, 36; 7253-7267, 2016![]()
11) Issler, O., Chen, A.: Determining the role of microRNAs in psychiatric disorders. Nat Rev Neurosci, 16; 201-212, 2015![]()
12) Issler, O., Haramati, S., Paul, E. D., et al.: MicroRNA 135 is essential for chronic stress resiliency, antidepressant efficacy, and intact serotonergic activity. Neuron, 83; 344-360, 2014![]()
13) Kang, H. J., Voleti, B., Hajszan, T., et al.: Decreased expression of synapse-related genes and loss of synapses in major depressive disorder. Nat Med, 18; 1413-1417, 2012![]()
14) Kim, A. H., Reimers, M., Maher, B., et al.: MicroRNA expression profiling in the prefrontal cortex of individuals affected with schizophrenia and bipolar disorders. Schizophr Res, 124; 183-191, 2010![]()
15) Labonté, B., Engmann, O., Purushothaman, I., et al.: Sex-specific transcriptional signatures in human depression. Nat Med, 23; 1102-1111, 2017![]()
16) Li, N., Liu, R. J., Dwyer, J. M., et al.: Glutamate NMDA receptor antagonists rapidly reverse behavioral and synaptic deficits caused by chronic stress exposure. Biol Psychiatry, 69; 754-761, 2011![]()
17) MacQueen, G., Frodl, T.: The hippocampus in major depression: evidence for the convergence of the bench and bedside in psychiatric research? Mol Psychiatry, 16; 252-264, 2011![]()
18) McGowan, P. O., Sasaki, A., D'Alessio, A. C., et al.: Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse. Nat Neurosci, 12; 342-348, 2009![]()
19) Nestler, E. J., Barrot, M., DiLeone, R. J., et al.: Neurobiology of depression. Neuron, 34; 13-25, 2002![]()
20) Parikshak, N. N., Swarup, V., Belgard, T. G., et al.: Genome-wide changes in lncRNA, splicing, and regional gene expression patterns in autism. Nature, 540; 423-427, 2016![]()
21) Perlman, W. R., Webster, M. J., Kleinman, J. E., et al.: Reduced glucocorticoid and estrogen receptor alpha messenger ribonucleic acid levels in the amygdala of patients with major mental illness. Biol Psychiatry, 56; 844-852, 2004![]()
22) Price, J. L., Drevets, W. C.: Neurocircuitry of mood disorders. Neuropsychopharmacology, 35; 192-216, 2010![]()
23) Rajkowska, G., Miguel-Hidalgo, J. J., Wei, J., et al.: Morphometric evidence for neuronal and glial prefrontal cell pathology in major depression. Biol Psychiatry, 45; 1085-1098, 1999![]()
24) Rong, H., Liu, T. B., Yang, K. J., et al.: MicroRNA-134 plasma levels before and after treatment for bipolar mania. J Psychiatr Res, 45; 92-95, 2011![]()
25) Saus, E., Soria, V., Escaramís, G., et al.: Genetic variants and abnormal processing of pre-miR-182, a circadian clock modulator, in major depression patients with late insomnia. Hum Mol Genet, 19; 4017-4025, 2010![]()
26) Schratt, G. M., Tuebing, F., Nigh, E. A., et al.: A brain-specific microRNA regulates dendritic spine development. Nature, 439; 283-289, 2006![]()
27) Stockmeier, C. A., Mahajan, G. J., Konick, L. C., et al.: Cellular changes in the postmortem hippocampus in major depression. Biol Psychiatry, 56; 640-650, 2004![]()
28) Tomari, Y., Zamore, P. D.: Perspective: machines for RNAi. Genes Dev, 19; 517-529, 2005![]()
29) Tsankova, N., Renthal, W., Kumar, A., et al.: Epigenetic regulation in psychiatric disorders. Nat Rev Neurosci, 8; 355-367, 2007![]()
30) Uchida, S., Hara, K., Kobayashi, A., et al.: Early life stress enhances behavioral vulnerability to stress through the activation of REST4-mediated gene transcription in the medial prefrontal cortex of rodents. J Neurosci, 30; 15007-15018, 2010![]()
31) Uchida, S., Hara, K., Kobayashi, A., et al.: Epigenetic status of Gdnf in the ventral striatum determines susceptibility and adaptation to daily stressful events. Neuron, 69; 359-372, 2011![]()
32) Uchida, S., Nishida, A., Hara, K., et al.: Characterization of the vulnerability to repeated stress in Fischer 344 rats: possible involvement of microRNA-mediated down-regulation of the glucocorticoid receptor. Eur J Neurosci, 27; 2250-2261, 2008![]()
33) Vreugdenhil, E., Verissimo, C. S., Mariman, R., et al.: MicroRNA 18 and 124a down-regulate the glucocorticoid receptor: implications for glucocorticoid responsiveness in the brain. Endocrinology, 150; 2220-2228, 2009![]()
34) Watanabe, Y., Gould, E., McEwen, B. S.: Stress induces atrophy of apical dendrites of hippocampal CA3 pyramidal neurons. Brain Res, 588; 341-345, 1992![]()
35) Wei, Q., Lu, X. Y., Liu, L., et al.: Glucocorticoid receptor overexpression in forebrain: a mouse model of increased emotional lability. Proc Natl Acad Sci U S A, 101; 11851-11856, 2004![]()
36) Xu, Y., Liu, H., Li, F., et al.: A polymorphism in the microRNA-30e precursor associated with major depressive disorder risk and P300 waveform. J Affect Disord, 127; 332-336, 2010![]()
37) Zhou, R., Yuan, P., Wang, Y., et al.: Evidence for selective microRNAs and their effectors as common long-term targets for the actions of mood stabilizers. Neuropsychopharmacology, 34; 1395-1405, 2009![]()