【背景】強迫性障害に関する多くの脳画像研究によりその広範囲に及ぶ脳灰白質病変が指摘されてきたが,その結論はいまだ一致していない.この不一致の理由の1つに,強迫性障害の多様性が挙げられる.今回の研究でわれわれは,脳の解剖学的変化を強迫性障害の亜型により分類することを目標とした.【方法】3テスラの核磁気共鳴画像(MRI)装置を用いて,37名の強迫性障害患者と37名の適合させた健常対照者の脳画像撮像を行った.ボクセル単位形態計測にて,前処理を施した灰白質形態画像を用いて2つの集団の比較を行い,また,強迫性障害患者の局所的な灰白質体積と強迫症状の亜型との関連を調べるため,相関解析を行った.【結果】健常対照者と比較して強迫性障害患者で,左前頭前野,右眼窩前頭前野,右頭頂葉,右側頭葉,右後部帯状回に有意な体積減少を認めた.加えて,症状亜型別重症度と局所的な灰白質体積に負の相関が認められた.主に,“攻撃性・確認”症状と右小脳体積の減少,“汚染・洗浄”症状と右島皮質体積の減少である.【結論】強迫性障害の病態生理には広範囲な脳神経基盤が関与している可能性がある.さらに,症状亜型と形態異常にはそれぞれ関連があることが示唆された.
2)桶狭間病院藤田こころケアセンター
3)久留米大学文学部
4)九州大学大学院医学研究院臨床放射線科学
5)鹿児島大学放射線診断治療学
はじめに
強迫性障害(obsessive-compulsive disorder:OCD)は,典型的には,“強迫観念”と呼ばれる繰り返し起こる侵入的な思考とそれに続いて起こる不安や恐怖などの負の感情,およびそれから抜け出すために繰り返し行われる“強迫行為”で特徴づけられる疾患である.OCDの診断基準はそれを疾病分類学的に1つの疾患とみなしているが,症状や重症度,洞察の程度,薬物抵抗性などが多様であるという点で,不均一な疾患であると考えられる.
いくつかの機能的神経画像研究37)45)では前部帯状回や眼窩前頭前野(orbitofrontal cortex:OFC),視床,尾状核や被殻などの大脳基底核の異常が示唆されており,これは従来のOCDネットワークモデル38)として知られる眼窩前頭-線条体回路仮説を支持するものである.OCDにおける,上および中側頭皮質,下部頭頂葉,視床,視床下部,島などの構造的異常もまた,報告されてきた13)22)33)43).最近のボクセル単位形態計測(VBM)に基づいたメタ解析研究では,OCDにおける,両側レンズ核および尾状核領域で灰白質体積の増加,および背内側前頭回と前部帯状回領域での灰白質体積の減少を明らかにした34).われわれの研究班もまた,OCD患者では両側内側前頭前野,右運動前野,右OFC,右背外側前頭前野(dorsolateral prefrontal cortex:DLPFC),後頭葉領域にて灰白質体積が顕著に減少していることを報告している42).
臨床的な多様性と結びつけられるこれらの機能的神経画像研究および構造的神経画像研究結果における不一致は,OCDが均一な疾患ではなく不均一な異種性のある疾患であることを示しており,それはOCDの専門家たちが近年着目しているところでもある.
同様に臨床的な見地からも,OCDの症状は個々により複雑にかつ幅広く表現型が異なるため,カテゴリカルなアプローチ方法(確認強迫なのか洗浄強迫なのか,洞察良好か不良かなど)が,臨床的印象を直接反映し,かつ診断と治療に実用的な程度に疾患間の鑑別を行うという点で有用である.このアプローチ法はしかしながら,診断閾値が曖昧であるため閾値下のOCD症状を除外できないという点において限界がある.精神疾患の診断にはカテゴリカルなアプローチが有利であるが,一方でよりよい感度をもつのは次元的(ディメンジョナル)なアプローチである.精神医学の研究においては,精神症状を正常から異常への連続体として捉える方がより真実へ近づくと考えられる.このような理由から,多くの研究者たちが精神疾患の診断に対する次元的なアプローチの重要性を強調している.OCDにおいても同様に,ディメンジョナルモデルの方が,診断の移行や二重診断なしに,カテゴリカルモデルでは見逃されていた閾値下のOCD症状を取りあげるのに有効であり,個々のOCDの状態をより正確に評価することにも役立つ.
今日までに,イェール・ブラウン強迫症状尺度チェックリスト(Yale-Brown Obsessive-Compulsive Scale:Y-BOCSチェックリスト)内に含まれている13カテゴリを用いたOCDの因子分析5)15)18)20)では,3~6個程度の次元因子が確認されており,OCDに対する次元的なアプローチの有効性が示唆されている.Mataix-Colsらは,認知および感情の処理を司る前頭皮質-線条体-視床-皮質回路内における異なる神経機構が,OCDの各々の症状を引き起こしているのではないかと提言した19).その後多くの機能的神経画像研究および形態的神経画像研究3)11)24)33)にて,症状次元に関連した脳活動が調査され,症状次元にそれぞれ異なった神経基盤が関連しているという,OCDの多様性を支持する結果であった.
今回の研究30)でわれわれは,OCDの症状次元を評価する尺度であるディメンジョナルイェール・ブラウン強迫症状尺度(Dimensional Yale-Brown Obsessive-Compulsive Scale:DY-BOCS)36)を採用した.これは,強迫症状を,同テーマごとの強迫観念と強迫行為(①攻撃性/確認,②性的/道徳的/宗教的,③対称性/整頓/数数え,④不潔/洗浄,⑤溜め込み,⑥その他)の6つの異なった症状次元に分けており,特徴を捉え,Y-BOCSのもつ潜在的な曖昧さを解決するのに十分感度がよく,それぞれの症状次元の重症度を量的に評価することができるものである.今回われわれは,それぞれの症状次元における灰白質の体積変化をVBMアプローチにて明らかにし,それぞれに固有の脳活動を有意な中間表現型として突き止めることを目的とした.先行研究19)32)に基づき,特に,前頭前野腹内側部および辺縁系における灰白質体積が洗浄行為に関連した嫌悪感や不安などの情緒的な過程に,そして,基底核領域および背側前頭前野の灰白質体積が確認行為に関連した認知・運動機能に携わっているという仮説を立てた.
I.方法および結果
1.対象者
DSM-IV(Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition)にてOCDの診断基準を満たした37名の患者と,年齢性別を合わせた37名の健常者がこの研究に参加した.OCDの患者は九州大学病院精神神経科の外来および入院患者の中から,健常者は地域から募った.OCDの診断は,熟練した精神科医によるDSM-IV日本語版を用いた構造化面接にて確定された.OCD患者は22~58歳であり,I軸疾患の併存(大うつ病を除く),神経疾患,頭部外傷,重症の身体状況,臨床的に明らかな物質またはアルコール依存の既往,および核磁気共鳴画像(MRI)装置への禁忌患者は除外した.
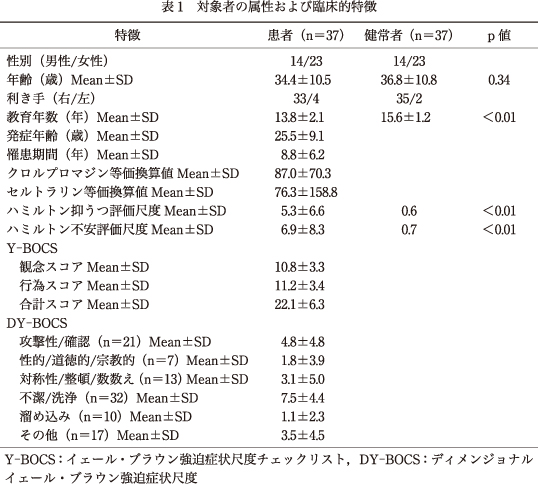
OCD症状の全体的な重症度を評価するのにY-BOCSを用い,攻撃性/確認,性的/道徳的/宗教的,対称性/整頓/数数え,不潔/洗浄,溜め込み,その他,の6つのOCD症状次元の有無およびそれぞれの重症度を評価するのにDY-BOCSを用いた.DY-BOCSのそれぞれの次元での点数は,0点(全くない)から15点(非常に重症)までの範囲にわたっている.健常者は22~60歳であり,重症な身体疾患および精神疾患の既往はなかった.すべての研究参加者に対し,ハミルトン抑うつ評価尺度(HDRS)を用いて抑うつの程度を評価,ハミルトン不安評価尺度(HARS)を用いて不安の程度を評価,エジンバラ調査尺度を用いて利き手を評価した.
2.倫理表明
この研究計画書および同意書は,九州大学病院倫理審査委員会にて承認された(番号:22-111).全ての参加者に対し当研究の説明を行った後,書面にて同意を得た.
3.MRI撮像
全ての参加者に対して,九州大学病院放射線科にて,3テスラのMRI装置(Achieva TX,Philips Healthcare,Best,オランダ製)を用いて標準的な頭部コイルで脳形態画像撮像を行った.T1強調画像は,以下の条件下でのT1強調3次元turbo field echoシーケンスにより得られた(繰り返し時間8.2ミリ秒,エコー時間3.8ミリ秒,フリップ角度8度,マトリックス240×240,反転時間1,026ミリ秒,フィールドビュー240×240,NSA1,スライス厚1ミリ,スライス数190,撮像時間320秒).
4.データ解析
得られた画像をまず,dcm2niiソフトウェアを用いてDICOM形式からNifTI-1形式に変換した.データ解析および検討は,MATLAB(2011bバージョン)上にてSPM8(Statistical Parametric Mapping 2008)ソフトウェア(The auspices of the Functional Imaging Laboratory,The Wellcome Trust Centre for Neuroimaging,in the Institute of Neurology at University College Londonにて開発されたもの)を用いて行った.全てのT1強調画像に対し,自動処理にてAC-PC(AC=anterior commissure,PC=posterior commissure)位置合わせを行った.次に,VBMの手順で使用する形態画像の前処理のため,VBM8ツールボックスを使用した.このVBM8ツールボックスの処理手順には,バイアス補正,脳組織分類,線形変換(12パラメーターアフィン変換)および非線形変換を用いたMontreal Neurological Institute(MNI)基準への標準化が含まれている.分割化の際のバイアスがより少ないとされている高次元画像標準化法DARTELが,VBM8ツールボックスで提供されている基準テンプレートとともに,解剖学的位置合わせに用いられた.灰白質と白質の区分けは非線形要素のみで調整されたため,個々の脳体積で補正された組織の絶対容量を比較することを可能にした.つまり,この手順は全脳体積補正を含んでいるため,異なる脳体積に対する追加補正をする必要がない.最後に,調整された脳画像データに対し,半値幅(full width half maximum:FWHM)8 mmのGaussian kernelでの空間的平滑化を行った.線形調整の際に欧州人脳の代わりに東アジア人脳テンプレートを用いた以外は,全ての過程にて標準パラメーターを使用した.
5.統計解析
対象者全ての個々のデータを処理した後,OCD患者-健常者の2群に分けた.灰白質体積の2群間比較として,ボクセル単位での共分散分析をSPM8にて行った.MRI撮像時の年齢,性別,およびハミルトン抑うつ評価尺度スコアが,共変量として入力された.OCD患者における向精神薬の影響を調べるため,灰白質体積と,抗精神病薬等価用量としてのクロルプロマジン等価換算値,および抗うつ薬等価用量としてセルトラリン等価換算値との相関解析を追加で行った.
次に,OCD患者における灰白質体積とDY-BOCSの各スコアとの相関を調べるため,回帰分析を行った.年齢,性別,Y-BOCSおよびハミルトン抑うつ評価尺度スコア,その他の症状次元スコアを,共変量として入力した.さらに事後比較解析として,OCD症状次元スコアと,はじめに仮説を立てた部位の灰白質体積との関連を調べるため,関心領域法(ROI)も行った.
上記の全ての解析において,統計学的に有意な閾値としてp<0.001(補正なし)を使用し,全てに両側p値を適応した.次に,MNI座標からTalairach座標に変換するためBrett変換を用いて計算し,解剖学的部位を突き止めた.
6.対象者の属性および臨床的特徴
対象者の属性および臨床的特徴の詳細を表1に示す.OCD患者および健常者間にて,教育年数以外の,年齢,性別,および利き手では有意差はみられなかった.当研究の時点で,5名の患者(14%)に大うつ病の併存が認められた.3名の患者が薬剤なし,32名の患者が抗うつ薬内服中(選択的セロトニン再取り込み阻害薬26名,セロトニン・ノルアドレナリン再取り込み阻害薬1名,三環系抗うつ薬5名),2名の患者が抗精神病薬のみ内服中であった.
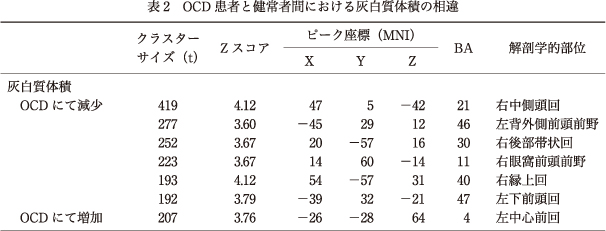
7.OCD患者と健常者間における灰白質体積の相違
健常者群と比較してOCD患者群では,右中側頭回,左背外側前頭前野(DLPFC),右後部帯状回(PCC),右眼窩前頭前野(OFC),右縁上回,左下前頭回に有意な灰白質体積減少を認めた.一方,左中心前回では灰白質体積の増加を認めた(表2).また,OCD患者における灰白質体積と,クロルプロマジン等価換算値およびセルトラリン等価換算値との相関解析においては,セルトラリン等価換算値と右上側頭回(Z score=137,MNI coordinates=52,-35,14),左小脳扁桃(Z score=284,MNI coordinates=-44,-64,-46),および左楔前部(Z score=413,MNI coordinates=-34,-74,34)の灰白質体積との負の相関のみ認めた.
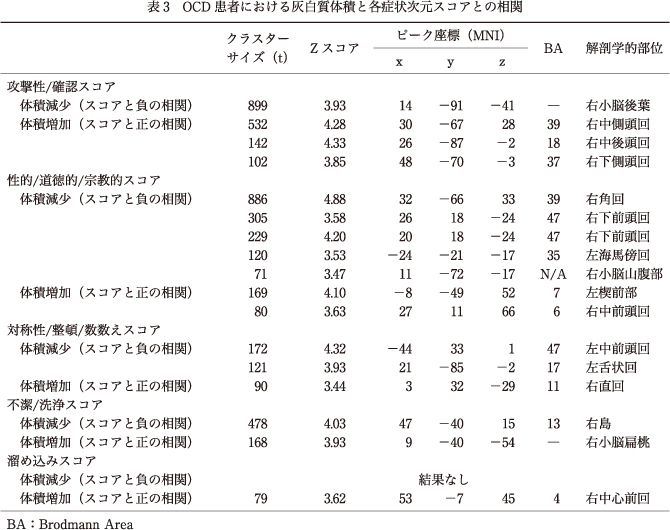
8.OCD患者における灰白質体積と各症状次元スコアとの相関
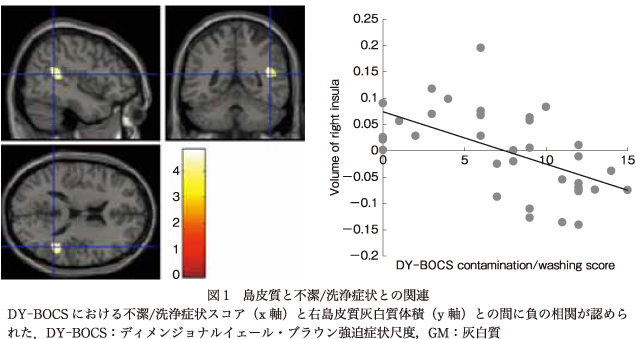
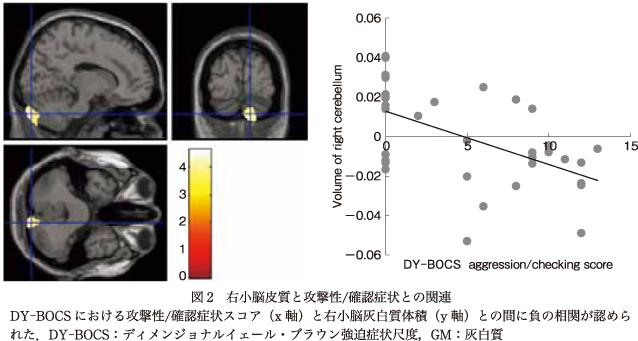
主に,右小脳と“攻撃性/確認”スコア,右前島部と“不潔/洗浄”スコアとの間に症状次元スコアと灰白質体積の負の相関を認めた.また,右中側頭回と“攻撃性/確認”スコアとの間に症状次元スコアと灰白質体積の正の相関を認めた.関心領域法においては,前頭前野腹内側部および辺縁系と“不潔/洗浄”スコア間,また基底核領域および背側前頭前野と“攻撃性/確認”スコア間のような,症状次元に関連した有意な灰白質体積減少は認めなかった(表3,図1, 図2).
II.考察
1.健常者と比較しOCD患者全体に共通する神経基盤
当研究において,OCD患者では健常者と比較して,左DLPFC/ブロードマンエリア(BA)46,右OFC/BA11,左下前頭回/BA47,右縁上回/BA40,右中側頭回/BA21,および右PCC/BA30などの広範な灰白質部位で有意な体積減少がみられた.
OFCは,他の前頭前野や辺縁系,感覚野および運動野などと線維結合をもち,行動の感情的側面や動機づけに重要な役割を担っているとされている7).ポジトロン断層撮像法(PET)と単一光子放射断層撮影(SPECT)を使用した脳神経画像研究のメタ解析から,OCD患者におけるOFC機能の異常が一致した見解として得られている45).機能的MRIを用いた先行脳神経画像研究の多くもまた,OCD症状誘発の際のOFCや尾状核,視床,前部帯状回における機能異常を明らかにした1)47).OFCの機能異常が適切な治療の後に正常化したとの報告28)もまた,OFCの機能異常がOCDの神経心理学的および臨床的特徴に本質的な影響を及ぼしているとの仮説を支持するものである.しかしながらVBMのメタ解析研究では,OFCの有意な構造的異常は認められていない34).この陰性所見はOFCのもつ代償的かつ可逆的メカニズムによるのではないかとされている.当論点においては,注意深い解釈とさらなる研究による考察を要する.
一方,DLPFCは選択的注意実行の側面に,またPCCと側頭葉皮質は視空間処理の過程に,役割を担っているとされている14).またいくつかの構造的MRIを用いた研究は,OCD患者およびその近縁者双方の頭頂葉皮質に灰白質異常がみられたと報告し,OCDにおける潜在的な反応抑制機能異常の存在を示唆している13)43).
メタ解析研究から提唱された改正版のOCDネットワークモデルでは,従来のネットワークモデルでいわれていた眼窩前頭-線条体回路および関連する辺縁系領域だけでなく,頭頂葉皮質,後頭葉皮質および小脳などのより広範囲に及ぶ灰白質異常がOCDの病態生理に関連しているとされる23).当研究でもわれわれは,OCD患者において頭頂葉,側頭葉およびPCCを含むそれらの領域に構造的異常を見出し,これらの領域がOCDの病態生理に関連する可能性を示唆した.
2.OCD患者において症状次元ごとにそれぞれ異なる神経基盤
次元的アプローチを用いてわれわれは,辺縁系と関連する島皮質体積と“不潔/洗浄”症状間,また小脳および中側頭回と“攻撃性/確認”症状間といった,灰白質体積と症状次元との間に特定の関連を認めた.これは,特定の脳領域が症状次元ごとに異なる病態生理に関与する可能性を示唆しており,これは先行研究にても報告されていることである3)19)44).
OCD患者の島皮質における形態的異常および器質的異常もまた,いくつかの先行研究にて報告されている17)19)26)33)35).島皮質は知覚情報と感情・認知処理とを統合する重要な役割を担うとされている4)25).
機能神経画像技術を用いた研究により,感情処理の過程の中でも,嫌悪感は主に島皮質と線条体(特にOCDの神経病理に関連が示唆されている部位)により媒介されている2)17)一方で,恐怖感や不安感は主に扁桃体(特に不安障害で関連が示唆されている部位9))により媒介されていることが示された8)16).さらに,主に洗浄強迫症状を呈するOCD患者では健常者と比較して,恐怖感を惹起する画像よりも嫌悪感を惹起する画像を見たときに,より右島における活動量が増加していたとの報告もある40).機能的MRI研究では,嫌悪感を表した顔の表情を見たときおよび悪臭を嗅いだことで嫌悪感が惹起されたときの双方で,島の活動量が増加したと報告されている46).島皮質の後部と前部では機能的に異なった役割を担うとされている.島後部は視床からの内受容信号を受け取る役割であるのに対し,島前部は主観的感情とともにその信号を再表出する役割である.それゆえ,島前部は情緒機能により関連が強いのではないかと考えられている.さらなる脳神経画像研究では,健常者と比較してOCD患者では,嫌悪感を惹起する症状に無関係な題材からでさえ島前部の活動量増加が認められ39),このことはOCD患者のもつ負の身体的状況に対する過敏性を支持するものである.
われわれの結果でも,島皮質,特に前部において体積減少を認めており,島がOCDの病態生理において特に汚染および洗浄儀式での嫌悪感に関与することを示したこれまでの機能的脳神経画像研究の知見を増強するものであった.
われわれの結果ではまた,攻撃性/確認症状次元スコアと小脳皮質との間に,負の相関を認めた.これまでの神経心理学研究12)27)31)において,主に確認症状を呈するOCD患者では,確認症状のない患者と比較して,抑制機能や認知の柔軟性,記憶などの認知機能に明らかな障害がみられたとされ,これは,認知機能の面からみてもOCD亜型の中で異なった神経基盤が存在することを示唆するものであった.一方,他の研究において,OCD患者の小脳に形態的および機能的異常が存在するのではないかと報告されている6)10)33).以前にわれわれの研究班もまた,OCD患者において,認知タスク中の小脳活動量が適切な治療の後には増加したとの報告をしている28).小脳は,一般的にいわれる協調運動での役割のほか,高次認知機能にも関連があるとされており41),これらを考えあわせるとつまり,攻撃性/確認症状を呈するOCD患者では確認する動機にかかわらず,特に小脳での何らかの異常に起因する神経認知機能の障害が存在する可能性があるといえた.
また攻撃性/確認スコアと右中側頭回体積との間に正の相関という結果が得られた.中側頭回は複数の感覚の統合などを司るとされる部位である.当研究とは結果の方向が異なるものの,過去のVBMを用いた先行研究でも確認強迫スコアと両側側頭葉体積間の負の相関が報告されている44).同症状次元と側頭葉との関連が示唆されるところであり,今後さらなる知見の集積が期待される.
3.長所および問題点
主な長所を以下に列挙する.①比較的大人数の対象者間で,次元的アプローチを用いて各症状次元での灰白質体積変化を調べた.汚染/洗浄症状と島皮質体積間に強い相関を認め,これは,汚染/洗浄症状と強い嫌悪感が関連しており主に島皮質が媒介しているのではないかとの,われわれの当初の仮説を支持するものであった.②3.0テスラのMRI装置にて撮像した後,個人の全体脳を評価するためVBM法を適応した.これは,関心領域法の欠点をカバーするものであった.
一方,当研究の結果を解釈するにはいくつかの問題点を考慮する必要性がある.①研究参加時点で,5名の患者(14%)に大うつ病の併存を認めた.大うつ病では内側前頭前野皮質などの特定の領域に体積減少が生じる可能性がある.しかし,抑うつの影響については,ハミルトン抑うつ評価尺度スコアを統計解析の際に共変量として入力し,補正している.②37名の患者中34名という大多数が,過去または研究参加時点で服薬をしていた.われわれは,灰白質体積と,クロルプロマジン等価換算値およびセルトラリン等価換算値との相関解析を追加で行い,右上側頭回,左小脳扁桃および左楔前部灰白質体積と,セルトラリン等価換算値の負の相関を認めた.これらの部位は抗うつ薬内服と関連するとされる部位とは異なっているものの,当研究の結果に内服治療が影響を及ぼしている可能性を否定できず,また先行研究の結果と異なっている原因の1つであるかもしれない.今後,内服をしていない十分な数の対象者においてさらなる研究が必要である.③確認症状次元においては,これまでの知見として,扁桃体や海馬,前部側頭極を含む辺縁系の関連が強く示唆されている.当研究にてこれらの部位での結果を欠いた原因として,対象者の数が不十分であること,対象者の多様性,方法論的相違が考えられた.④次元解析において,多くの患者が0点を示した,性的/道徳的/宗教的,対称性/整頓/数数え,溜め込み症状次元においては,信頼に足る重回帰分析が不可能であった.⑤結果を注意深く解釈するにあたり,両グループ間での教育年数および利き手の差は考慮する必要がある.
おわりに―今後の展望―
今回の研究30)では,OCDの病態生理には従来の眼窩前頭-線条体ネットワークモデルだけでなく,外側前頭前野,側頭葉,および頭頂葉などの広範囲な脳神経基盤が関与している可能性があることを提言した.さらに各症状亜型と形態異常,特に“汚染/洗浄”症状と右島皮質体積,および“攻撃性/確認”症状と右小脳体積,でそれぞれに相関を認めた.
OCDの病態生理に関与するものとして,これまでの数多くの画像研究からはおおむね眼窩前頭-線条体ネットワークの異常が一致した知見である.2014年に発表されたメガ解析研究では,これまで繰り返し報告されてきたOFCの異常が改めて報告された10).しかし当分野は,異常の方向性や上記以外の部位での異常所見の示唆など,当研究も含め統一見解のいまだ得られていない分野である.より高解像度での撮像や大規模な被験者数,症状タイプや服薬歴を考慮するなどの患者背景の統一といった,よりブラッシュアップされた研究が望まれる.さらに,形態画像においてはMRIを用いた白質・神経線維および灰白質画像解析研究,機能画像においてはMRIおよびPET/SPECTを用いた課題誘発型研究,MRIを用いた安静時機能画像解析研究,近年注目されているMRS研究など,複数のモダリティを用いての研究も待たれるところである.
またこれまでの家族研究・双生児研究においてOCDでは遺伝負因が高いことが報告されており29),分子遺伝学研究においてはセロトニンやドパミン関連遺伝子多型との関連が示唆されている21).我々の研究グループでも脳形態画像をエンドフェノタイプとして疾患の有無と候補遺伝子多型の関連を調べ,遺伝子多型脳構造画像と遺伝子との関連解析研究を行った結果,各遺伝子多型の種類,特に5-HTTLPRおよび5-HTTin2VNTR,DAT-VNTRに関して,OCD群-健常群間において局所の体積分布に差異を認めた(未発表データ).今後,このように遺伝学的研究・薬理学的研究などさまざまな角度からのアプローチを組み合わせることにより,OCDのより包括的な理解が得られると考える.
本論文は,PCN誌に掲載された最新の研究論文30)を編集委員会の依頼により,著者の1人が日本語で書き改め,その意義と展望などにつき加筆したものである.
なお,本論文に関連して開示すべき利益相反はない.
1) Adler, C. M., McDonough-Ryan, P., Sax, K. W., et al.: fMRI of neuronal activation with symptom provocation in unmedicated patients with obsessive compulsive disorder. J Psychiatr Res, 34 (4-5); 317-324, 2000![]()
2) Adolphs, R., Tranel, D., Damasio, A. R.: Dissociable neural systems for recognizing emotions. Brain Cogn, 52 (1); 61-69, 2003![]()
3) Alvarenga, P. G., do Rosário, M. C., Batistuzzo, M. C., et al.: Obsessive-compulsive symptom dimensions correlate to specific gray matter volumes in treatment-naïve patients. J Psychiatr Res, 46 (12); 1635-1642, 2012![]()
4) Augustine, J. R.: Circuitry and functional aspects of the insular lobe in primates including humans. Brain Res Brain Res Rev, 22 (3); 229-244, 1996![]()
5) Bloch, M. H., Landeros-Weisenberger, A., Rosario, M. C., et al.: Meta-analysis of the symptom structure of obsessive-compulsive disorder. Am J Psychiatry, 165 (12); 1532-1542, 2008![]()
6) Busatto, G. F., Buchpiguel, C. A., Zamignani, D. R., et al.: Regional cerebral blood flow abnormalities in early-onset obsessive-compulsive disorder: an exploratory SPECT study. J Am Acad Child Adolesc Psychiatry, 40 (3); 347-354, 2001![]()
7) Cavada, C., Company, T., Tejedor, J., et al.: The anatomical connections of the macaque monkey orbitofrontal cortex. A review. Cereb Cortex, 10 (3); 220-242, 2000![]()
8) Davis, M.: Neurobiology of fear responses: the role of the amygdala. J Neuropsychiatry Clin Neurosci, 9 (3); 382-402, 1997![]()
9) Davis, M., Whalen, P. J.: The amygdala: vigilance and emotion. Mol Psychiatry, 6 (1); 13-34, 2001![]()
10) de Wit, S. J., Alonso, P., Schweren, L., et al.: Multicenter voxel-based morphometry mega-analysis of structural brain scans in obsessive-compulsive disorder. Am J Psychiatry, 171 (3); 340-349, 2014![]()
11) Harrison, B. J., Pujol, J., Cardoner, N., et al.: Brain corticostriatal systems and the major clinical symptom dimensions of obsessive-compulsive disorder. Biol Psychiatry, 73 (4); 321-328, 2013![]()
12) Hoenig, K., Hochrein, A., Muller, D. J., et al.: Different negative priming impairments in schizophrenia and subgroups of obsessive-compulsive disorder. Psychol Med, 32 (3); 459-468, 2002![]()
13) Kim, J. J., Lee, M. C., Kim, J., et al.: Grey matter abnormalities in obsessive-compulsive disorder: statistical parametric mapping of segmented magnetic resonance images. Br J Psychiatry, 179; 330-334, 2001![]()
14) Kravitz, D. J., Saleem, K. S., Baker, C. I., et al.: A new neural framework for visuospatial processing. Nat Rev Neurosci, 12 (4); 217-230, 2011![]()
15) Leckman, J. F., Grice, D. E., Boardman, J.: Symptoms of obsessive-compulsive disorder. Am J Psychiatry, 154 (7); 911-917, 1997![]()
16) LeDoux, J.: Fear and the brain: where have we been, and where are we going? Biol Psychiatry, 44 (12); 1229-1238, 1998![]()
17) Mataix-Cols, D., An, S. K., Lawrence, N. S., et al.: Individual differences in disgust sensitivity modulate neural responses to aversive/disgusting stimuli. Eur J Neurosci, 27 (11); 3050-3058, 2008![]()
18) Mataix-Cols, D., Rauch, S. L., Manzo, P. A., et al.: Use of factor-analyzed symptom dimensions to predict outcome with serotonin reuptake inhibitors and placebo in the treatment of obsessive-compulsive disorder. Am J Psychiatry, 156 (9); 1409-1416, 1999![]()
19) Mataix-Cols, D., Wooderson, S., Lawrence, N., et al.: Distinct neural correlates of washing, checking, and hoarding symptom dimensions in obsessive-compulsive disorder. Arch Gen Psychiatry, 61 (6); 564-576, 2004![]()
20) Matsunaga, H., Maebayashi, K., Hayashida, K., et al.: Symptom structure in Japanese patients with obsessive-compulsive disorder. Am J Psychiatry, 165 (2); 251-253, 2008![]()
21) Mattheisen, M., Samuels, J. F., Wang, Y., et al.: Genome-wide association study in obsessive-compulsive disorder: results from the OCGAS. Mol Psychiatry, 20; 337-344, 2015![]()
22) Menzies, L., Achard, S., Chamberlain, S. R., et al.: Neurocognitive endophenotypes of obsessive-compulsive disorder. Brain, 130 (12); 3223-3236, 2007![]()
23) Menzies, L., Chamberlain, S. R., Laird, A. R., et al.: Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: the orbitofronto-striatal model revisited. Neurosci Biobehav Rev, 32 (3); 525-549, 2008![]()
24) Murayama, K., Nakao, T., Sanematsu, H., et al.: Differential neural network of checking versus washing symptoms in obsessive-compulsive disorder. Prog Neuropsychopharmacol Biol Psychiatry, 40C; 160-166, 2012
25) Nagai, M., Kishi, K., Kato, S.: Insular cortex and neuropsychiatric disorders: a review of recent literature. Eur Psychiatry, 22 (6); 387-394, 2007![]()
26) Nakamae, T., Narumoto, J., Sakai, Y., et al.: The neural basis of dysfunctional beliefs in non-medicated patients with obsessive-compulsive disorder. Prog Neuropsychopharmacol Biol Psychiatry, 37 (1); 22-25, 2012![]()
27) Nakao, T., Nakagawa, A., Nakatani, E., et al.: Working memory dysfunction in obsessive-compulsive disorder: a neuropsychological and functional MRI study. J Psychiatr Res, 43 (8); 784-791, 2009![]()
28) Nakao, T., Nakagawa, A., Yoshiura, T., et al.: Brain activation of patients with obsessive-compulsive disorder during neuropsychological and symptom provocation tasks before and after symptom improvement: a functional magnetic resonance imaging study. Biol Psychiatry, 57 (8); 901-910, 2005![]()
29) Nestadt, G., Lan, T., Samuels, J., et al.: Complex segregation analysis provides compelling evidence for a major gene underlying obsessive-compulsive disorder and for heterogeneity by sex. Am J Hum Genet, 67; 1611-1616, 2000![]()
30) Okada, K., Nakao, T., Sanematsu, H., et al.: Biological heterogeneity of obsessive-compulsive disorder: A voxel-based morphometric study based on dimensional assessment. Psychiatry Clin Neurosci, 69 (7); 411-421, 2015![]()
31) Omori, I. M., Murata, Y., Yamanishi, T., et al.: The differential impact of executive attention dysfunction on episodic memory in obsessive-compulsive disorder patients with checking symptoms vs. those with washing symptoms. J Psychiatr Res, 41 (9); 776-784, 2007![]()
32) Phillips, M. L., Marks, I. M., Senior, C., et al.: A differential neural response in obsessive-compulsive disorder patients with washing compared with checking symptoms to disgust. Psychol Med, 30 (5); 1037-1050, 2000![]()
33) Pujol, J., Soriano-Mas, C., Alonso, P., et al.: Mapping structural brain alterations in obsessive-compulsive disorder. Arch Gen Psychiatry, 61 (7); 720-730, 2004![]()
34) Radua, J., Mataix-Cols, D.: Voxel-wise meta-analysis of grey matter changes in obsessive-compulsive disorder. Br J Psychiatry, 195 (5); 393-402, 2009![]()
35) Remijnse, P. L., Nielen, M. M., van Balkom, A. J., et al.: Reduced orbitofrontal-striatal activity on a reversal learning task in obsessive-compulsive disorder. Arch Gen Psychiatry, 63 (11); 1225-1236, 2006![]()
36) Rosario-Campos, M. C., Miguel, E. C., Quatrano, S., et al.: The Dimensional Yale-Brown Obsessive-Compulsive Scale (DY-BOCS): an instrument for assessing obsessive-compulsive symptom dimensions. Mol Psychiatry, 11 (5); 495-504, 2006![]()
37) Saxena, S., Brody, A. L., Ho, M. L., et al.: Cerebral metabolism in major depression and obsessive-compulsive disorder occurring separately and concurrently. Biol Psychiatry, 50 (3); 159-170, 2001![]()
38) Saxena, S., Brody, A. L., Schwartz, J. M., et al.: Neuroimaging and frontal-subcortical circuitry in obsessive-compulsive disorder. Br J Psychiatry Suppl(35); 26-37, 1998
39) Schienle, A., Schäfer, A., Stark, R., et al.: Neural responses of OCD patients towards disorder-relevant, generally disgust-inducing and fear-inducing pictures. Int J Psychophysiol, 57 (1); 69-77, 2005![]()
40) Shapira, N. A., Liu, Y., He, A. G., et al.: Brain activation by disgust-inducing pictures in obsessive-compulsive disorder. Biol Psychiatry, 54 (7); 751-756, 2003![]()
41) Tanaka, H., Harada, M., Arai, M., et al.: Cognitive dysfunction in cortical cerebellar atrophy correlates with impairment of the inhibitory system. Neuropsychobiology, 47 (4); 206-211, 2003![]()
42) Togao, O., Yoshiura, T., Nakao, T., et al.: Regional gray and white matter volume abnormalities in obsessive-compulsive disorder: a voxel-based morphometry study. Psychiatry Res, 184 (1); 29-37, 2010![]()
43) Valente, A. A., Jr., Miguel, E. C., Castro, C. C., et al.: Regional gray matter abnormalities in obsessive-compulsive disorder: a voxel-based morphometry study. Biol Psychiatry, 58 (6); 479-487, 2005![]()
44) van den Heuvel, O. A., Remijnse, P. L., Mataix-Cols, D., et al.: The major symptom dimensions of obsessive-compulsive disorder are mediated by partially distinct neural systems. Brain, 132 (Pt 4); 853-868, 2009![]()
45) Whiteside, S. P., Port, J. D., Abramowitz, J. S.: A meta-analysis of functional neuroimaging in obsessive-compulsive disorder. Psychiatry Res, 132 (1); 69-79, 2004![]()
46) Wicker, B., Keysers, C., Plailly, J., et al.: Both of us disgusted in my insula: the common neural basis of seeing and feeling disgust. Neuron, 40 (3); 655-664, 2003![]()
47) Zohar, J., Insel, T. R., Berman, K. F., et al.: Anxiety and cerebral blood flow during behavioral challenge. Dissociation of central from peripheral and subjective measures. Arch Gen Psychiatry, 46 (6); 505-510, 1989![]()