解離性麻酔薬(R, S)-ケタミンは,難治性うつ病患者に単回投与で即効性の抗うつ効果,および希死念慮・自殺願望の低下を示す.現在,(R, S)-ケタミンは最も注目されている抗うつ薬候補である.一方,(R, S)-ケタミンは投与直後に精神病症状や解離症状を引き起こすこと,および繰り返し投与による薬物依存などの問題が解決していないにもかかわらず,米国では適応外使用が日常的に行われている.2019年3月5日,米国FDAは,ヤンセン社の(S)-ケタミン点鼻薬を難治性うつ病の追加治療薬として承認した.しかしながら,(S)-ケタミン点鼻薬に関する問題点も指摘されている.著者らはもう1つの光学異性体(R)-ケタミンのほうが(S)-ケタミンより抗うつ効果が強く,副作用が少ないことを報告した.現在,海外企業とともに,新規抗うつ薬として臨床治験を開始している.本稿において,難治性うつ病の画期的な治療薬として期待されているケタミンの光学異性体について議論したい.
はじめに
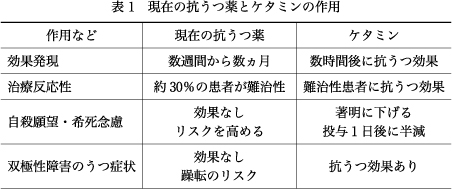
世界保健機関(World Health Organization:WHO)の報告では,世界中で3億人以上がうつ病に罹患しており,年間80万人が自ら命を絶っている.うつ病の治療には,抗うつ薬などが使用されるが,現在の抗うつ薬は,モノアミン系(セロトニンやノルエピネフリンなど)に主に作用する薬剤である.表1に示すように,現在の抗うつ薬は,効果発現が遅く,既存の抗うつ薬に奏効しない難治性うつ病が約30%存在する.また現在の抗うつ薬は,自殺願望・希死念慮には効果がない.さらに抗うつ薬は双極性障害のうつ症状には効果がなく,躁転のリスクを高めることが知られている.
一方,解離性麻酔薬ケタミンは現在の抗うつ薬の問題点をすべて解決する画期的な薬理作用を有していることが海外の臨床研究から報告されている(表1).すなわち,現在のうつ病治療のアンメットニーズに最も期待されている薬剤である.欧米では,ケタミンの抗うつ効果は,気分障害研究の歴史において,過去60年間で最も大きな発見,あるいは精神医学分野ではクロルプロマジン以来の発見とまでいわれている17).
本稿では,難治性うつ病の治療薬として期待されているケタミンの最新情報を報告する.ケタミンの抗うつ薬に関する詳細な総説は,本学会の英文誌(Psychiatry and Clinical Neuroscience)の2019年10号に掲載されているので,興味のある方は参照されたい11).
I.ケタミンの抗うつ作用の歴史
ケタミンは,1962年に米国製薬企業Park Davis社において麻酔薬フェンサイクリジン(phencyclidine:PCP)の代用品として合成された.1964年に米国ミシガン大学のEdward F. Domino博士らによって,健常者(囚人)に最初に投与された.ケタミン投与後の症状(幽体離脱などの解離症状など)から,解離性麻酔薬と命名された4).ケタミンは他の麻酔薬と比べて,呼吸抑制をしないため,WHOによる必須医薬品の一覧に加えられている.乱用薬物のため,わが国では2007年に麻薬指定された.
一方,PCPやケタミンなどは,1960年,1970年代に米国の若者などに広く乱用された.その際,ケタミン乱用者は,抗うつ効果を期待してケタミンを使用したケースが多かったことが,後のDomino博士の総説に記載されている4).一部の研究者は,薬物依存者に対してケタミンが,モノアミン系抗うつ薬と異なり,即効性の抗うつ効果を示すことに気がついていたようだ.Domino博士は,乱用薬物ケタミンが現在,難治性うつ病の画期的な治療薬として使用されていることに驚いていた.
さらに幻覚剤サイロシビンや合成麻薬MDMA(別名:エクスタシー)が,難治性うつ病やPTSDの新規治療薬として,米国食品医薬品局(Food and Drug Administration:FDA)より画期的治療薬指定を受け,現在臨床治験が進行中である.ケタミン同様,精神病症状を引き起こす規制薬剤で,精神疾患を治療しようとする流れが米国で加速しており,米国スタンフォード大学の研究者は,「Disruptive Psychopharmacology」という記事をJAMA Psychiatry誌に掲載した12).
ケタミンを健常者に投与すると統合失調症と酷似した陽性症状を引き起こすことは古くから知られており,統合失調症のNMDA受容体機能低下仮説につながっている4).1994年,米国イエール大学のグループは,健常者にケタミンを投与し,統合失調症と酷似した3つの症状(陽性症状,陰性症状,認知機能障害)を引き起こすことを報告している16).米国では現在でも,統合失調症のモデルとして,健常者にケタミンを投与する臨床研究が行われている.
2000年に,米国イエール大学の同グループが,ケタミンのプラセボ対照二重盲検試験(先の健常者に対する臨床研究と同じ投与条件)をうつ病患者で実施し,ケタミンの即効性および持続性の抗うつ効果を初めて科学的に報告した1).この論文以来,数多くの研究グループが難治性うつ病患者におけるケタミンの即効性抗うつ効果と持続効果を報告している.興味深いことに,ケタミンはうつ病患者の自殺願望・希死念慮を著明に下げることも報告された.例えば,米国コロンビア大学のグループは,ケタミンが別の麻酔薬ミダゾラムと比べて,希死念慮の高いうつ病患者の希死念慮を有意に下げることを報告した6).これまでいくつかのメタ解析で,ケタミンは難治性うつ病患者に対して,強力な即効性抗うつ効果およびその持続効果,希死念慮を低下させる効果が証明されている15)19)27).
II.難治性双極性障害患者のうつ症状に対するケタミンの抗うつ効果
表1に示したように,現在の抗うつ薬は,双極性障害患者のうつ症状には効果を示さないが,ケタミンは治療抵抗性の双極性障害患者のうつ症状に対しても,即効性の抗うつ効果を示すことが報告された.米国国立精神衛生研究所(National Institute of Mental Health:NIMH)のグループは,治療抵抗性の双極性障害患者を対象としたプラセボ対照二重盲検試験において,気分安定薬へのケタミンの追加投与は,有意な抗うつ効果と希死念慮の低下を示したことを報告した3).メタ解析からも,ケタミンは双極性障害のうつ症状にも有効であることが証明されている15)19).双極性障害患者のうつ症状は,難治性うつ病と誤診される場合も多く,大うつ病性患者のうつ症状と区別することが難しい場合もあるが,両疾患へのケタミンの即効性の抗うつ効果は注目に値する.
上述したように,ケタミンは難治性うつ病や双極性障害のうつ症状に即効性の抗うつ効果を示すことから,米国では1,000以上の医療機関で,ケタミンの適応外使用が行われている.ケタミン投与後の副作用(精神病症状惹起作用,解離症状,繰り返し投与による依存など)が解決していないにもかかわらず,米国の街中のケタミンクリニックなどで投与されているのが現状である22).
III.ケタミンの光学異性体
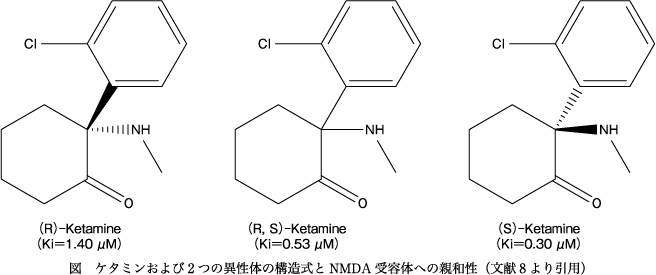
ケタミンは不斉炭素を有するため,2つの光学異性体を有する(図).NMDA受容体への親和性は,(S)体のほうが(R)体より3~4倍程度強いことが知られており,ヨーロッパや中国では(S)-ケタミンは麻酔薬(麻酔作用は,NMDA受容体遮断作用が関与)として使用されている.しかしながら,米国や日本では,(S)-ケタミンは麻酔薬として認可されていない.多くの研究者が,ケタミンの抗うつ作用は,NMDA受容体遮断作用によると信じており,いくつかの製薬企業が新規NMDA受容体拮抗薬を開発したが,第III相臨床治験でケタミン様の強力な抗うつ効果はなく,中止に追い込まれた8).選択的で強力なNMDA受容体遮断薬(+)MK-801もうつ病患者で抗うつ効果がないことが知られているが,論文発表されていない.
米国Johnson & Johnson社の子会社であるJanssen社は,NMDA受容体への親和性が強い(S)-ケタミンの点鼻薬を難治性うつ病患者の追加投与薬として開発し,2019年3月5日に米国FDAより承認を得た.しかしながら,副作用の問題から,(S)-ケタミンはリスク評価軽減戦略(risk evaluation and mitigation strategies:REMS)のもとで使用しなければならず,患者は点鼻薬を医師の診察室や医療機関において自分で投与できるが,自宅に持って帰ることは禁止されている.さらに(S)-ケタミンの抗うつ効果に関する問題点も指摘されている13)14)25).現在,日本,中国を含むアジア地区では,(S)-ケタミンの点鼻薬の臨床治験が実施中である.
著者は,2010年頃からケタミンの抗うつ作用に対するNMDA受容体遮断作用の関与を疑っていた.しかし,ケタミンは麻薬指定されており,光学異性体を入手することが不可能であるため,ケタミン注射液(商品名:ケタラール,第一三共株式会社)を大量に購入し,自ら光学分割を行った(著者は麻薬研究者の免許所有).うつ病の動物モデルを用いて,2つの光学異性体を比較すると,(R)-ケタミンが,(S)-ケタミンよりも抗うつ効果が強く,持続効果も長いことを報告した28)30)31)32)35).両異性体の薬物動態には差がないことから,両異性体の抗うつ効果の差は,薬物動態の寄与は低いと考えられた.NMDA受容体への親和性は,(S)体のほうが(R)体より3~4倍程度強いことから,ケタミンの抗うつ作用には,NMDA受容体以外の関与があると考えている.
上述したように,ケタミンは即効性抗うつ効果を示すが,ケタミンの副作用は臨床応用を考えた場合,大きな問題である.そのため動物を用いてケタミン異性体の副作用を比較した.その結果,精神病症状惹起作用の指標である運動量亢進作用,プレパルス抑制障害,前頭皮質におけるパルブアルブミン陽性細胞の低下は,(S)-ケタミンの単回投与および繰り返し投与で起きるが,(R)-ケタミンでは起きなかった2)28)29).(S)-ケタミンや(R, S)-ケタミンの投与では,ラット後部帯状回における熱ストレス蛋白(神経障害マーカー)の誘導が起きるが,(R)-ケタミンの投与では起きなかった24).場所嗜好性試験においては,(R, S)-ケタミンや(S)-ケタミンは場所嗜好性を増加させ,依存形成を起こすことが示唆されたが,(R)-ケタミンの投与では起きなかった2)28).
無麻酔サルPETを用いた研究から,(R)-ケタミンの静脈投与は,ドパミンD2受容体に影響を与えないが,(S)-ケタミンの静脈投与はドパミンD2受容体を有意に低下することを報告した9).この結果は,(S)-ケタミン投与により,前シナプスから顕著なドパミン放出が起きていることを示しており,ヒトにおける(S)-ケタミン静脈投与後の精神病症状惹起作用および解離症状23)と関連していると思われる.このように,ケタミンの副作用は,主にNMDA受容体が関与していることから,NMDA受容体への親和性が低い(R)-ケタミンは,(R, S)-ケタミンや(S)-ケタミンより副作用の少ない安全な抗うつ薬として有用であろう(表2)8)32).
著者らは2014年から,(R)-ケタミンが(S)-ケタミンより優れた抗うつ薬であることを報告したが28)35),ほとんど注目されなかった.しかしながら2016年5月に,米国メリーランド大学や米国国立衛生研究所(National Institute of Health:NIH)のグループは,(R)-ケタミンが(S)-ケタミンより抗うつ効果が強いことをNature誌に掲載し,われわれの論文を追試した33).この報告以来,多くの研究者が(R)-ケタミンの抗うつ効果に注目するようになった.その後,わが国の大正製薬株式会社のグループからも追試された5).
IV.(R)-ケタミンの抗うつ作用とNMDA受容体遮断作用
これまで,多くの研究者がケタミンの抗うつ効果は,NMDA受容体遮断作用によると信じていたが,ケタミン以外のすべてのNMDA受容体遮断薬が第III相臨床治験で失敗した.われわれは前臨床試験結果から,NMDA受容体への親和性が弱い(R)-ケタミンのほうが,(S)-ケタミンより抗うつ効果が強いことから,NMDA受容体遮断以外の薬理作用が起因していると推測している8)32).
最近,塩野義製薬株式会社の研究者が,機能的MRIを用いて,無麻酔ラットの脳活動における(R, S)-ケタミン,ケタミン異性体の効果を比較した.その結果,(S)-ケタミン投与後の脳活動は,(R, S)-ケタミンおよび選択的NMDA受容体遮断薬(+)MK-801投与後と類似していたが,(R)-ケタミン投与後の脳活動はまったく異なった18).この知見は,(R)-ケタミンの薬理作用に,NMDA受容体遮断作用は関係していない可能性を強く示唆した.またこの結果は,健常者を対象とした脳糖代謝へのケタミン異性体の影響を調べた結果と同じであった26).興味深いことに,この論文では,(S)-ケタミンは健常者において精神病症状惹起作用や解離症状を引き起こすが,同じ投与量の(R)-ケタミンはこのような症状を引き起こさず,逆にリラックスな症状をもたらしたことを報告した26).以上のことから,(R, S)-ケタミンの副作用は,主に(S)-ケタミンが寄与しており,(R)-ケタミンの寄与は低いと報告されている34).
つまり,ケタミンの抗うつ効果は,NMDA受容体遮断作用以外の薬理作用が寄与している可能性があると考え7)8)11)23),現在,研究を進めている.
V.動物実験結果がなぜ,ヒトで反映できないか?
上記で述べた多くの新規NMDA受容体遮断薬は,ラットやマウスなどのげっ歯類を用いた試験で,強制水泳試験や尾懸垂試験の無動時間(うつ症状を反映する絶望状態)を短縮することが報告され,抗うつ様効果を示す.しかしながら,うつ病患者を対象とした臨床治験では,すべて失敗している.すなわち,げっ歯類を用いたこれらの行動試験は,ほとんど臨床効果を予測できないことを示しており,これらの行動試験は意味がなく,すぐにでも中止すべきだという記事が,2019年7月のNature誌に掲載された21).著者も,これらの行動試験を使用しているが,ある程度同意する点もある.また国内外の研究者のなかには,うつ様行動を示さない動物を用いてケタミンや新規抗うつ薬候補化合物の評価を実施している研究者が多い.ケタミンは健常者に投与すると,抗うつ作用はなく,逆にアンヘドニアなどのうつ症状を引き起こすことが報告されている20).ケタミンやケタミン代謝物の抗うつ効果に関する論文が,研究室で再現できていない要因の1つには,モデル動物や行動評価にあるようだ10).
今回,この総説で議論しているケタミンは,すでにうつ病患者で素晴らしい抗うつ効果が証明されており,米国の精神科医であれば,ケタミンの抗うつ効果を疑う医師はいない.すなわち,うつ病患者で得られた知見をもとに,動物に戻して,どちらの光学異性体がケタミンの抗うつ効果の本体か?を研究してきた.結果は上記のとおりである.
おわりに
米国のケタミンクリニックでは,難治性うつ病に対して(R, S)-ケタミンの適応外使用が日常的に行われている.2019年3月5日,米国FDAは,Johnson & Johnson社の(S)-ケタミン点鼻薬を条件つきで承認した.一方,著者らは2014年以来,(S)-ケタミンに対する(R)-ケタミンの有用性を数多く報告してきた.現在,米国企業(Perception Neuroscience社)により(R)-ケタミンの臨床治験が海外で実施中であり,2020年には臨床治験の結果が判明するであろう.一方,われわれの特許は,中国や南米に出願していないため,中国の製薬企業2社が,(R)-ケタミン点鼻薬を難治性うつ病の治療薬として,中国において臨床治験を開始した.また最近ブラジルの研究者は,難治性うつ病患者に対する(R)-ケタミンの即効性抗うつ効果を報告した.日本での(R)-ケタミンの臨床治験はいまだ開始していないが,できるだけ早く臨床治験を開始したい.
これまで,麻酔薬(S)-ケタミンの精製過程で,ゴミとして捨てられていた(R)-ケタミンが,もしかしたら,画期的な抗うつ薬になるかもしれない.将来,(R)-ケタミンがうつ病患者で副作用の少ない即効性抗うつ効果を示し,うつ病患者に処方されることを切に願いながら,地道な研究を続けていきたい.
利益相反
著者は,特許「R-ケタミンおよびその塩の医薬品としての応用」(出願人:国立大学法人千葉大学)の発明者である.
謝 辞 本稿に引用した著者らの論文の共同研究者に深謝いたします.また本総説の内容の一部は,国立研究開発法人日本医療研究開発機構(AMED)の「脳科学研究戦略推進プログラム」(融合脳)の支援によって行われた.
1) Berman, R. M., Cappiello, A., Anand, A., et al.: Antidepressant effects of ketamine in depressed patients. Biol Psychiatry, 47 (4); 351-354, 2000![]()
2) Chang, L., Zhang, K., Pu, Y., et al.: Comparison of antidepressant and side effects in mice after intranasal administration of (R,S) -ketamine, (R) -ketamine, and (S) -ketamine. Pharmacol Biochem Behav, 181; 53-59, 2019![]()
3) DiazGranados, N., Ibrahim, L., Brutsche, N. E., et al.: A randomized add-on trial of an N-methyl-D-aspartate antagonist in treatment-resistant bipolar depression. Arch Gen Psychiatry, 67 (8); 793-802, 2010![]()
4) Domino, E. F.: Taming the ketamine tiger. 1965. Anesthesiology, 113 (3); 678-684, 2010![]()
5) Fukumoto, K., Toki, H., Iijima, M., et al.: Antidepressant potential of (R) -ketamine in rodent models: comparison with (S) -ketamine. J Pharmacol Exp Ther, 361 (1); 9-16, 2017![]()
6) Grunebaum, M. F., Galfalvy, H. C., Choo, T. H., et al.: Ketamine for rapid reduction of suicidal thoughts in major depression: a midazolam-controlled randomized clinical trial. Am J Psychiatry, 175 (4); 327-335, 2018![]()
7) Hashimoto, K.: Ketamine's antidepressant action: beyond NMDA receptor inhibition. Expert Opin Ther Targets, 20 (11); 1389-1392, 2016
8) Hashimoto, K.: Letter to the Editor: R-ketamine: a rapid-onset and sustained antidepressant without risk of brain toxicity. Psychol Med, 46 (11); 2449-2451, 2016![]()
9) Hashimoto, K., Kakiuchi, T., Ohba, H., et al.: Reduction of dopamine D2/3 receptor binding in the striatum after a single administration of esketamine, but not R-ketamine: a PET study in conscious monkeys. Eur Arch Psychiatry Clin Neurosci, 267 (2); 173-176, 2017![]()
10) Hashimoto, K., Shirayama, Y.: What are the causes for discrepancies of antidepressant actions of (2R, 6R)-hydroxynorketamine? Biol Psychiatry, 84 (1); e7-8, 2018
11) Hashimoto, K.: Rapid-acting antidepressant ketamine, its metabolites and other candidates: a historical overview and future perspective. Psychiatry Clin Neurosci, 73 (10); 613-627, 2019![]()
12) Heifets, B. D., Malenka, R. C.: Disruptive psychopharmacology. JAMA Psychiatry, 76 (8); 775-776, 2019
13) Jauhar, S., Morrison, P.: Esketamine for treatment resistant depression. BMJ, 366; I5572, 2019
14) Kaur, U., Pathak, B. K., Singh, A., et al.: Esketamine: a glimmer of hope in treatment-resistant depression. Eur Arch Psychiatry Clin Neurosci, 2019 (Epub ahead of print)
15) Kishimoto, T., Chawla, J. M., Hagi, K., et al.: Single-dose infusion of ketamine and non-ketamine N-methyl-d-aspartate receptor antagonists for unipolar and bipolar depression: a meta-analysis of efficacy, safety and time trajectories. Psychol Med, 46 (7); 1459-1472, 2016![]()
16) Krystal, J. H., Karper, L. P., Seibyl, J. P., et al.: Subanesthetic effects of the noncompetitive NMDA antagonist, ketamine, in humans. Psychotomimetic, perceptual, cognitive, and neuroendocrine responses. Arch Gen Psychiatry, 51 (3); 199-214, 1994
17) Krystal, J. H., Abdallah, C. G., Sanacora, G., et al.: Ketamine: a paradigm shift for depression research and treatment. Neuron, 101 (5); 774-778, 2019
18) Masaki, Y., Kashiwagi, Y., Watabe, H., et al.: (R) - and (S) -ketamine induce differential fMRI responses in conscious rats. Synapse, 73 (12); e22126, 2019![]()
19) Newport, D. J., Carpenter, L. L., McDonald, W. M., et al.: Ketamine and other NMDA antagonists: early clinical trials and possible mechanisms in depression. Am J Psychiatry, 172 (10); 950-966, 2015![]()
20) Nugent, A. C., Ballard, E. D., Gould, T. D., et al.: Ketamine has distinct electrophysiological and behavioral effects in depressed and healthy subjects. Mol Psychiatry, 24 (7); 1040-1052, 2019![]()
21) Reardon, S.: Depression researchers rethink popular mouse swim tests. Nature, 571 (7766); 456-457, 2019![]()
22) Sanacora, G., Frye, M. A., McDonald, W., et al.: A consensus statement on the use of ketamine in the treatment of mood disorders. JAMA Psychiatry, 74 (4); 399-405, 2017![]()
23) Singh, J. B., Fedgchin, M., Daly, E., et al.: Intravenous esketamine in adult treatment-resistant depression: a double-blind, double-randomization, placebo-controlled study. Biol Psychiatry, 80 (6); 424-431, 2016![]()
24) Tian, Z., Dong, C., Fujita, A., et al.: Expression of heat shock protein HSP-70 in the retrosplenial cortex of rat brain after administration of (R,S)-ketamine and (S)-ketamine, but not (R)-ketamine. Pharmacol Biochem Behav, 172; 17-21, 2018![]()
25) Turner, E. H.: Esketamine for treatment-resistant depression: seven concerns about efficacy and FDA approval. Lancet Psychiatry, 6 (12); 977-979, 2019![]()
26) Vollenweider, F. X., Leenders, K. L., Oye, I., et al.: Differential psychopathology and patterns of cerebral glucose utilisation produced by (S)- and (R)-ketamine in healthy volunteers using positron emission tomography (PET). Eur Neuropsychopharmacol, 7 (1); 25-38, 1997![]()
27) Wilkinson, S. T., Ballard, E. D., Bloch, M. H., et al.: The effect of a single dose of intravenous ketamine on suicidal ideation: a systematic review and individual participant data meta-analysis. Am J Psychiatry, 175 (2); 150-158, 2018![]()
28) Yang, C., Shirayama, Y., Zhang, J. C., et al.: R-ketamine: a rapid-onset and sustained antidepressant without psychotomimetic side effects. Transl Psychiatry, 5; e632, 2015![]()
29) Yang, C., Han, M., Zhang, J. C., et al.: Loss of parvalbumin-immunoreactivity in mouse brain regions after repeated intermittent administration of esketamine, but not R-ketamine. Psychiatry Res, 239; 281-283, 2016![]()
30) Yang, C., Qu, Y., Fujita, Y., et al.: Possible role of the gut microbiota-brain axis in the antidepressant effects of (R)-ketamine in a social defeat stress model. Transl Psychiatry, 7 (12); 1294, 2017![]()
31) Yang, C., Ren, Q., Qu, Y., et al.: Mechanistic target of rapamycin-independent antidepressant effects of(R)-ketamine in a social defeat stress model. Biol Psychiatry, 83 (1); 18-28, 2018![]()
32) Yang, C., Yang, J., Luo, A., et al.: Molecular and cellular mechanisms underlying the antidepressant effects of ketamine enantiomers and its metabolites. Transl Psychiatry, 9 (1); 280, 2019![]()
33) Zanos, P., Moaddel, R., Morris, P. J., et al.: NMDAR inhibition-independent antidepressant actions of ketamine metabolites. Nature, 533 (7604); 481-486, 2016![]()
34) Zanos, P., Moaddel, R., Morris, P. J., et al.: Ketamine and ketamine metabolite pharmacology: insights into therapeutic mechanisms. Pharmacol Rev, 70 (3); 621-660, 2018![]()
35) Zhang, J. C., Li, S. X., Hashimoto, K.: R(-)-Ketamine shows greater potency and longer lasting antidepressant effects than S (+) -ketamine. Pharmacol Biochem Behav, 116; 137-141, 2014![]()